La greffe intracérébrale : comprendre et combattre le rejet.
Publié le 25 octobre 2012 à 07:46Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
La maladie de Parkinson est une maladie progressive caractérisée par la dégénérescence bilatérale des neurones dopaminergiques de la voie nigrostriée. La destruction des neurones dopaminergiques de la substance noire a pour conséquence une diminution de la sécrétion de dopamine au niveau du striatum.
Actuellement, il n’existe pas de traitement curatif de la maladie, mais différents traitements symptomatiques sont utilisés. L’administration par voie orale de L‑DOPA (lévodopa), précurseur de la dopamine capable de traverser la barrière hémato-encéphalique, est l’un des traitements les plus couramment prescrits. Un inconvénient majeur de la prise de L‑DOPA est l’apparition, au bout de quelques années, de dyskinésies (mouvements anormaux). Une autre stratégie basée sur la stimulation électrique du noyau subthalamique, montre une efficacité sur les troubles moteurs, dans la plupart des cas, mais les risques chirurgicaux et les critères d’inclusion en font une opération accessible à un très faible nombre de patients. De plus, de nombreux symptômes ne sont pas corrigés par ces thérapies.
Aussi, il apparaît important de poursuivre les recherches sur les stratégies restauratrices, notamment la greffe intracérébrale de neuroblastes.
Des neuroblastes mésencéphaliques issus d’embryons humains (8 à 9 semaines) et transplantés dans le striatum de patients parkinsoniens ont conduit à des améliorations cliniques basées, entre autres, sur la production de dopamine par les neurones greffés. Cependant, le recours à des embryons humains est freiné par des considérations éthiques et logistiques qui limitent l’accès à ces greffes. D’où l’intérêt d’utiliser des neuroblastes d’origine animale telle que le porc. En effet, le porc présente de nombreux avantages pour la xénotransplantation : un grand nombre d’embryons à chaque portée, une facilité d’élevage, la possibilité de contrôler la reproduction des animaux et de pouvoir pratiquer des manipulations génétiques. De plus, son cerveau étant de grande taille, les neurones porcins ont la capacité d’émettre des neurites sur de longues distances comme chez l’Homme. Une survie des cellules greffées, une réinnervation du striatum ainsi qu’une récupération des fonctions motrices ont été observées lors d’essais cliniques menés chez certains patients parkinsoniens traités par des immunosuppresseurs (molécules permettant de limiter l’activité du système immunitaire). Mais le problème rencontré reste le rejet de ces greffes.
En effet, en l’absence d’immunosuppresseur comme la cyclosporine A, les greffes de neuroblastes porcins dans le striatum de rat sont systématiquement rejetées au bout de 7 – 8 semaines. Les traitements par des immunosuppresseurs prolongent la survie de la greffe, mais de manière transitoire, de plus, utilisés à fortes doses, ceux-ci entraînent des effets secondaires, notamment une toxicité rénale. Il est donc important de comprendre et d’étudier les mécanismes en cause dans le rejet pour envisager une survie à long terme de la greffe.
Diverses études ont mis en évidence un rôle important de la réponse immunitaire cellulaire dans le rejet. En effet, en l’absence d’immunosuppresseur, on observe vers 7 à 8 semaines, une forte infiltration de la greffe par des lymphocytes T et des cellules dendritiques. Cette réaction immune est accompagnée d’une activation des cellules microgliales. Elle a pour conséquence le rejet de la greffe.
Outre la réponse cellulaire, il a été observé un dépôt d’anticorps et de complément au niveau du greffon. Cette observation suggère une réponse humorale, caractérisée par la production d’anticorps, dirigés contre la greffe, qui, à ce jour, a été très peu étudiée.
Une partie de mon travail au sein de l’INSERM U1064 de Nantes a eu pour but de caractériser le rôle de la réponse humorale dans le rejet des xénogreffes intracérébrales.
Les anticorps produits suite à la greffe vont venir se fixer sur les cellules porcines du greffon et le détruire. Nous avons pu mettre en évidence que la production d’anticorps augmentait en fonction du délai post greffe et du statut de la greffe. En particulier, une forte concentration d’anticorps est observée dans le sérum de rats pour qui la greffe est rejetée. Ces anticorps ayant la capacité de cibler différentes populations cellulaires telles que les neurones et les astrocytes.
Evolution de la production d’anticorps au cours des différents stades du rejet.
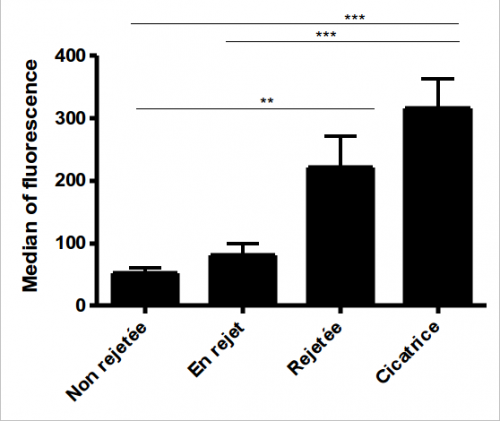
De plus, des résultats préliminaires ont montré une meilleure survie des xénogreffes dans des modèles de rats dépourvus d’anticorps. Ces données vont donc dans le sens d’un rôle de la réponse humorale dans le phénomène de rejet même s’il est important de confirmer ce résultat sur un plus grand nombre d’animaux.
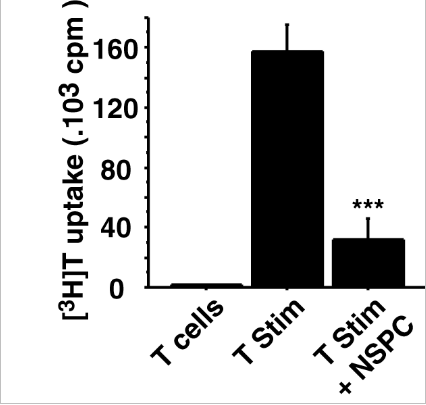
Une autre partie de mon travail a été d’envisager de nouvelles stratégies immunosuppressives afin de limiter le rejet, en particulier, par l’étude des propriétés immunosuppressives des cellules souches neurales. En effet, outre leur capacité de prolifération et de différenciation en neurones, une production de molécules immunomodulatrices par les cellules souches neurales permettrait d’induire au niveau du site de greffe une immunosuppression locale, limitant le recours à des immunosuppresseurs systémiques. Une première étude nous a permis de mettre en évidence que les cellules souches neurales de rat (NSPC) avaient des propriétés immunosuppressives limitant la prolifération des lymphocytes T, et que cet effet s’effectuait via l’hème oxygénase.
Inhibition de la prolifération des lymphocytes T par les cellules souches neurales de rat.
La suite de ce travail va se focaliser sur les propriétés immunosuppressives des populations de cellules souches neurales humaines dérivées d’IPSC (induced pluripotent stem cells). Cette étude est d’autant plus importante que l’utilisation des cellules souches neurales dérivées d’IPSCs humaines est une des voies thérapeutiques envisagées pour effectuer des auto- ou des allotransplantations à grande échelle. En effet, ces cellules sont issues de la reprogrammation de cellules somatiques adultes (ex : cellules de la peau) en cellules pluripotentes capables de s’auto-renouveler et de se différencier en différents types cellulaires. Elles peuvent donc être prélevées chez le patient pour être reprogrammées, différenciées en cellules souches neurales avant d’être greffées dans le cerveau de ce même patient (autogreffe).
La transplantation intracérébrale reste donc une thérapie prometteuse pour la maladie de Parkinson. Une meilleure compréhension des phénomènes du rejet et du potentiel immunosuppressif des cellules souches permettra d’envisager une survie à long terme de la greffe.
Je tenais à remercier tous les membres de l’association CECAP pour leur soutien dans la réalisation de ce travail.
Réalisé par Elodie Mathieux
Pas encore de Commentaires Cliquer ici pour laisser un commentaire
Laisser un commentaire
Flux RSS des commentaires de cet article. Rétrolien URI
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.