Témoignage : Ballade en montagne…
Publié le 08 avril 2008 à 07:49Article paru dans Le Parkinsonien Independant N°32 – mars 2008
Chaque lundi, Alain me propose des randonnées en montagne avec un groupe d’amis. Parfois, il nous entraîne aux techniques de l’escalade avec baudrier et corde1. Il a toujours en esprit que je suis sujet au vertige depuis que je me soigne pour Parkinson.
Il me met en situation de vaincre cette phobie du vide et de fait, lorsque je suis harnaché et sécurisé par la corde de rappel, cette appréhension disparaît : je peux profiter pleinement du paysage.
Pourtant la semaine dernière, nous avons vécu une situation un peu exceptionnelle que je voudrais vous rapporter pour dire à quel point l’esprit peut dominer les réactions physiques.
Nous devions rejoindre le sommet de la Sainte Victoire, célèbre montagne qui domine Aix en Provence, par une voie un peu périlleuse mais sans grosse difficulté. Pourtant, il y a deux ans, au début de nos pérégrinations, j’avais callé dans cette voie à un passage un peu délicat : le pas de l’éléphant. Je le franchis sans m’en rendre compte malgré une petite appréhension imaginaire. Je suivais avec bonheur le rythme de mes compagnons et nous arrivâmes sur le plateau du sommet.
Pour redescendre, nous recherchâmes, alors, le passage connu d’Alain qui devait nous permettre de rejoindre aisément la voiture. Manque de chance, les repères avaient été supprimés ou nous les avions dépassés ; il décida alors de ne pas prolonger plus longtemps notre randonnée sur le plateau : il commençait à se faire un peu tard.
Il nous averti que nous allions prendre une voie raccourcie mais qui présentait des difficultés un peu particulières : il serait obligé de nous assurer et nous demandait de respecter fermement ses consignes. Il s’agissait du Grand Couloir.
Imaginez une entaille large d’à peine deux mètres dans une falaise de plus de 100 mètres d’à‑pic et d’où vous découvrez la plaine 700 mètres en dessous ! Et nous allions nous engager, accrochés à des chaînes sans voir où nous atterrissions…
Bonjour l’ambiance : je sentais l’angoisse monter. Elle risquait de me faire perdre tous mes moyens si je me laissais aller. Alain me demanda de le suivre de près et m’encorda pour m’assurer. Je me raisonnais alors ne voulant pas paraître renâcler devant l’obstacle ; et puis j’avais entièrement confiance dans mon guide.
Heureusement, parce que nous n’étions pas au bout de nos peines. Juste après deux chaînes d’une vingtaine de mètres, nous trouvions un câble fixé en garde-corps pour une traversée de la paroi en diagonale, les pieds trouvant tout juste la place de se glisser sur un léger redan dominant un à‑pic vertigineux de 60 mètres lisse comme un mur !
Rassuré par les consignes d’Alain, j’effectuais tranquillement cette traversée que je n’aurais jamais imaginée faire. Mais le passage le plus délicat, pour moi, fût la suite où les embûches pourtant n’étant pas aussi importantes. Nous progressions sur un étroit sentier tout en corniche pour rejoindre un épaulement rocheux d’où nous descendrions alors sans problème et je ressentais alors la montée du vertige.
Pourquoi cette appréhension ? J’y vois deux causes : tout d’abord le contrecoup de l’émotion causée par la technique particulière et les « peurs » rétrospectives plus ou moins imaginaires. Mais aussi et surtout, l’absence de points de réconfort (chaîne et câble) matérialisés.
Cela me permet d’affirmer quelle pression importante peut être exercée par notre cerveau sur notre corps et nos attitudes. Notre imaginaire a des pouvoirs que l’on ne conçoit pas toujours : il faut savoir le contrôler. D’ailleurs, dans la nuit qui suivit, je fis un rêve semi éveillé où je me voyais accroché à la paroi avec la peur de paniquer !
J’ai voulu raconter cette petite aventure non pas pour me vanter mais pour dire combien il nous est possible, en cas de coup dur, de réagir et dominer nos craintes et même nos difficultés physiques.
Ce n’est pas en fuyant nos problèmes que nous les résolvons, mais bien au contraire en s’y préparant et en les affrontant vigoureusement.
« La confiance dans le mouvement est égal à la compétence qu’on se reconnait plus le plaisir escompté moins le risque escompté »
(Didier Delignères)
Par Jean GRAVELEAU graveleau.jean2@wanadoo.fr
Informations médicales
Publié le 08 avril 2008 à 07:37Article paru dans Le Parkinsonien Indépendant n° 32 mars 2008
Des Chercheurs traquent les origines de Parkinson
d’après un article d’Ouest-France Régional du 11/12/07
À l’initiative de CECAP RECHERCHE, André FOUQUET du journal Ouest-France a rencontré les équipes INSERM U 643 et U 913 pour une interview sur les recherches menées à Nantes et subventionnées par le fonds Recherche de CECAP
UNITÉ 643
XÉNOGREFFE : CECAP a subventionné le début de cette recherche qui se poursuit. Pour s’affranchir du problème éthique posé par la greffe de neurones embryonnaires issus d’IVG , l’équipe a mis au point une lignée de porcs transgéniques dont les neurones seront implantés dans les cerveaux de rats rendus parkinsoniens.
Les neurones fonctionnent, mais, au bout d’un mois, les défenses immunitaires du rat les détruisent. Donc en ce moment l’équipe sous la direction de Philippe NAVEILHAN traque la molécule qui évitera le rejet.
RAT TRANSGÉNIQUE ɑ SINUCLÉINE : création et développement d’un modèle de rat dont le
Parkinson se rapprochera le plus possible de la maladie humaine.
Cécile BOYER (subventionnée par CECAP), sous la direction de Laurent LESCAUDRON surveille l’installation et l’évolution de la maladie.
« il faut absolument comprendre la logique de la cascade d’éléments délétères qui se produisent avant l’apparition des premiers symptômes » pour pouvoir un jour enrayer la maladie.
UNITÉ 913
Deux jeunes chercheurs : Tanguy CHAUMETTE (subvention par CECAP) et Thibaud LEBOUVIER sous la direction de Michel NEUNLIST s’efforcent de vérifier l’hypothèse récente de l’Allemand BRAAK à savoir que :
Dans la maladie de Parkinson les intestins pourraient être atteints avant le cerveau. Cet hypothèse de recherche s’appuie sur les observations suivantes :
- Au cours de l’Évolution, les êtres vivants ont acquis un système nerveux entérique (SNE) – ou digestif – bien avant que les fonctions nerveuses soient centralisées dans le crâne.
- Ce 2ème cerveau fonctionne toujours
- Le tube digestif (de l’œsophage au rectum) possède 100 millions de neurones et un milliard de cellules gliales.
- La maladie de Parkinson s’accompagne de troubles digestifs.
« Si l’on arrive à mieux comprendre l’origine et l’évolution de la maladie, il deviendra possible de poser un diagnostic beaucoup plus tôt, de mieux traiter les troubles digestifs et, peut-être, de mettre au point un traitement neuroprotecteur plus précoce et donc plus efficace »
Ces deux équipes échangent leurs informations et l’on peut dire que les instestins de rats transgéniques sont aussi étroitement surveillés que leurs cerveaux.
Jacqueline GÉFARD-LE BIDEAU
Xénogreffe : transplantation entre espèces différentes
Neurones : Cellules nerveuses différenciées et spécialisées dans le transfert d’information
Cellules gliales : transmission de l’influx nerveux (notamment)
Éditorial
Publié le 07 avril 2008 à 06:32Paru dans Le Parkinsonien Indépendant N°32 – mars 2008
Nous venons d’apprendre le décès volontaire de l’un de nos amis atteint de la maladie de Parkinson. Il avait été neurostimulé mais n’avait jamais retrouvé le plein exercice de ses moyens et sans doute ne l’a‑t-il plus supporté. Que sa femme et ses enfants sachent combien nous partageons leur douleur et voulons leur apporter notre soutien.
Pour les bien-portants ou les « bien dosés », il est sans doute difficile de comprendre que l’on puisse prendre une décision si définitive. Mais nous ne savons pas quelle serait notre attitude dans une situation qui nous dépasse, nous envahi.
Il n’est pas toujours facile de vivre au jour le jour avec ce poids et cette pression s’exercant sur nous jour après jour. Cependant nous avons des ressources en nous qu’il nous faut aller chercher au plus profond de nous-mêmes : elles nous permettent de réagir et de lutter pour donner moins prise à Parkinson.
Nous avons le souci de ne rien celer des difficultés inhérentes à cette maladie et nous évoquons deux sortes de difficultés spécifiques : le bruxisme et les hallucinations. Mais nous devons lutter pied à pied et garder espoir d’un mieux être possible. Des chercheurs nous disent leur volonté de trouver des réponses. Un poète décrit sa joie de courir. Je vous donne aussi une expérience qui m’est arrivée dans une balade en montagne.
Essayons de ne pas perdre le contrôle de notre vie. Gardons espoir pour tous les êtres chers qui nous entourent et qui comptent sur nos forces pour mieux vivre avec ce fidèle compagnon.
Le printemps est là, tout proche ; que la renaissance de la nature nous remplisse d’espoir et nous donne la force de vivre !
Bon courage et une fois encore notre soutien le plus sincère à tous !
Jean GRAVELEAU
graveleau.jean2@orange.fr
Un Nouveau Congé pour pour prendre soin d’un Parent Dépendant
Publié le 20 janvier 2008 à 13:48Article paru dans LE PARKINSONIEN INDÉPENDANT N°31 –décembre 2007
Un décret autorisant les salariés à prendre un congé de soutien familial pour s’occuper d’un parent dépendant ou très handicapé est paru au Journal Officiel début 2007.
Trois mois renouvelables
Pour bénéficier du congé de soutien familial d’une durée de 3 mois renouvelable dans la limite d’un an, le salarié devra prévenir son employeur au moins 2 mois auparavant. Il joindra à sa demande : les documents attestant de son lien de parenté avec la personne à aider et la preuve de la dépendance de celle-ci (décision de l’attribution de l’Allocation Personnalisée d’Autonomie (A.P.A.), ou justification d’un taux d’incapacité permanente au moins égal à 80%.
Urgence et Préavis
Le délai de la demande est ramené à 15 jours, en cas d’urgence liée notamment à une dégradation soudaine de l’état de santé de la personne à aider. S’il veut renouveler son congé, le salarié doit en prévenir son employeur avec un préavis d’un mois.
Non rémunéré
Ce congé qui ne peut être refusé, n’est pas rémunéré, mais le salarié continue à acquérir des droits à la retraite via l’assurance vieillesse du parent au foyer, comme, notamment, c’est le cas pour la retraite des parents d’enfants handicapés.
Le salarié, pour bénéficier de ce congé, doit avoir une ancienneté de deux ans dans l’entreprise.
Il a la garantie de retrouver, au terme de son congé, son emploi ou un emploi équivalant dans son entreprise.
Le ministère de la Santé et des Solidarités a annoncé une mise en ligne du Guide de l’Aidant Familial sur le site internet : www.famille.gouv.fr
Pour tous renseignements complémentaires, adressez-vous à une Assistante Sociale ou au C.C.A.S. (Comité d’Action Sociale) de votre mairie
d’après Presse-Océan
Lu par Jacqueline GÉFARD-LE BIDEAU
Débat sur la prise en charge financière des affections longues durées (ALD)
Publié le 20 janvier 2008 à 13:46Article paru dans LE PARKINSONIEN INDÉPENDANT N°31 –décembre 2007
Maladies longues : débat sur la prise en charge à 100%
Coûteux et pas forcément équitable, le régime des affections de longue durée concerne 7.4 millions de patients qui y sont très attachés.
« Ce dispositif est condamné », prophétise un responsable du monde de la santé, au sujet des affections de longue durée (ALD). On n’en est pas encore là. Mais les voix se multiplient pour souligner la nécessité de réfléchir à l’avenir de ce régime qui exonère les personnes atteintes d’une maladie longue et coûteuse, de tout ticket modérateur. Autrement dit, qui rembourse à 100% les soins de ces patients atteints de diabète, d’hypertension, de cancer, du sida, d’Alzheimer, de Parkinson ou encore d’une maladie psychiatrique chronique ou d’une cirrhose.
En envisageant sérieusement d’appliquer, d’ici à quelques années, un « bouclier sanitaire », François Fillon soulève implicitement le problème. En effet, « l’idée consiste à substituer aux régimes actuels », en particulier celui de l’ALD, « un plafonnement unique » des dépenses de santé non remboursées par la Sécu, « fonction du revenu », explique Martin HIRSH, ardent promoteur de ce bouclier.
« L’ALD sera percutée par le bouclier sanitaire », confirmait Roselyne BACHELOT, avant-hier, expliquant pourquoi aucune économie du plan d’urgence ne concernait les maladies longues. « On n’y touche pas pour ne pas préempter le débat », dit le Ministre de la Santé. Le Haut Conseil pour l’avenir de l’Assurance Maladie s’est penché sur les ALD dès 2005. La Haute Autorité de Santé y travaille.
Hier, c’est la Caisse nationale d’Assurance Maladie qui est venue alimenter le débat, en dévoilant ses projections à l’horizon 2015. La CNAM estime que, si les tendances actuelles se poursuivent, les dépenses de santé remboursées par la Sécu atteindront alors 210 milliards, soit 50% de plus que maintenant ! Pour les couvrir, il faudrait des recettes supplémentaires (l’équivalent d’un point de CSG tous les 5 ans), ou réduire de 20%les remboursements, ou encore transférer les nouvelles dépenses aux complémentaires, dont les cotisations grimperaient alors de 10ù par an. Difficile à envisager…
« Optimiser les dépenses »
Or, au rythme actuel, les ALD représenteront 70% des remboursements en 2015, contre 60% actuellement et 50% en 1992. La dépense par malade de longue durée progresse certes au même rythme que les autres, mais elle est nettement plus élevée (7 450 euros annuels par personne en ALD contre 1 050 pour les autres assurés d’après le Haut Conseil). Et les effectifs en ALD s’étendent, à cause du vieillissement de la population, de la progression de la maladie comme le diabète ou tout simplement de leur meilleure détection (c’est le cas du cancer de la prostate). Pour le seul régime général, de 7.4 millions de personne concernés en 2005, on passerait à 11 millions dix ans plus tard !
Le régime des ALD, extrêmement coûteux, n’est toujours pas équitable. Les critères d’admission dans la liste des 30 maladies concernées ne sont pas appliquées avec la même rigueur par tous les médecins. Et certains Assurés, frappés par une maladie hors liste peuvent sortir de leur poche des sommes importantes. De même certains patients en ALD ont des « reste à charge » élevés pour des soins sans lien avec leur longue maladie et donc non remboursés à 100%.
La CNAM tire ses propres conclusions de ces observations. Pour son Directeur, « la priorité n’est pas de changer le périmètre de prise en charge, avec par exemple des franchises, ou de trouver de nouvelles recettes, comme une TVA sociale. Il faut plutôt optimiser les dépenses de santé ». Frédéric van Roekeghem cite trois axes : mieux prévenir, ces pathologies grâce notamment aux campagnes de dépistage, mieux suivre les maladies chroniques (l’Inspection des Affaires Sociales est allée étudier à l’étranger le « disease management »), et accroître l’efficience du système de soins, par exemple en cessant d’accueillir aux urgences hospitalières des cas qui relèvent plutôt du généraliste de garde.
Le Figaro – 6 juillet 2007
Lu pour vous par Pierre LEMAY
Association de La Manche
L’Assemblée Générale et la semaine de vacances 2007 de l’Association des Parkinsoniens de la Manche
Publié le 17 janvier 2008 à 10:21Paru dans LE PARKINSONIEN INDÉPENDANT N°31 – décembre 2007
L’Assemblée Générale et la semaine de vacances 2007 (informations/tourisme) à Hauteville sur Mer (50)
Le Président de l’Association des Parkinsoniens de la Manche : Daniel Le Beurier (en deux mots et un seul R s’il vous plaît) est assez têtu et lorsqu’il a une idée en tête il est impatient de la voir se réaliser, un Normand vaut deux Bretons dit-il (ceux qui ne sont pas d’accord peuvent lui envoyer leurs critiques à son adresse qui figure en dernière page). Nous étions en général une bonne dizaine de la Manche à participer aux semaines de vacances organisés depuis quelques années par CECAP à l’occasion de l’Assemblée générale, après chaque séjour Daniel évoquait un peu plus l’idée de l’organiser dans le département. Nous avons fini par céder et nous sommes partis à l’aventure. Nous ne savions pas trop dans quelle aventure nous partions, c’est un travail de longue haleine où il faut penser à beaucoup de choses au moins 6 mois à l’avance, il faut trouver un lieu de séjour, des visites intéressantes, des idées pour les soirées, des conférenciers intéressants… sans oublier la chasse aux subventions, tout ceci sans trop connaître le nombre de participants. Pour l’essentiel et même le superflu, nous n’avons pas oublié grand-chose et le résultat final a été un bon moment, avec peut-être un léger reproche : il y avait trop d’activités.
Presque 50 personnes ont participé à la semaine entière, certains départements avaient fait très forts dans la participation (merci Françoise) et nous étions près de 120 personnes pendant les deux jours de l’Assemblée Générale. L’ambiance a été bonne, avec beaucoup de rires et de sourires, nous avons aussi beaucoup chanté.
Les bungalows au milieu des pins ont été appréciés de tous, le restaurant et la nourriture également.
Les deux journées consacrées à la prise en charge sociales médicale et psychologique de la maladie de Parkinson ainsi qu’à l’aide aux aidants ont été denses sans trop de temps pour respirer. Trois moments forts ont retenu l’attention : l’exposé de Madame Biré du Conseil Général relatif à l’aide sociale, celui du docteur Busson relatif aux pompes à Apokinon et Duodopa ainsi que celui du docteur Lecavorzin relatif au relevé automatique des symptômes.
Le tourisme n’avait pas été oublié : la route de la table, les jardins d’Argences, Villedieu, les plages du débarquement, le logis d’Equilly.
Il faut aussi parler de l’animation des soirées, il y a eu de bons et même de très bons moments :
- La musique folk avec le groupe à Richard (qui, malgré sa maladie, continue de jouer du violon et de l’accordéon) sans oublier les chœurs du Morbihan
- Les jeux avec la superbe prestation de Madeleine
- La soirée danse dont beaucoup se souviendront
- Le loto dont la participation financière de chacun a été envoyée à CECAP Recherche.
Globalement, les participants sont repartis un peu fatigués mais avec la joie et le sourire aux lèvres. L’année prochaine c’est au tour de l’Association du Finistère d’organiser ces vacances, à Loctudy paraît-il, nous leurs souhaitons bon courage et nous espérons nous retrouver encore plus nombreux pour faire la fête. Nous comptons sur les participants aux vacances de la Manche pour faire la publicité qui convient.
Le bureau de l’Association de la Manche
Daniel, Claude, Jean-Claude, Arthur, Pierre…
Quels traitements médicamenteux pour nos malades parkinsoniens ?
Publié le 17 janvier 2008 à 10:05Article paru dans LE PARKINSONIEN INDÉPENDANT N°31 –décembre 2007
Rédigé par De la FOURNIERE F, GICQUEAU M, DEHORNE M,
C’est au moment où les médias nous inondent d’une information anticipée, à savoir la promotion prochaine d’un patch antiparkinsonien auréolé d’une autorisation de mise sur le marché européenne que Madame DEHORNE me demande d’essayer d’écrire une modeste synthèse sur les rapports entre la thérapeutique anti-parkinsonienne et le stress oxydant…
Vaste gageure
1) Moyens thérapeutiques à la phase initiale de la maladie de Parkinson :
Il n’existe actuellement aucun traitement curatif de la maladie de Parkinson idiopathique. Depuis 30 ans, les traitements dopaminergiques ont transformé, il faut le dire, au moins à ce stade, la prise en soins de nos patients avec comme référence la L DOPA. Nous parlerons ici surtout de cette famille puisqu’il s’agit de la pierre angulaire (1) des traitements symptomatiques antiparkinsoniens.
En dehors de la forme standard (LEVODOPA ou CARBIDOPA) sont apparues des formes à libération prolongée puis des formes dispersibles. La réponse à la L DOPA par la preuve de son efficacité fait partie de la triade symptomatique de la maladie de Parkinson idiopathique ; elle constitue donc un critère de diagnostic positif et a démontré son efficacité à réduire la mortalité. Cependant des complications motrices (1) à type de fluctuations motrices et de dyskinésies apparaissent très fréquemment dans 86 % des cas après la période de « lune de miel ». C’est pourquoi chez le sujet jeune on privilégiera les agonistes dopaminergiques le plus longtemps possible avant le recours à la dopathérapie. Ces médicaments sont moins neurotoxiques que la L DOPA en théorie et peuvent donc différer l’heure de la L DOPA pendant environ 3 à 5 ans (12ème congrès international de la maladie de Parkinson).
Néanmoins chez le sujet jeune (1), la posologie de L DOPA devra rester la plus faible possible initialement.
Chez le sujet âgé de plus de 65 ans (2), la règle est avant tout d’être le plus efficace possible pour lever la gêne fonctionnelle et on préférera pour ces raisons la L DOPA d’emblée en monothérapie.
2) Thérapeutiques médicamenteuses à la phase évoluée de la maladie de Parkinson :
Il s’agit d’envisager principalement le problème des fluctuations motrices ou dyskinésies invalidantes comme nous l’avons vu en 1ère partie. En effet la capacité de stockage de la DOPAMINE dans les neurones pré-synaptiques va diminuer au fur et à mesure de la maladie (3). Il est possible alors d’adjoindre à la L DOPA d’autres traitements, un agoniste dopaminergique s’il n’a pas été utilisé, de l’APOMORPHINE sous-cutanée, un inhibiteur de la COMT s’il n’a pas été utilisé plus tôt là aussi. En se recentrant sur l’utilisation de la seule L DOPA, notre impression clinique (4 et 5) est que les cliniciens ayant effectué un sous-dosage médicamenteux inefficace, recommandé d’ailleurs au début de la maladie, peuvent être tentés par un sur-dosage, entraînant par l’effet inverse des mouvements involontaires. En particulier chez les malades dont la maladie a débuté avant 50 ans, il est difficile d’imposer un léger sous-dosage car ces patients sont encore en activité professionnelle (6).
Toujours est-il que si la recherche d’une dose minimale efficace a été effectuée au stade précoce, avec une posologie de 300 à 500 mg (7) par jour de L DOPA, on peut éviter ces dyskinésies qui apparaissent particulièrement quand il existe des pics plasmatiques en LEVO DOPA (8). Si l’on continue dans l’évolution de la maladie, nous avons prouvé (4) que pour une durée de maladie supérieure à 9 ans, avec posologie de plus en plus élevée de plus 875 mg par jour de L DOPA, le taux d’enzymes détoxifiantes (GLUTATHION PEROXYDASE PLAQUETTAIRE) devient significativement abaissé. L’âge seul n’est pas une variable explicative (4) quant à ces diminutions de l’enzyme considérée, sorte « d’éboueur » de radicaux libres.
Il existe en effet de nombreux arguments en faveur d’un effet toxique de la L DOPA, favorisant la maladie de Parkinson. La L DOPA accroîtrait le stress oxydant lui même éventuellement causal de la maladie (9).
Au total, le coût socio-économique de ces dyskinésies paraît très important (10).
Dans l’avenir le choix d’autres formes d’administration de la L DOPA devra non seulement « améliorer la bio-disponibilité et la pharmacocinétique de ce médicament mais faciliter le respect de la prescription. Par le contrôle des concentrations plasmatiques et centrales pourrait être personnalisée une dopathérapie spécifique des parkinsoniens qui connaissent des fluctuations » (11).
Cette dimension chronobiologique est également indiquée par d’autres auteurs (12).
A titre d’illustration sur un cas, non généralisable donc, nous rapportons en histogramme cette histoire singulière : chute brutale de la dopamine circulante (cf. graphique ci-dessous) dès augmentation posologique modérée (62,5 mg de L DOPA en plus) en deux temps (au bout d’un puis de deux ans) de la L DOPA. Il n’y a plus d’éboueur de radicaux libres efficace et le médicament n’est plus du tout actif, avec un niveau de posologie (et de dosage sanguin) élevés et il n’entraîne que des effets secondaires.
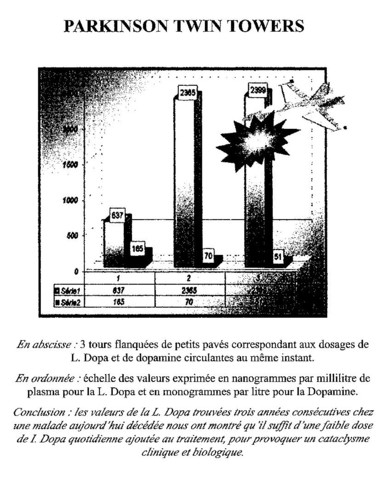
3) Quelle posologie de L DOPA chez nos malades ?
En attente des progrès de la chronobiologie, seuls des essais thérapeutiques prospectifs randomisés sur des études longitudinales permettraient d’affirmer avec force le caractère aggravant de la L DOPA sur le stress oxydant avec paramètres biologiques et parallèlement sur les complications motrices de la maladie. On pourrait envisager des études thérapeutiques contrôlées sur 2 groupes de parkinsoniens avec des différences posologiques en fonction d’âge et de sex-ratio comparables (5). Ceci a été envisagé par d’autres que nous (9).
Plus précisément pourquoi ne pas envisager 2 posologies comparées 300 à 500 mg chez le sujet âgé, 400 à 600 chez le jeune ? Parallèlement à l’abaissement de GLUTATHION PEROXYDASE a été également affirmé (5) une baisse de la cystinémie, avec un rapport glutamate sur cystine anormal chez les parkinsoniens :
Ne s’agit-il que d’aberrations nutritionnelles au stade évolué de la maladie ?
Est-il possible d’envisager un apport de cystéine acide aminé soufré, composant essentiel du GLUTATHION PEROXYDASE, versus groupe contrôle, afin d’affirmer si cette alimentation déséquilibrée aggrave la maladie ou non. Il s’agirait bien d’une autre étude.
Nous sommes là bien au cœur de toutes les affections neurodégénératives chroniques de cause inconnue : il nous faudra à l’avenir pondérer les facteurs génétiques, environnementaux dont nutritionnels et médicamenteux pour tenter d’optimiser la qualité de vie de nos malades (13)
______________
BIBLIOGRAPHIE
1‑Conférence de consensus‑3 03 2000-La maladie de Parkinson Rev. Neurol., 2000, 156,9 – 15
2‑Verny M. Quels antiparkinsoniens chez le sujet âgé ? Gériatries, 2000, 21,17 – 19
3‑Geny C. Les traitements de la maladie de Parkinson, un demi-siècle de progrès A.I.M.126, 2007,10 – 13
4- F. de la FOURNIERE, B. PLACINES, M. DEHORNE, D. ALBERT, J.F. LAGABRIELLE, P. GRANDET, J.F. DARTIGUES
Diminution de l’activité de la glutathion peroxydase plaquettaire chez les sujets âgés présentant une maladie de Parkinson Rev. Gériatries. , 2000, 25, 457 – 62
5- De la FOURNIERE F, DEHORNE M, GICQUEAU M, et al
Discussion du rôle des acides aminés « neurotoxiques« dans la maladie de Parkinson à propos de 49 patients et 185 témoins. Age § Nutrition 2006,17,115 – 119
6 ‑Pollak P. Maladie de Parkinson Médecine thérapeutique, 1996, 2,36 – 38
7‑Olanow CW, Koller CK, An algorithm for the management of Parkinson’s disease Neurology, 1998,50,1 – 57
8‑Montgomery EB Pharmacokinetics and pharmacodynamics of levodopa Neurology, 1992, 42, 17 – 22
9‑Fahn S Is levodopa neurotoxic ? Neurology 1996, 47, S184-195
10-Maurel F, Lilliu H, Le Pen C. Le coût socio-économique des dyskinésies associées au traitement par la L‑Dopa chez des patients atteints de la maladie de Parkinson Rev. Neurol. 2001, 157, 507 – 14
11-Chukwuemeka S Okereke Role of Integrative Pharmacokinetic and Pharmacodynamic Optimization Strategy in the Management of Parkinson’s disease patients experiencing motor fluctuations with Levodopa J Pharm Pharmaceut Sci, 2002, 5, 146 – 161
12-Bruguerolle B in Chronobiologie Médicale Chronothérapeutique – Alain E. REINBERG
Ed ; Med. Sciences Flammarion
13- C. GENY, M. DEHORNE, P ; URBINELLI, C. MANSO, F. De la FOURNIERE, DE BOER A., FA. ALLERT qualité de vie et maladie de Parkinson : résultat d’une enquête postale Rev Neurologie 1999, 15, 34 – 35
Les oméga‑3 contre le Parkinson
Publié le 17 janvier 2008 à 10:03Article paru dans LE PARKINSONIEN INDÉPENDANT N°31 – décembre 2007
Des chercheurs de l’Université Laval ont démontré pour la première fois qu’une alimentation riche en oméga‑3 peut protéger contre la maladie de Parkinson.
Frédéric Calon et Francesca Cicchetti, deux chercheurs du CHUL, ont nourri des souris avec une moulée enrichie d’oméga‑3 avant de leur donner un composé toxique, le MPTP, qui a les mêmes effets que le Parkinson sur le cerveau. Les effets ont été minimes. Un second groupe de souris, nourri avec une moulée ordinaire, a quant à lui manifesté des symptômes caractéristiques de la maladie.
Dans les poissons
Les analyses ont révélé que les acides gras avaient pris la place des oméga‑6, qui se trouvent dans les aliments riches en huiles végétales et en gras animaux. Les oméga‑3 sont naturellement présents dans les poissons et le lin et de plus en plus ajoutés à des produits de consommation courante, comme les œufs, le lait et les jus.
« On peut dire qu’il y a un effet protecteur », conclut M. Calon. La même preuve avait été faite pour la maladie d’Alzheimer, mais jamais pour le Parkinson. Depuis quelques années, la liste des bienfaits des oméga‑3 pour le cerveau ne cesse de s’allonger.
Le Parkinson résulte de la mort progressive de neurones du cerveau qui produisent de la dopamine, un neurotransmetteur étroitement lié au contrôle des mouvements. Les personnes atteintes souffrent de tremblements et doivent commander chaque mouvement, ce qui demande beaucoup d’énergie. La médication disponible ne permet de soulager que les symptômes.
« Ce qu’il faut retenir, c’est qu’il faut éviter d’être en carence d’oméga‑3, surtout les personnes âgées », insiste le professeur Calon. Dans un régime alimentaire idéal, le rapport entre les oméga‑6 et les oméga‑3 devrait être de quatre pour un. L’alimentation occidentale type conduit toutefois à des proportions de 10 à 20 pour un.
Résultats publiés la semaine prochaine
Les résultats de cette recherche, amorcée en 2005, seront publiés la semaine prochaine dans le site Internet de la Federation of American Societies for Experimental Biology. M. Calon entend maintenant tester la réaction de groupes de souris sur une plus longue période de temps. Il ne dirait pas non à des études cliniques sur des humains, mais cela demande beaucoup plus de capitaux. Il faut trouver un organisme subventionnaire ou une entreprise privée pour acquitter la facture.
Article original paru le jeudi 22 novembre 2007
Annie Morin (amorin@lesoleil.com)
Le Soleil
Québec
Lu par Annick LEBRUN de l’ADPLA
— — — — — — — — — — –
Plus de Parkinson chez les adeptes du lait
Risque de Parkinson augmenté de 60% avec 4 verres de lait par jour
Paris, le 20/04/07. LJS.com
On s’en doutait et c’est une nouvelle fois confirmé : les adeptes des produits laitiers courent un risque de maladie de Parkinson plus important que les personnes qui en consomment peu.
Cette fois, le lien a été mise en évidence grâce au suivi de 130 000 Américains, (57 689 hommes et 73 175 femmes) par une équipe de chercheurs du National Institute of Environmental Health Sciences Research Triangle Park de Caroline du Nord. Le Dr Honglei Chen et ses collaborateurs ont étudié les habitudes de vie, l’alimentation et l’état de santé de l’ensemble de ces volontaires pendant 9 ans.
Résultats : les hommes dont la consommation de produits laitiers dépasse 800gr par jour (ou 3 ou 4 verres de lait) ont un risque de maladie de Parkinson augmenté de 60% par rapport à ceux qui en consomment moins de 78gr par jour. Aucune association de ce type n’est en revanche retrouvée chez les femmes.
La maladie de Parkinson est une maladie neurodégénérative qui affecte 1,5 % des plus de 65 ans. Elle atteint autant les hommes que les femmes et affecte un certain type de neurones : les neurones dopaminergiques. Ceux-ci produisent de la dopamine, un neurotransmetteur du système nerveux qui agit sur les neurones qui contrôlent les mouvements du corps. Les personnes atteintes de la maladie de Parkinson présentent un déficit en dopamine dans le cerveau qui se manifeste par des troubles des mouvements.
D’après les chercheurs, ce serait plus le lait que le yaourt ou le fromage qui serait impliqué dans l’apparition de la maladie. Aucune preuve de l’effet néfaste du lait n’a cependant pu encore être apportée.
Les études précédentes ont démontré que ni le calcium, ni la vitamine D, ni la crème contenu dans le lait n’était liée au risque de Parkinson. Alors, à quoi pourrait bien être dû l’effet néfaste du lait ? Aux pesticides qu’il contient. C’est en tout cas l’hypothèse que le Dr Chen et ses collaborateurs émettent. Le lait pourrait selon eux contenir des résidus de toxines capables d’endommager les neurones et de favoriser leur dégénérescence. Le problème avec cette hypothèse c’est qu’elle ne permet pas d’expliquer pourquoi aucune association n’est retrouvée entre la maladie de Parkinson et la consommation d’autres aliments susceptibles de contenir des pesticides.
D’autres études devront donc être menées pour répondre à ces questions. En attendant, le Dr Chen souligne qu’il n’y a pour le moment aucune raison d’éliminer tout produit laitier de son alimentation. « Etant donné le bénéfice nutritionnel conféré par le lait, on peut continuer à en consommer en quantités modérées ».
De notre correspondant BENOIT MELCHIOR
Publié le 16 janvier 2008 à 13:20Article paru dans LE PARKINSONIEN INDÉPENDANT N°31 – décembre 2007
Les malades parkinsoniens américains et européens trouvent les cellules souches chinoises efficaces, ce qui provoque de vives discussions en occident.
La clinique de neurochirurgie de l’hôpital de Tiantan Puhua (Pékin, Chine), leader mondial pour le traitement de la maladie de Parkinson utilisant les cellules souches adultes de la rétine, a annoncé que quatre patients d’origines étrangères sont revenus de Chine avec une réduction significative des symptômes de la maladie. Ce succès démontre clairement que les cellules souches peuvent être utilisées efficacement pour traiter les afflictions comme la maladie de Parkinson et autres désordres neurologiques.
Détails, témoignages et vidéos sont disponibles en anglais à :
http://www.stemcellschina.com.
Alors que les débats sur l’utilisation des cellules souches continuent dans beaucoup de pays, les essais cliniques en occident ont prouvé que les cellules souches rétinals adultes étaient la meilleure chance pour les malades de Parkinson d’améliorer leur qualité de vie. Les neurologues chinois de l’hôpital de Tiantan Puhua sont parmi les leaders mondiaux de la pratique de ces techniques de pointes au travers d’un traitement sûr et efficace. Après l’hawaiien Penny Thomas qui a bénéficié de cellules souches il y a un an, ce sont maintenant quatre patients supplémentaires (américains et européens) qui sont revenus chez eux après ce même traitement.
Jane Edwards, une britannique de 55 ans, a vu une amélioration considérable de ses symptômes débilitants presque immédiatement après l’implantation de millions de cellules rétiniennes (HRPE, Human Retinal Pigment Epithelial). La procédure nécessite l’utilisation de chirurgies stéréotaxiques, un procédé d’imagerie en 3 dimensions qui permet au neurochirurgien de déterminer de façon très précise l’endroit où implanter les cellules. Le traitement de plusieurs semaines pour les patients atteints de Parkinson inclus aussi l’injection d’un cocktail nutritif intraveineux qui protègent les cellules implantées, une thérapie physique personnalisée et il est même offert une médecine traditionnelle chinoise. Ceci prend place dans un hôpital dont les docteurs et le personnel sont tous sous des normes internationales.
Le témoignage de Jane (en anglais) :
http://www.stemcellspuhua.com/articles/article_86716.html.
« J’espère que tout ceux qui souffrent de cette terrible maladie et qui cherchent l’espoir puissent constater les preuves et considérer la possibilité de venir en Chine pour rechercher une amélioration physique à travers ces grands docteurs, » dit Jane. « Ceux de l’ouest qui préconisent la prudence aux patients parkinsoniens qui veulent aller à Pékin sans aucune preuve, pourquoi n’iraient ils pas simplement au travers de ce que j’ai vécu » dit-elle.
Jane a été diagnostiquée Parkinsonienne au printemps 2001, atteignant rapidement un stade 3 de la maladie (échelle de Hoehn/Yahr) et ses symptômes allaient en s’aggravant progressivement juste avant le traitement.
Avant d’aller en Chine, Jane ne pouvait pas faire les simples choses de la vie par elle même comme se tourner dans son lit, se lever de sa chaise, s’habiller, mettre ses chaussures ou écrire –chose qu’elle a abandonnée depuis 2 ans. Elle ne pouvait pas non plus tourner le cou et son langage devenait de plus en plus lent. Après six semaines de traitement, presque tous les symptômes de Jane ont diminué de façon importante. Jane peut de nouveau écrire, se tourner dans son lit, s’habiller et même faire du vélo.
Linda Rouen, 59 ans, américaine, a été diagnostiquée Parkinsonienne il y a 5 ans. En 2007, Linda décide d’aller en Chine pour le traitement de cellules souches afin de trouver une solution à sa condition physique déclinante. Pour contrôler ses symptômes, Linda prenait des doses importantes de médicaments toutes les 2 heures.
« Je regardais ma montre constamment. Après quoi, j’ai arrêté de nager et évité tout effort physique et activité sociale parce que je ne savais pas quand l’effet des médicaments se stopperait » dit-elle. « Sans ma lourde médication, je ne pouvais pas m’habiller, sortir du lit, ou prendre une douche seule ».
L’amélioration la plus notable de Linda après la chirurgie et son traitement à Tiantan Puhua a été sa première paisible nuit de sommeil en 5 ans. Dans les 5 semaines qui ont suivi l’implantation, la plus part des ses symptômes se sont progressivement améliorés lui permettant de diminuer de manière significative sa médication.
Le témoignage complet (en anglais) à :
http://www.stemcellspuhua.com/articles/article_97730.html.
A cette heure, 2 autres patients américains ont rendu compte d’améliorations significatives après le traitement de l’hôpital de Tiantan Puhua. David Brown, 64 ans, un meilleur équilibre, une meilleure fluidité des mouvements, et la disparition de sa rigidité après le traitement. James Devlin, 65 ans a montré une réduction de ses tremblements, il ressent une augmentation de sa force musculaire, dort mieux et se sent soulager de son anxiété et sa dépression dont il souffrait depuis plusieurs années.
Plus sur la clinique de Neurochirurgie de l’hôpital de Tiantan Puhua (Pékin, Chine)
Tiantan (Temple du Paradis) Puhua est un établissement de renommé internationale et est devenu un des centres les plus connus au monde pour le traitement de la maladie de Parkinson et d’autres maladies neurodégénératives à travers sa thérapie innovante d’implantation de cellules souches. L’hôpital collabore avec le centre de recherche sur les cellules souches de l’université de Pékin qui est le leader en Chine. C’est là que sont préparées les cellules pour la transplantation. Jusque-là, Tiantan Puhua a traité 14 patients parkinsoniens étrangers. Le traitement est basé sur un unique essai clinique réalisé à Pékin dans lequel 20 patients chinois ont reçu une implantation de cellules souches rétiniennes. L’imagerie médicale avant et après l’opération montre une augmentation des taux de dopamine chez tous les patients et est corrélée à l’amélioration des mouvements.
Si, malgré son coût et la lourdeur chirurgicale, ce traitement semble prometteur, il reste qu’il n’y a pour l’instant aucune donnée significative à moyen et long terme quant à la survie de ces cellules et leur caractère pathogène (possibilité de développer des tumeurs). Ceci explique la réticence actuelle des cliniques européennes et américaines à mettre cette technique en application. Espérons que Tiantan Puhua représente l’avant-garde d’un traitement qui puisse se généraliser à tous les patients.
Un nouvel essai clinique pour un nouveau facteur de survie, la neurturin.
La compagnie Ceregene (San Diego, CA) a annoncé le 14 Novembre avoir complété l’enrôlement des patients pour la Phase 2 de l’essai clinique évaluant CERE-120, leur nouveau produit de thérapie génique pour le traitement de la maladie de Parkinson. 58 patients ont été choisis pour tester ce nouveau médicament destiné à délivrer le gène de la neurturin, un facteur de croissance du système nerveux, qui a la propriété de maintenir la croissance et la survie des neurones dopaminergiques qui se détériorent dans la maladie de Parkinson.
Cette phase clinique est supportée en partie part la Fondation de l’acteur américain Michael J. Fox et est encouragée par des résultats préalables très positifs qui ont démontré une réduction de 36% des symptômes sur une période d’un an et une très bonne tolérance des patients au traitement. Les résultats sont attendus pour la fin 2008 et s’ils s’avéraient positifs, la Phase 3 de l’essai clinique pourrait démarrer en 2009.
CERE-120 est un vecteur dérivé de l’adeno-associated virus (AAV) transformé pour exprimer le gène de la neurturin (NTN), une protéine connue pour naturellement réparer et garder en vie les neurones endommagés ou mourant du cerveau. La NTN est un membre de la même famille que le GDNF et les deux molécules ont des propriétés pharmacologiques similaires. CERE-120 est un outil de thérapie génique, il est délivré par injections stéréotaxiques (chirurgie) directement dans les zones du cerveau touchées par la maladie, fournissant ainsi une production stable et à long terme de la protéine.
Ce nouveau vecteur de thérapie génique est dans la ligne directe d’une étude pionnière menée il y a plusieurs années par l’équipe du Dr Brachet à l’INSERM U437 de Nantes et supportée financièrement par « CECAP Recherche ». Cette étude avait montré, en utilisant ce même type de vecteur AAV, que le récepteur pour le NGF, un autre facteur de survie, pouvait protéger les neurones dopaminergiques (Melchior et al. publié dans Expérimental Neurology, Oct. 2003).
La Recherche en bref :
Tezampanel réduit la paralysie spasmodique musculaire et la rigidité.
Tezampanel (TorreyPines Therapeutics, San Diego, CA), une nouvelle molécule actuellement en développement clinique pour le traitement des migraines a montré dans une étude indépendante qu’il était aussi efficace pour rétablir et prévenir la paralysie spasmodique musculaire et la rigidité chez le rat. Ces symptômes sont très souvent observés chez les Parkinsoniens. La molécule pourrait être bientôt disponible pour les patients.
Des scientifiques ont déniché le fer caché qui pourrait induire la neurodégénération.
Les chercheurs suspectent que l’accumulation de fer joue un rôle dans les processus de neurodégénération observés dans la maladie de Parkinson ; mais sa localisation dans les neurones n’a jamais été observée a cause du manque technique de précision jusqu’à maintenant… Les chercheurs du CNRS de l’université de Bordeaux, de l’université de Séville et de l’unité de Neurosciences de l’INSERM de Grenoble ont recherché la présence de fer dans un modèle de cellules neuronales en culture qui produisent de la dopamine. Parce que la dopamine peut former des complexes stables avec le fer, Richard Ortega, du groupe d’imagerie cellulaire de Bordeaux, croit que la dopamine peut exercer un effet protecteur en mobilisant l’excès de fer dans les neurones dopaminergiques, un mécanisme qui pourrait être défaillant chez les Parkinsoniens.
Séparer le « bon » fer du « mauvais » dans le cerveau.
Les chimistes de l’université de Duke (Durham, Caroline du Nord) ont développé une méthode pour capturer le fer dans le cerveau afin de combattre l’effet dévastateur chez les patients atteints de Parkinson et d’Alzheimer. La clé est de se débarrasser des formes destructives qui génèrent des radicaux libres et laisser les formes bénignes du fer nécessaire pour les fonctions vitales du corps.
Un gène anormal lié au développement de la maladie de Parkinson chez les jeunes adultes
Certaines personnes avec une mutation très spécifique ont plus de chances de développer la maladie de Parkinson avant l’âge de 5 ans comparé à ceux qui n’ont pas la mutation. Dans une étude publiée dans la revue Neurology du 18 septembre 2007, des chercheurs ont analysé les gènes de 278 parkinsoniens et de 179 patients contrôles. L’étude montre que 14% des Parkinsoniens portent une mutation du gène de la glucocérébrosidase contre 5% chez les sujets sains. Le taux s’élève à 22% des Parkinsoniens diagnostiqués avant l’âge de 50 ans contre 10% chez les sujets développant la maladie après l’âge de 50 ans.
Le Dr Benoît Melchior est chercheur au La Jolla Bioengineering Institute (San Diego, Californie) où il explore les liens entre le système vasculaire et le développement des maladies neurodégénératives. Le docteur Melchior a obtenu sa thèse de doctorat à l’Université de Nantes, en particulier grâce à un soutien financier du fond « CECAP Recherche ».
Contact : bmelchior@ljbi.org
L’effet Placebo chez les patients parkinsoniens
Publié le 16 janvier 2008 à 12:20Article paru dans LE PARKINSONIEN INDÉPENDANT N°31 – décembre 2007
Article original écrit par Johannes Kornacher, paru en septembre 2007 dans « Parkinson » la revue de Parkinson Suisse
Le responsable de l’association nous invite à nous pencher sur un effet très particulier de la maladie de Parkinson que nous avons tous ressenti : les conditions psychologiques de notre environnement ont une influence particulièrement sensible sur notre état physique. Il y a sûrement là une piste à explorer pour nous aider à prolonger voire améliorer les effets de nos traitements.
« Les « placebos » sont des pilules dépourvues de principe actif. Pourtant, elles produisent un effet certain. Ce que l’on appelle l’effet placebo est un phénomène qui touche aussi les personnes atteintes de Parkinson ; il arrive même que les médecins l’intègrent délibérément au traitement. Voici des histoires surprenantes sur l’effet placebo … »
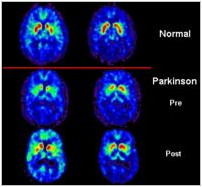
La confiance, une arme contre Parkinson : des chercheurs canadiens ont administré des médicaments antiparkinsoniens à des personnes souffrant de la maladie. Certains patients ont reçu un véritable principe actif, tandis que d’autres ont absorbé des médicaments « vides », c’est-à-dire sans effet du point de vue de la substance chimique. Aucun des patients ne savait laquelle des pilules lui était administrée. Les résultats de l’expérience ont stupéfait les scientifiques : les pilules vides ont déclenché les mêmes processus dans le cerveau des patients que les vrais médicaments. Grâce à une technique d’imagerie moderne, la tomographie par émission de positrons (TEP), les chercheurs ont pu prouver l’effet placebo dans le cerveau de leurs patients, créant ainsi la sensation : jusqu’ici, on était toujours parti du principe que les placebos influaient sur le ressenti subjectif du patient, soit qu’ils avaient un effet purement psychologique. Or, en réalité, ils ont bel et bien un effet physiologique : le seul fait de s’attendre à une amélioration a stimulé la production de dopamine, un neurotransmetteur du cerveau.
Des scientifiques américains ont également observé un puissant effet placebo chez des patients parkinsoniens. A l’université de Denvers, les chercheurs ont traité trente patients volontaires. Ils leur ont expliqué qu’ils allaient leur injecter des cellules fœtales dans le cerveau afin de rajeunir l’organe. Les patients savaient que seuls certains d’entre eux seraient réellement opérés, tandis que d’autres subiraient une opération factice. Douze malades se sont vus implanter des neurones dopaminergiques issus de cellules souches embryonnaires. Les dix-huit autres participants ont été également emmenés au bloc opératoire et préparés, mais les médecins ont seulement fait semblant de les opérer, aucune transplantation de tissus n’étant réellement effectuée. Après quatre, huit et douze mois, les chercheurs ont évalué la qualité de vie ainsi que d’autres données médicales chez tous les participants à l’étude. Or, les résultats ont révélé une amélioration de la qualité de vie pour les deux groupes. La chercheuse Cynthia McRae a rapporté qu’une participante, qui avait cru à tort avoir été opérée, avait commencé à faire des randonnées et du patin à glace après le traitement. Même les médecins ignorant à quel groupe les patients appartenaient ont pu constater une amélioration de leur état.
Les recherches du neurologue italien Fabrizio Benedetti, de l’université de Turin, vont encore plus loin. Son équipe et lui ont pu constater l’effet placebo au niveau des cellules cérébrales pour la première fois. Ils ont donné à des patients parkinsoniens souffrant de tremblements une solution inoffensive à base de sel et leur ont assuré qu’il s’agissait d’un véritable médicament. En outre ils ont mentionné, l’air de rien, que la mobilité des malades s’améliorerait, ce qui s’est effectivement produit. « L’imagination humaine », a expliqué Benedetti dans le magazine d’actualité Der Spiegel, « a le pouvoir de déclencher dans le corps des mécanismes semblables à ceux qu’actionnent les médicaments. »
Pour Der Spiegel, les exemples le montrent : « L’effet placebo est une chimère bien réelle. » Il provoque une réponse biologique du système nerveux et mène à des modifications bien réelles à l’intérieur du corps. Dans le cas des parkinsoniens, il augmente même la production de dopamine. L’effet placebo connaît toutefois des limites. D’une part il ne permet pas de guérir un malade mais seulement d’améliorer son état. D’autre part, comme il prend naissance dans certaines régions du cerveau en particulier, telles que le thalamus, le potentiel d’autoguérison dans le cas de maladies qui détruisent ces circuits –par exemple Alzheimer– est réduit.
L’effet placebo, qui naît de l’espoir du patient qu’une amélioration, voire qu’une guérison se produise, est une chose extraordinaire en soi. Néanmoins, le médecin joue un rôle décisif dans ce processus. En effet, des études ont prouvé que les médecins qui sont à l’écoute de leurs patients et leur fournissent des informations précisent ont besoin de prescrire moins de médicaments. Ce phénomène s’applique aussi bien aux antidouleurs qu’aux antidépresseurs.
Dans le cas des maladies incurables telles que Parkinson, le potentiel de l’effet placebo est limité à long terme. Mais le médecin, par sa personnalité, son attitude, sa façon de communiquer, a incontestablement une influence positive sur l’évolution de la maladie de son patient. « Au début, les patients parkinsoniens ont peur de l’avenir », explique Fario Baronti, médecin chef et neurologue à Tschugg. « Pour leur redonner confiance, il suffit d’envisager ce qui est possible de manière positive, sans rien minimiser, et de proposer de petites solutions pour la vie de tous les jours. » A ces fins, le médecin doit savoir écouter et prendre le temps. Le dialogue comme remède, et non l’expédition en trois minutes chrono : voila ce qu’attendent les patients d’un médecin.
Pour les patients parkinsoniens, victimes chaque jour des mauvais tours et des petites misères de la maladie, il est particulièrement important de souligner les aspects positifs de la vie quotidienne. « En tant que médecin, je dois aider le patient à atteindre la meilleure qualité de vie possible, et non décréter qu’il a irrémédiablement perdu cette qualité de vie » explique Fabio Baronti. « Vous avez la maladie du Pape » sonne bien mieux aux oreilles d’un nouveau malade que « le ciel est en train de vous tomber sur la tête ». Pour le docteur Baronti, il est important que le médecin témoigne à son patient considération et empathie lorsqu’il lui communique des informations. « Chez les patients motivés qui entretiennent une attitude positive malgré leur maladie, l’empreinte de la douleur semble souvent moindre. »
Selon Brian Olshansky, cardiologue aux Etats-Unis, les médecins devraient réviser leurs conceptions. L’effet placebo rend les mesures thérapeutiques jusqu’à 40% plus efficaces. On devrait donc l’utiliser sciemment. « Un médecin insensible, indifférent et technocratique produira un « effet nocebo », affirme le docteur Olshansky. Le neurologue Fabio Baronti insiste également sur ce point : « Le patient se sent alors impuissant, ce qui accentue ses douleurs. » Les médecins sont de plus en plus nombreux à comprendre qu’ils influent sur la neurobiologie de leurs patients. Ils se rappellent un vieil adage : « Le dialogue est souvent le meilleur des remèdes. »
L’effet placebo agit dans le cerveau : ce dernier réagit aux mots du médecin, aux impressions, aux attentes, aux espoirs. Dans certaines zones, il fabrique des substances endogènes telles que la morphine ou la dopamine. Ces substances se lient aux neurones et modifient les symptômes du malade. On estime que le pouvoir thérapeutique de l’effet placebo peut aller jusqu’à 40%.
Article rédigé par Johannes KORNACHER
Il m’est apparu essentiel de vous faire part de cette lecture : elle ouvre de réelles perspectives d’amélioration de nos conditions de vie et pourquoi pas d’ « autoguérison ». Pour ma part, j’en suis convaincu ; et toutes mes démarches actuelles pour essayer d’analyser ma maladie de parkinson et « l’apprivoiser » pour mieux la combattre, semblent apporter la preuve de ce que décrit cet article.
A chacun de compléter l’apport des produits chimiques des traitements, par des démarches parallèles et tout particulièrement dans le domaine psychologique. Dans le même temps, il faut savoir se construire des conditions de vie familiale, sociétale, professionnelle …, respectant au mieux les exigences de notre corps qui se défend en développant cette fichue maladie.
Il ne s’agit pas de « miracle » ou de « croyances » naïves, immatures, mais de faits vérifiables et contrôlables : nous avons tous en nous un potentiel important de « guérison » qu’il nous faut mobiliser en nous en donnant les moyens. Notre statut de malade est parfois tellement fascinant (et même confortable !) qu’il nous empêche de prendre notre vie en main :
Soyons des « Parkinsoniens Indépendants » actifs et responsables de notre devenir !
Par Jean GRAVELEAU graveleau.jean2@wanadoo.fr
Editorial du PARKINSONIEN INDÉPENDANT N°31 – décembre 2007
Publié le 16 janvier 2008 à 12:16MEILLEURS VŒUX A TOUS !
Voici revenus les vœux traditionnels que l’on se porte quelquefois sans vraiment y penser, par simple politesse ou habitude culturelle. C’est aussi la course aux cadeaux que l’on offre ou que l’on reçoit.
Nous ne dérogerons donc pas à cette tradition mais nous le faisons avec une grande sincérité : que tous nos vœux de bonheur, de meilleure santé – il faut y croire malgré ce que l’on ressent – et d’espoirs vous accompagnent tout au long de cette nouvelle année.
Pour aller dans ce sens nous avons lu et il nous a été adressé divers articles qui font état d’évolutions positives dans la recherche ; il faut en être vraiment persuadé : des progrès sont à l’aube d’être découverts ou vont être mis en œuvre prochainement.
Et puis nos amis suisses ont écrit un article que nous reproduisons intégralement tant il nous est apparu essentiel : il s’agit du phénomène de l’effet placebo. Il est prouvé (et nous pouvons le constater nous-mêmes dans notre vie de tous les jours) : dans certaines circonstances positives, nous sommes capables – tout au moins notre cerveau inconscient – de commander à nos neurones et aux producteurs de neurotransmetteurs (dopamine, noradrénaline, …) d’agir alors que nous en sommes démunis et que, consciemment, nous avons des difficultés à commander le mouvement !
Il faut nous installer dans une dynamique positive aidée en cela par tout ce qui peut nous apporter un mieux-être. C’est là notre vœu le plus sincère : prenons notre vie en main et devenons des Parkinsoniens Indépendants libres et positifs. C’est la clé de la guérison que nous appelons de tous nos vœux.
Ne baissons pas les bras, des améliorations de notre condition de « malade » sont possibles. Mais le chemin est difficile alors qu’il peut être plus facile de se laisser glisser dans l’inconfort (malgré tout confortable) du patient dépendant !
Certain vont trouver un peu exagéré mon propos et me rétorquerons que cela est difficile voire impossible compte tenu de l’évolution de leur maladie ou du contexte dans lequel ils évoluent. Je ne veux pas les blesser, je maintiens que nous pouvons, nous devons, tout faire pour redevenir maître d’une « saloperie » qui veut nous dominer.
Bon courage à tous et une fois encore nos vœux les plus sincères !
Jean GRAVELEAU
graveleau.jean2@wanadoo.fr
GP29 — Lettre d’info n° 41 — Octobre 2007
Publié le 16 novembre 2007 à 08:37Et voilà, nous n’avons pas eu à mettre en action le plan canicule, il va certainement nous manquer les bienfaits que nous devons au soleil, espérons que nous compenserons par un hiver bienveillant, ce qui sera bien pour nous et notre budget !!!
Tout cela ne nous a pas laissé inactifs,
- Les forums : des solidarités en septembre à Quimper, dans le cadre de la semaine de la santé à Brest en octobre – tous deux bien organisés, même si nous avons l’impression de n’aider qu’un petit nombre de personnes, il faut y être pour montrer notre existence.
- Septembre a vu aussi notre journée de rencontre avec les psychologues – vous en avez le compte rendu par ailleurs.
- Les interventions de formation ont recommencé, en octobre à Brest, bientôt à Morlaix.
Les points rencontre ont repris leur rythme mensuel. Hélas, nous avons dû prendre la décision de fermer Carhaix. Contrairement à ce que laissait espérer l’intérêt montré lors de la Porte Ouverte, la fréquentation du point rencontre a été nulle. Nos responsables se sont présentés chaque mois pendant plus d’une année, dans le local que la municipalité de Carhaix avait mis à notre disposition, et ce, sans le moindre résultat – dommage.
En octobre, nous avons assisté aux Assemblées Générales de CECAP et d’AGP à Hauteville dans la Manche. Les Associations qui composent CECAP ont pu faire le point sur les activités et sur la Recherche – Une excellente journée d’interventions de différents intervenants nous a fait aborder beaucoup de sujets (les pompes à Apokinon et Duodupa – la psychologie et la MP – l’aide aux Aidants.) Un certain nombre de finistériens ont vécu avec bonheur les 8 jours de vacances magistralement organisés par nos amis de la Manche.
Et la grande nouvelle : En 2008, c’est notre département qui recevra toutes les autres Associations. Réservez dès maintenant 8 jours de vos vacances pour participer à ce grand moment de la vie de notre Association.
date : 27 septembre au 4 octobre 2008 -
lieu : Loctudy
Cela ajouté à toutes nos autres activités nous promet une année bien remplie – ne manquez pas d’y participer –
Bien amicalement
Emilienne Six
Présidente du GP29
ASSOCIATION DE PARKINSONIENS DU FINISTÈRE
LES AMIS DU FINISTÉRE — PENN AR BED
gp29@altern.org
La réforme des mesures de protection juridique des majeurs
Publié le 16 novembre 2007 à 08:21Paru dans LE PARKINSONIEN INDÉPENDANT N°30 – septembre 2007
La réforme des mesures de protection juridique des majeurs
Mandat de protection future, sauvegarde de justice, curatelle et tutelle.
Loi N°2007 – 308 du 5 mars 2007
Décision du Conseil Constitutionnel DC N°2007 – 552 du 1er mars 2007
Journal Officiel du 7 mars 2007
Actualités Sociales hebdomadaires des 29 juin et 13 juillet 2007
« Meilleure prise en compte de la personne du majeur protégé, réaffirmation des principes de nécessité, de subsidiarité et de proportionnalité qui doivent sous-tendre toute mesure de protection future, harmonisation et simplification de la tutelle et de la curatelle. Ainsi peuvent se résumer les principales avancées de la loi du 5 mars 2007 concernant les mesures de protection juridique des majeurs. »
Je ne vous ferais pas un résumé de ce texte très complet mais je vous invite à vous reporter au Journal Officiel du 7 mars 2007 ou aux A.S.H. (Actualités Sociales Hebdomadaires) des 29 juin et 13 juillet (ces deux revues existent sur Internet).
Ce texte ne concerne que quelques uns d’entre nous mais il est important d’y faire référence pour les intéressés qui pourront s’y reporter en cas de besoin.
Par Jean GRAVELEAU graveleau.jean2@wanadoo.fr
Parkinson et idées fausses
Publié le 15 novembre 2007 à 12:53Paru dans LE PARKINSONIEN INDÉPENDANT N°30 – septembre 2007
| La maladie de Parkinson est une maladie du 3ème âge | FAUX |
| Le tremblement est toujours associe au Parkinson | FAUX |
| Les gens qui tremblent ne sont pas tous Parkinsoniens | VRAI |
| La maladie de Parkinson est héréditaire | FAUX |
| La cause de la maladie reste inconnue et multi-factorielle | VRAI |
| On vit mieux avec le Parkinson depuis l’avènement de la DOPA | VRAI |
| La maladie de PARKINSON n’induit ni fatigue, ni douleurs | FAUX |
| la maladie de PARKINSON induit irrévocablement un Handicap | VRAI |
| Le Handicap lié au PARKINSON est Permanent | FAUX |
| La chirurgie permet de guérir la maladie par l’implantation d’électrodes | FAUX |
| La maladie de PARKINSON n’induit qu’une gêne motrice | FAUX |
| Tous les malades présentent les mêmes symptômes | FAUX |
Mal connue du grand public, la Maladie de Parkinson est très souvent associée à des idées fausses. Tout le monde peut comprendre ce que représente le handicap des non voyants, des paralysés, des sourds … Il n’en est pas de même pour la MP, les symptômes étant moteurs et psychiques, intermittents dans la journée, déroutants pour l’entourage… et donc bien difficiles à comprendre pour une personne bien-portante.
S’il fallait retenir 10 idées fausses à combattre sur la M.P, voici celles que je retiendrais :
1- La maladie de Parkinson est une maladie du 3ème âge : FAUX
L’âge moyen au moment du diagnostic est de 57 ans … Ce qui signifie que, statistiquement, un parkinsonien sur 2 a moins de 57 ans au moment du diagnostic… C’est donc — en principe — un actif et non un retraité. En fait 10 à 15 % des parkinsoniens ont 40 ans ou moins au moment du diagnostic. De plus, il semblerait que les parkinsoniens juvéniles sont de plus en plus fréquents …
Puisqu’on est dans les statistiques, on sait que l’évolution moyenne de la maladie ne permet plus le maintien de l’activité professionnelle au bout de 7 à 8 ans. Et pendant ces 7 à 8 ans, l’activité est souvent réduite à un temps partiel. Evidemment, si on est chirurgien, dentiste, ou encore visiteuse médicale ou VRP, ou encore fonctionnaire … le maintien de l’activité professionnelle ne pose pas tout à fait les mêmes problèmes.
2 — Le tremblement est toujours associe au Parkinson : FAUX
L’équation tremblement = Parkinson est tellement ancrée dans l’esprit des gens que :
- peu de gens savent qu’on peut être parkinsonien sans présenter le moindre tremblement, notamment au début de la maladie,
- peu de gens savent qu’on peut être un « grand trembleur » sans pour autant être Parkinsonien …
En fait, le tremblement est bien le signe le plus visible et donc le plus gênant socialement, mais l’akinésie (mouvements lents voire impossibles), et l’hypertonie (raideurs des muscles) sont les signes moins visibles mais qui entraînent plus sûrement le handicap. D’autres symptômes sont également fréquents au cours de l’évolution de la maladie : l’insomnie, la dépression, l’hypotension, la constipation, l’hypersalivation, les difficultés d’élocution, les problèmes d’équilibre, le ralentissement psychomoteur… et la fatigue quasi permanente…
3- La maladie de Parkinson est héréditaire : FAUX
On pense de plus en plus à une cause mixte de déclenchement de la maladie : susceptibilité génétique à un facteur de l’environnement (lequel ?). En fait, le caractère héréditaire est très peu marqué (même s’il existe des familles de parkinsoniens). Les observations effectuées sur les jumeaux confirment le caractère très peu héréditaires de la MP. Cependant,c’est une maladie fréquente (1 sur 1000), avec laquelle on peut vivre de nombreuses années, ce qui explique que l’on peut retrouver plusieurs cas de Parkinson dans une famille.
4- On vit mieux avec le Parkinson depuis l’avènement de la DOPA : VRAI
La L‑DOPA, découverte dans les années 60, a certes révolutionné la qualité de vie des parkinsoniens. Avant la DOPA, les malades devenaient grabataires en moins de 10 ans et ne survivaient pas au delà.
La L‑DOPA est le médicament le plus efficace pour pallier aux symptômes moteurs du Parkinson. Son action est très efficace les 1ères années de traitement, puis son effet s’amenuise au fur et à mesure que les neurones de la substance noire meurent. Ceci se traduit par les fameuses fluctuations motrices en cours de journée, qui se traduisent par des périodes OFF (mouvements lents voire bloqués, parole difficile, crampes etc.) alternant avec des périodes ON (mouvements désordonnés ou dyskinésies) en fonction des heures de prises des médicaments.
En conclusion, on vit mieux avec la L‑DOPA qu’avant, mais la qualité de vie se dégrade tout de même progressivement. On ne sait pas encore guérir le Parkinson.
5- La maladie de PARKINSON n’induit pas de fatigue, ni de douleurs : FAUX
Au moment du diagnostic, lorsque mon médecin généraliste m’a affirmé que la MP ne faisait pas souffrir, j’ai été rassurée…
Mais, j’ai rapidement déchanté… Les crampes, raideurs musculaires et douleurs quasi-permanentes au niveau de la nuque sont des douleurs chroniques, en général peu aigues (sauf pour les crampes !). Non, on ne peut pas dire que la MP ne fait pas souffrir …
La fatigue : Je dirais qu’il s’agit d’un symptôme majeur de la MP, celui qui ne vous lâche pas d’une semelle, du matin au soir, une asthénie de tous les instants. Tout fatigue : parler, se déplacer, écouter une conversation, marcher, lire, manger, répondre au téléphone, sourire, chercher des papiers dans son sac, rendre la monnaie etc. La MP c’est épuisant, car vos moindres gestes et vos moindres paroles ne sont plus sous « pilotage automatique ». Tout doit être pensé « comme si c’était la première fois ».
La fatigue et l’hypertonie entraînent fréquemment une perte de poids qui peut être importante.
6- Le HANDICAP lié au PARKINSON est PERMANENT : FAUX
7 — La maladie de PARKINSON induit irrévocablement un HANDICAP
Être parkinsonien, c’est être handicapé à temps partiel …
Allez faire comprendre cela au quidam dans la rue … que par moments les parkinsoniens sont bloqués, incapables d’initier un mouvement et par moments, au contraire les mouvements sont aisés, voire involontaires (dyskinésies).
Que faire un pas pour franchir une porte, c’est difficile, mais grimper l’escalier c’est facile… Que parler et se faire comprendre n’est pas possible par moments et possible à d’autres…
Un handicap à temps partiel, qui gêne l’activité normale quotidienne, est peu compatible avec l’activité professionnelle, et n’est pas toujours reconnu comme un réel handicap par les bien-portants.
Déroutant, non ?
8- La maladie de PARKINSON peut être guérie par l’implantation d’électrodes dans le cerveau : FAUX
La stimulation du noyau sous thalamique permet de réduire significativement les symptômes majeurs de la MP : tremblement, akinésie et hypertonie.
Seule, une petite majorité de parkinsoniens environ 15 % sont « éligibles » à une stimulation, car ils doivent correspondre à certains critères, notamment réagir favorablement au traitement dopaminergique, et ne pas présenter de troubles cognitifs ; les heureux élus devront attendre plusieurs années avant de pouvoir être opérés, car il y a trop de malades potentiels par rapport aux possibilités d’opérations en neurochirurgie.
Il faut retenir que 15 % des malades sont concernés par une amélioration des symptômes « moteurs » exclusivement.
9 — La maladie de PARKINSON n’induit qu’une gêne motrice : FAUX
Des troubles psychiques telles que la dépression, le ralentissement psychomoteur et l’insomnie sont fréquemment associés. Les médicaments peuvent induire également des troubles tels que les hallucinations ou la confusion mentale.
La gêne sociale peut être très importante : les tremblements, les mouvements involontaires, les difficultés d’élocution, le visage figé sont autant de « murs » entre les Parkinsoniens et leur entourage et gênent les relations sociales.
Des troubles divers telles que l’hypersudation, l’hypersalivation, la constipation, le manque d’équilibre sont fréquents.
10 — Tous les malades présentent les mêmes symptômes : FAUX
Il n’existe pas deux Parkinsoniens identiques : les symptômes majeurs ne sont pas les mêmes, leurs criticités, l’évolution de la maladie sont différents.
Le traitement qui réussit à Pierre ne marche pas avec Paul. Comment voulez-vous que les neurologues y retrouvent leur latin ?
11 — Il n’est pas nécessaire d’être suivi par un neurologue lorsqu’on est Parkinsonien : FAUX
Un médecin généraliste a en moyenne 1 parkinsonien dans sa clientèle. Or tous les parkinsoniens sont différents ; les traitements médicamenteux sont nombreux et évoluent. On ne soigne pas un Parkinson comme on soignerait une grippe.
Rien ne remplace une formation et une expérience d’un neurologue qui soigne des multitudes de patients tous les jours, même s’il faut faire quelques kms pour cela.
NOURRY Marie-Pierre
Le nombre de cas de maladie de Parkinson doublera en 25 ans
Publié le 12 novembre 2007 à 10:31Paru dans LE PARKINSONIEN INDÉPENDANT N°30 – septembre 2007
Washington, 30/01 –
Le nombre de personnes souffrant de la maladie de Parkinson doublera au cours des vingt-cinq prochaines années dans quinze des pays les plus peuplés de la planète surtout les moins développés, selon une étude publiée lundi dans la revue américaine Neurology (source : AFP).
Les auteurs de cette recherche soulignent aussi les défis de taille auxquels seront confrontés les nations dont l‘économie connaît une croissance rapide accompagnée d‘une plus grande longévité de la population, surtout en Asie où un grand nombre de pays ne sont pas préparés.
Au cours des dernières années, les ressources financières et humaines ont été en priorité consacrées à la lutte contre le sida, la tuberculose et le paludisme notamment, relève le Dr. Ray Dorsey, un neurologue de l‘université de Rochester (New York, nord-est).
Alors que les maladies infectieuses ont retenu la plus grande attention, ce sont en fait les pathologies chroniques non transmissibles, comme la maladie de Parkinson (une maladie neurodégénérative), qui représenteront les coûts économiques et sociaux les plus lourds pour les pays en développement, ajoute-t-il.
Le Dr. Dorsey et une équipe de chercheurs ont étudié des projections démographiques des cinq plus grands pays d‘Europe occidentale (France, Espagne, Allemagne, Royaume-Uni et Italie) ainsi que celles des dix nations les plus peuplées du globe (Chine, Inde, Indonésie, Etats-Unis, Brésil, Pakistan, Bangladesh, Nigeria, Japon et Russie).
Lu pour vous par Pierre LEMAY
Association de La Manche
Test médical de la Créatine© contre Parkinson
Publié le 12 novembre 2007 à 10:22Paru dans LE PARKINSONIEN INDÉPENDANT N°30 – septembre 2007
La maladie de Parkinson est un risque important pour les anciens du monde occidental. Comment échapper à cette maladie du système nerveux central qui touche 3% des plus de 85 ans ? Aujourd’hui, aucun traitement n’est vraiment efficace. Un institut américain lance un test important pour vérifier si la créatine ralenti la progression de la maladie.
1720 personnes réparties dans 51 centres médicaux nord-américains vont participer à l’étude. Cette population est constituée de personnes qui en sont au tout début de la maladie de Parkinson. Le test est mené par l’Institut National de la Santé (NIH) et se veut plus que sérieux (test en double aveugle avec contrôle comparé au placebo).
L’objectif est de mesurer l’efficacité de la prise de créatine sur les patients. La durée de traitement devrait se situer entre 5 et 7 ans.
La créatine, plus connue comme dopant des sportifs, améliorerait les fonctions des mitochondries, productrices d’énergie cellulaire. Elle pourrait aussi agir comme anti-oxydant qui empêcherait la dégénérescence de certaines parties du cerveau.
Si la créatine joue bien le rôle escompté, ce sont près d’un million de clients (patients) américains qui seront concernés par ce nouveau médicament contre la maladie de Parkinson.
Source : Eurekalert
Lu pour vous par Pierre LEMAY
Association de La Manche
L’acupuncture contre la maladie de Parkinson
Publié le 07 novembre 2007 à 09:46Paru dans LE PARKINSONIEN INDÉPENDANT N°30 – septembre 2007
Par Jean – Luc Goudet « Futura-Sciences janvier 2007 »
Cette ancestrale pratique asiatique a montré son action bénéfique sur la maladie de Parkinson…. chez la souris, ce qui exclut l’effet placebo. Le traitement ne se limite pas aux symptômes corporels mais agit en amont en protégeant les neurones dopaminergiques.
L’acupuncture fonctionne aussi chez la souris. C’est ce qu’a incidemment prouvé Sabina Lim de l’Université KYUNG HEE, à Séoul (Corée du Sud). Mais le but premier était de tester la méthode de cette pratique médicale sur la maladie de Parkinson, une atteinte neurologique grave qui induit des mouvements musculaires involontaires et touche six millions de personnes dans le monde. Et là aussi, la réponse a été positive.
Les animaux ont subi des injections d’une toxine, la MPTP (1‑méthyl-4-phényl‑1,2,3,6‑tétrahydropyridine), qui détruit dans le cerveau les neurones fabriquant la dopamine, un neurotransmetteur. Quelle qu’en soit la cause première, la maladie de Parkinson est en effet liée à la perte de ces neurones dopaminergiques .
Mais comment trouver chez la souris les « méridiens » (sorte de canaux qui véhiculent la force vitale selon les explications traditionnelles) et les « écluses » (points où il faut insérer les aiguilles) ? Très simplement en reprenant ceux que les manuels d’acupuncture indiquent pour l’être humain. Sabina Lim a choisi deux points connus, chez l’homme, pour être liés à l’activité musculaire (derrière le genou et sur le haut du pied). Les animaux subissaient une séance tous les deux jours. L’équipe a constitué deux groupes témoins, l’un ne recevant aucun traitement et l’autre subissant des piqûres à la hanche, une zone censément dépourvue d’écluses.
Le résultat est éloquent : une semaine après l’injection de MPTP, les souris n’ayant reçu aucun traitement et celles ayant été piquées à la hanche ont vu leur taux de dopamine diminuer de moitié. Mais les animaux ayant bénéficié de vraies séances d’acupuncture ont conservé 80% de leurs neurones dopaminergiques et les symptômes ont donc été réduits de beaucoup.
Rencontre entre Orient et Occident
Comment les piqûres sur le corps peuvent-elles protéger des neurones du cerveau ? L’équipe n’explique pas cet effet mais avance une hypothèse. Des réactions d’inflammation dans le cerveau accompagnent les manifestations de la maladie de Parkinson et aggravent la pathologie. Les scientifiques estiment possible que les séances d’acupuncture réduisent ces inflammations.
Dans le journal Science, Iris Chen neurologue au Massachusetts General Hospital de Boston, confirme que l’acupuncture peut effectivement augmenter la quantité de dopamine dans le cerveau lorsqu’elle est trop faible.
Les effets observés chez la souris existent-ils chez l’homme ? Lim et ses collègues ont commencé des tests mais le nombre de patients est pour l’instant insuffisant pour que les résultats soient statistiquement significatifs. En Corée, rapporte l’équipe, l’acupuncture est utilisée pour traiter les patients atteints par la maladie de Parkinson « mais on ne peut pas parler de guérison ».
Toutefois, ces scientifiques soulignent l’intérêt d’une rencontre entre les pratiques de la médecine traditionnelle asiatique et les méthodes de la science occidentale, espérant que le cumul de l’acupuncture et du traitement par médicaments pourra réduire la souffrance des patients voire augmenter leur longévité .
L’acupuncture est issue de la médecine traditionnelle chinoise et en chine, la maladie de Parkinson est nommée la « maladie du vent ».
L’acupuncture s’intéresse aux flux d’énergie qui traverse le corps au niveau des méridiens. Elle consiste, au niveau des points d’acupuncture (près de 400 points) situés le long des méridiens, à stimuler ou disperser ces flux d’énergie, au moyen d’aiguilles essentiellement. En France, seuls les médecins ont le droit de pratiquer l’acupuncture, mais grâce à la grande compétence de praticiens, de nombreux Parkinsoniens obtiennent d’excellents résultats sur les manifestations particulières telles que : incontinences, insomnies, douleurs articulaires… et bien d’autres symptômes qui nous gâchent la vie.
Lu pour vous par Jacques PIASER et Henri MINARET
As Parkinsoniens du Limousin
Les 50 ans de la Dopamine
Publié le 01 novembre 2007 à 10:29Paru dans LE PARKINSONIEN INDÉPENDANT — N°30 septembre 2007
Cette année, est célébré le cinquantième anniversaire de la découverte de la Dopamine en tant que neurotransmetteur cérébral. Elle a été découverte par Arvid Carlsson, qui a reçu en l’an 2000, à l’âge de soixante dix-sept ans, le prix Nobel de Médecine et de Physiologie, pour l’ensemble de ses travaux de neurophysiologie et de neuropharmacologie.
Depuis la fin des années 1950, ces travaux ont ouvert la voie à la compréhension des modalités d’action des neurotransmetteurs aminergiques (Dopamine, Adrénaline et Noradrénaline) dans le système nerveux central, et ont permis de découvrir certaines des fonctions centrales de la dopamine.
Au-delà de l’intérêt direct de ces travaux pour la compréhension et le traitement de maladies neurologiques et psychiatriques, telles que la maladie de Parkinson ou la schizophrénie, l’inspiration et les résultats de A. Carlsson ont donné une impulsion considérable à la neuropsychopharmacologie dont l’intérêt ne se dément pas cinquante ans plus tard.
Depuis une vingtaine d’années, ce champ des neurosciences a grandement bénéficié des stratégies particulièrement puissantes et informatives apportées par la biologie moléculaire et l’imagerie cérébrale chez l’homme. A. Carlsson, médecin et neurophysiologiste suédois, a tout d’abord étudié puis travaillé comme Professeur de Pharmacologie à l’Université de Lund (Suède). Depuis 1956, il dirige le laboratoire de Pharmacologie de l’Université de Göteborg (Suède).
A partir de 1958, A. Carlsson apporte des arguments décisifs démontrant que la dopamine est un neurotransmetteur dans le système nerveux central. En quoi cette découverte était elle si importante ?
A cette époque, le nombre de molécules susceptibles d’intervenir comme messager chimique dans le système nerveux central apparaît très limité. Parmi les neurotransmetteurs déjà identifiés, on connaissait l’acétylcholine et la noradrénaline, cette dernière étant synthétisée à partir de la tyrosine, présente dans le sang.
La dopamine n’est alors que le métabolite situé en amont de la noradrénaline. Carlsson débute ses travaux alors que naît la neuropsychopharmacologie et que la biochimie permet le développement d’outils puissants pour comprendre et modifier le métabolisme et les effets des monoamines. A l’Université de Lund (Suède), A. Carlsson démontre avec N. Hillarp que, chez l’animal, la réserpine (connue maintenant comme un bloqueur vésiculaire de la dopamine) entraîne une perte massive des monoamines dans le système nerveux central, avec des effets comportementaux qui rappellent certains des symptômes de la maladie de Parkinson.
Sur la base de ces résultats, il démontre que l’injection de L‑dopa, précurseur immédiat de la dopamine, restaure des concentrations cérébrales normales en dopamine et corrige les manifestations comportementales de la réserpine, en particulier les effets akinétiques (c’est-à-dire les ralentissements des mouvements). Ces résultats conduisent Carlsson et de nombreux groupes à s’intéresser de près à la dopamine avec plusieurs découvertes majeures : la dopamine est présente dans le cerveau à l’état naturel, dans des zones qui ne contiennent pas de noradrénaline. Parmi celles-ci, le striatum constitue un des territoires les plus riches en dopamine. Cela conduit Carlsson à suggérer que la perte en dopamine induite par la réserpine est seule responsable des symptômes parkinsoniens observés chez l’animal, ce que confirme la correction des troubles par l’injection de L‑Dopa.
Malgré quelques résistances, la dopamine prend la place qui lui est due comme nouvelle venue dans la famille des neurotransmetteurs.
Au début des années 1960, l’école d’histologie suédoise, sur la base des remarquables travaux d’histochimie de HILLARP, visualise et décrit pour la première fois des populations neuronales productrices de monoamines et permet en fait de comprendre que la richesse en dopamine du striatum est due à son innervation massive par les neurones de la substance noire. Il devient possible de détecter et de décrire des populations neuronales dans le système nerveux central, sur la base de leur contenu en neurotransmetteur. Soixante ans après les travaux de CAPAL, une nouvelle neuroanatomie est en train de naître.
Stimulé par les découvertes des équipes suédoises, HORNYKIEWIEZ (un autrichien) démontre alors que le striatum des sujets parkinsoniens présente une perte massive en dopamine.
La dopamine acquiert ses lettres de noblesse en médecine lorsque COTZIAS et al. démontrent en 1967 que l’administration de L‑dopa chez des sujets atteints de maladie de Parkinson corrige efficacement certains des symptômes les plus invalidants, en particulier le tremblement.
Grâce à la conjonction des approches de pharmacologie, de neurochimie, et de neuroanatomie, le lien est fait entre un neurotransmetteur, ses fonctions et une maladie neurodégénérative. Pour la première fois, on dispose, sur des bases rationnelles, d’un traitement symptomatique efficace pour cette maladie.
Quarante ans plus tard, malgré ses limites, la L‑dopa reste le traitement de référence de la maladie de Parkinson.
A partir des années 1960, grâce à ces découvertes, les travaux consacrés à la dopamine prennent un essor considérable dans de nouveaux champs des neurosciences et de la médecine. Au-delà de l’intérêt des hypothèses et des résultats de A. CARLSSON et de ses collaborateurs dans la compréhension et le contrôle de la transmission dopaminergique, ces découvertes ont donné un formidable élan à la neuropsychopharmacologie.
Des défis majeurs restent cependant encore à relever, parmi lesquels la compréhension des mécanismes biologiques des psychoses et des conduites addictives (dans lesquelles la dopamine est impliquée), et la mise au point de thérapeutiques permettant aux patients concernés de recouvrer une vie normale.
(adapté de Med Sciences 2000 ; 16 :1285 – 8)
Vincent PAILLE
Fondazione Santa Lucia, European Brain Research Institute (EBRI)
Neurphysiology laboratory,
Via del Fosso di Fiorano, 64
00143 Rome Italy
Le sommeil et les rythmes biologiques : Effets de la maladie de Parkinson
Publié le 01 novembre 2007 à 10:05Paru dans LE PARKINSONIEN INDÉPENDANT N°30 – septembre 2007
Dr Claude Gronfier, Département de Chronobiologie
Inserm U846, Institut Cellule Souche et Cerveau, Lyon-Bron
Le sommeil est loin d’avoir livré tous ses secrets. On sait qu’il est indispensable à la vie puisqu’on le retrouve dans l’ensemble du règne animal : chez les oiseaux, les reptiles, les poissons, les mammifères et même les insectes. Sa structure, sa durée, sa place dans la journée ne sont pas les mêmes chez tous les animaux. Certains sont diurnes et dorment la nuit, d’autres sont nocturnes et dorment le jour, certains sont crépusculaires et dorment un peu le jour et un peu la nuit. On observe aussi des différences chez l’Homme. Certains d’entre nous sont des petits dormeurs, d’autres des marmottes, certains sont des couche-tôt, d’autres des lève-tard. Chez un même individu, le sommeil se modifie au cours de la vie, depuis l’enfance à la vieillesse en passant par l’adolescence. Notre horloge biologique est au cœur de ces phénomènes. Dormir est une histoire de rythme. L’horloge biologique est le chef d’orchestre. Dans certaines situations de la vie courante et certaines pathologies, la belle symphonie devient cacophonie et le sommeil se dégrade. La maladie de Parkinson, connue principalement pour ses troubles moteurs, est associée de troubles du sommeil qui peuvent rendre la vie bien difficile, la nuit bien agitée et la journée bien longue !
Qu’est-ce que le sommeil ?
A la question « Qu’est-ce que le sommeil ? » les spécialistes ont toujours beaucoup de difficultés à donner une réponse simple. Et pour cause, la réponse est compliquée ! Elle est compliquée car le sommeil est un état actif — et non passif comme on le croyait encore au début du 20ème siècle – mais aussi, et surtout, parce que l’on ignore encore LA fonction du sommeil.
Bien que le sommeil ait toujours fasciné et inquiété l’Homme, son mystère, en tout cas une partie seulement, ne s’est réellement éclaircie qu’au début du 20ème siècle. Ce n’est qu’en 1928 par le psychiatre allemand Hans Berger, que la démonstration était faite de manière indiscutable que le sommeil n’était pas un état passif. Ces enregistrements de l’activité électrique cérébrale montraient très clairement des différences de rythmes électriques entre l’état éveillé et l’état de sommeil. Le sommeil devenait alors un état actif et l’étude de l’activité électrique cérébrale au cours du sommeil ne faisait que commencer.
Une découverte majeure fut faite en France dans les années 1950. Au cours de cette décennie, Michel Jouvet découvrait à Lyon un stade particulier du sommeil qu’il appelait le sommeil paradoxal. Il observait chez le chat que l’activité électrique cérébrale dans cet état était proche de la veille alors que paradoxalement l’animal était endormi. Les travaux de Michel Jouvet à la fin des années 1950, montraient que le sommeil paradoxal était un état très particulier du sommeil, différent du sommeil à ondes lentes. Cette découverte a ensuite servi de base au concept que l’activité du cerveau au cours de la journée ne se résume pas à un état binaire (veille ou sommeil) mais qu’elle passe par 3 états de « vigilance » : la veille, le sommeil à ondes lentes et le sommeil paradoxal.
Les fonctions du sommeil
Trois grandes théories ont prévalu jusqu’à maintenant pour tenter d’expliquer la fonction du sommeil :
- La théorie restaurative : le sommeil permet de récupérer ou restaurer les déficits corporels ou cérébraux causés par les activités de la veille.
- La théorie du maintien de la veille : chez les espèces qui possèdent de faibles réserves énergétiques il faut rester éveillé pour se nourrir et donc dormir peu pour survivre.
- La théorie de la conservation de l’énergie : le sommeil permet de diminuer les dépenses énergétiques (pendant qu’on dort on dépense) au cours des 24h.
Ces trois théories sont intéressantes, mais ne sont pas satisfaisantes car de nombreuses espèces animales échappent à ces critères. Même si l’on ne connaît pas encore LA fonction du sommeil, ce que l’on peut dire avec certitude est que le sommeil n’est pas un luxe ! Le sommeil est même vital car son absence chez l’animal conduit à la mort en quelques semaines. Sans aller jusqu’à cette extrémité, on sait que la privation de sommeil ou la dette de sommeil à des conséquences chez l’Homme. A court terme, un sommeil insuffisant conduit à un état de fatigue, une baisse des performances, des troubles de la mémoire. Cela peut aller jusqu’à provoquer une irritabilité, une inefficacité physique ou intellectuelle, et conduire à des accidents du travail ou de la route. A long terme, les effets sont moins biens connus car ils sont plus difficiles à étudier, mais ils sont pernicieux car moins évidents. On pense à l’heure actuelle qu’un sommeil insuffisant de manière chronique peut conduire à l’apparition de troubles de l’humeur (anxiété, dépression), à des troubles cardiovasculaires et des troubles du métabolisme (éventuellement conduire au développement ou au maintient de l’obésité) pour n’en citer que quelques uns. En bref, on considère maintenant qu’une altération de la qualité du sommeil (volontaire ou involontaire) peut avoir un impact négatif sur l’état de santé général.
Le sommeil chez l’animal
Avant de pouvoir comparer le sommeil des différentes espèces animales, il faut tout d’abord définir ce qu’on appelle le sommeil. Deux éléments importants définissent le sommeil :
- Le sommeil est un état de désengagement perceptif, c’est-à-dire un état dans lequel l’individu (l’animal) est soustrait de l’environnement, on pourrait dire isolé intérieurement, en perdant toute sensibilité perceptive (il n’est plus sensible au bruit, a la lumière, aux odeurs, au toucher et au goût).
- Le sommeil est un état rapidement réversible, à la différence du coma, de l’hibernation, mais aussi de la mort. Au réveil, il n’existe plus aucune trace visible du passage du sommeil.
Ces éléments sont importants mais ne permettent pas de définir suffisamment précisément le sommeil. Pour cela, on fait appel à 2 critères précis, qui doivent être vérifiés simultanément pour pouvoir parler de sommeil :
- Les critères comportementaux. Le sommeil est associé à i) une posture particulière — qui dépend de l’espèce animale ; ii) une diminution de la sensibilité à environnement (nous en avons parlé au dessus); iii) un rebond de sommeil après privation : si un animal est privé de sommeil (pendant quelques heures, quelques jours), on observe lors de l’épisode de sommeil suivant une augmentation de la quantité et la qualité du sommeil.
- Les critères électrophysiologiques. Les critères indispensables permettant de s’assurer de la présence de sommeil utilisent l’activité électrique cérébrale comme marqueur (ce qu’on appelle l’électroencéphalographie de sommeil ou polysomnographie dans les cliniques de sommeil). On doit observer pendant le sommeil une activité électrique cérébrale différente de celle de la veille et des signes précis de sommeil à ondes lentes et de sommeil paradoxal.
L’existence du sommeil est indiscutable chez les mammifères, les oiseaux, les reptiles, les amphibiens et les poissons. Elle a été plus controversée chez les invertébrés. La dernière discussion passionnante en date – et toujours d’actualité — concerne le sommeil chez la mouche. A partir d’élégantes études, Chiara Chirelli, une chercheuse italienne travaillant aux états unis, a décrit le sommeil de la drosophile (la mouche du vinaigre, très étudiée en biologie). Elle a montré que cette mouche présente un rebond de sommeil après une privation (elle dort plus longtemps) et qu’elle pouvait être maintenue éveillée pendant une longue durée si on lui administrait de la caféine ou des amphétamines. Plus surprenant encore, la mouche, tout comme l’Homme, présente des troubles de la mémoire lorsqu’elle ne dort pas suffisamment ! On peut donc parler de sommeil chez la mouche.
Le sommeil chez l’Homme
La durée et le rythme du sommeil varient entre les individus
Les besoins de sommeil sont différents entre les individus d’une même espèce. Comme l’illustre la figure 1 issue d’une enquête effectuée en France 2005, près de 60% de la population interrogée dort entre 7 – 8h par nuit. Il existe des petits dormeurs qui dorment 6h et moins (23%) et des grands dormeurs qui dorment plus de 9h (15% des individus). La biologie, plus précisément, des mécanismes circadiens (contrôlés par l’horloge biologique) et homéostatiques, sont à l’origine de la durée de notre sommeil.
La croyance que les gros dormeurs sont des fainéants et que les petits dormeurs sont des courageux doit disparaître ! Nous seulement elle est stupide car ne repose sur des croyances d’une autre époque, mais elle est potentiellement dangereuse car restreindre volontairement sa durée de sommeil de manière chronique peut conduire aux symptômes que nous avons évoqués précédemment (fatigue, irritation, …), mais plus grave encore, elle peut être à l’origine d’accidents causés par des attaques de sommeil (au volant ou au travail) et elle peut conduire à développer des pathologies.
Le mal moderne des pays industrialisées est le manque de sommeil. Il faut savoir qu’on dort en moyenne 1h30 de moins qu’au début du 20ème siècle. Puisque la dette de sommeil accumulée pendant la semaine se traduit généralement par un rebond de sommeil pendant le week-end, on a tendance à croire que cela ne pose pas de problème. Rien n’est moins sûr ! Les données actuelles suggèrent même le contraire, c’est-à-dire que la dette de sommeil n’est pas sans conséquence sur la santé. Elle aurait un coût physiologique ! On pense à l’heure actuelle que la dette de sommeil est sans doute proche de 1h par jour, soit environ 5h par semaine travaillée. Dormir plus le week-end est capital pour « éponger » une partie de la dette de sommeil accumulée durant la semaine, mais cela n’est peut être pas suffisant pour restaurer tous les compartiments de l’organisme. Ce qui a été perdu est peut être perdu à tout jamais. Nous ne connaissons pas à l’heure actuelle l’étendue des conséquences d’un manque de sommeil chronique.
La quantité et la structure du sommeil varient au cours de la vie.
La structure du sommeil va se mettre en place progressivement pendant l’enfance. Le sommeil va devenir consolidé (c’est-à-dire en un seul épisode) avec la disparition de la sieste chez l’enfant (entre 4 et 6 ans en moyenne). Au cours de l’adolescence, le sommeil va progressivement se retarder, au grand dam des parents qui verront leurs enfant se coucher bien trop tard pour pouvoir se réveiller frais et dispos le matin pour aller à l’école. Heureusement, la maturation de l’horloge biologique va corriger ce phénomène et le sommeil va se normaliser chez le jeune adulte (les couche-tard biologiques resteront des couche-tard). La structure interne du sommeil, se modifiera à l’age adulte avec le vieillissement. Avec l’âge, la quantité totale de sommeil nocturne diminue et l’on peut voir se développer chez certains un sommeil polyphasique avec l’apparition d’une ou plusieurs siestes dans la journée. Le sommeil chez le sujet âgé sera souvent plus court et sa qualité moindre (on observe en particulier une diminution de l’intensité du sommeil à ondes lentes et une augmentation du nombre d’éveil). Tout comme on observe une diminution du besoin calorique au cours du vieillissement, il est légitime de se demander si le besoin de sommeil ne diminue pas de la même manière avec l’âge. Il semble toutefois que ce ne soit pas le cas pour un grand nombre d’individus puisque entre 40 et 70% des personnes âgées se plaignent de troubles du sommeil.
Le sommeil dans la maladie de Parkinson
La maladie de Parkinson est bien connue pour ses perturbations du contrôle moteur (tremblements, rigidité, akinésie). Ce qui est moins connu, ou en tout cas qui a manifesté moins d’intérêt, sont les troubles du sommeil et des rythmes biologiques. Même si James Parkinson dans son ouvrage « Assay on the Shaking Palsy » en 1817 écrivait « le sommeil devient très perturbé », les symptômes nocturnes — présents chez 75% des patients — n’ont été étudiées qu’a partir des années 1960.
Troubles du sommeil
Les troubles du sommeil du patient Parkinsonien sont caractérisés par des difficultés d’endormissement, une insomnie matinale, une fragmentation importante du sommeil (on peut observer jusqu’à 40% de veille au cours de la nuit), une diminution de la durée du sommeil à ondes lentes et du sommeil paradoxal (voir la figure 2). Les troubles de la vigilance diurne accompagnent souvent la faible efficacité du sommeil. En bref, il est souvent difficile pour le patient de s’endormir et de rester endormi la nuit alors que la journée il lui faut parfois lutter pour rester éveillé (ce qu’on appelle la somnolence diurne excessive). Alors que chez le sujet sain le sommeil est réparateur, le patient Parkinsonien se réveille souvent fatigué et peu reposé.
Troubles des rythmes biologiques
En plus des troubles du sommeil, certaines études rapportent des perturbations des rythmes biologiques chez le malade Parkinsonien. Une diminution de l’amplitude des rythmes de température et de l’activité motrice ont été décrites. Les mécanismes de régulation du système nerveux autonome sont perturbés et une perte du rythme de 24 h de la pression artérielle liée à une hypertension nocturne est observée. Les systèmes hormonaux sont semble-t-il aussi affectés : le cortisol présente une diminution de l’amplitude de son rythme de 24 h et la prolactine présente des niveaux nocturnes plus faibles. Des études récentes montrent que le siège de l’horloge biologique (le noyau suprachiasmatique) pourrait subir une perte de certains neurones impliqués dans son bon fonctionnement. De ce fait, les modifications des rythmes biologiques observés dans la maladie pourraient être la conséquence d’une altération de cette petite structure.
Impact des traitements actuels sur le sommeil
Les traitements actuels visent principalement les symptômes moteurs. Ils sont évidements indispensables, toutefois, leur impact sur le sommeil est loin d’être négligeable. Les doses élevées de médicaments dopaminergiques le soir augmentent la latence d’endormissement. Ils perturbent le sommeil de début de nuit mais peuvent augmenter la qualité du sommeil de la 2ème partie de la nuit. Utilisés dans la journée ou en soirée, les agents dopaminergiques peuvent induire des troubles de sommeil nouveaux (c’est-à-dire non liés à la maladie mais au médicament lui-même) : rêves agités, cauchemars et terreurs nocturnes (dans 30% des cas avec la L‑dopa). La L‑dopa en traitement chronique de longue durée peut induire des myoclonies nocturnes (des contractions musculaires involontaires) et des mouvements périodiques des jambes durant le sommeil. Enfin, les dyskinésies insomnies, tremblements et rigidités sont traités par de nombreux agents tels que : de faibles doses agonistes DA, des benzodiazépines ou des antidépresseurs tricycliques. Ces médicaments sont certes efficaces contre ces symptômes mais ils possèdent malheureusement des effets secondaires sur le sommeil.
La recherche actuelle : chronobiologie et maladie de Parkinson
Ces vingt dernières années, les travaux scientifiques ont permis des avancées importantes dans la compréhension, à la fois du développement de la maladie et du dysfonctionnement des structures cérébrales atteintes. Toutefois, on ne connaît toujours pas l’origine des troubles du sommeil, ni les approches qui pourraient éviter ou ralentir leur développement au cours de la maladie. Dans le cadre d’un projet multi-équipes de notre unité de recherche (faisant intervenir de nombreuses expertises dans des domaines différent allant des neurosciences à la biologie des cellules souches), nous nous intéressons, au sein du Département de Chronobiologie, tout particulièrement à l’apparition des troubles du sommeil et des rythmes biologiques dans la maladie de Parkinson. Nos projets de recherche visent en particulier à étudier si ces troubles apparaissent de manière précoce dans la maladie et pourraient ainsi constituer des marqueurs permettant d’agir plus tôt et de proposer des traitements plus adaptés que ceux existant à l’heure actuelle. Nos projets visent aussi à mieux comprendre certains symptômes bien connus des patients et pour lesquels nous n’avons pas encore d’explication, par exemple :
- Pourquoi chez environ 50% des patients, la sévérité des symptômes moteurs est elle plus faible le matin au réveil (un phénomène appelé “bénéfice du sommeil” ou sleep benefit en anglais) ?
- Pourquoi certains patients présentent des variations diurnes marquées de la rigidité/dystonie, qui est faible le matin au réveil avec une augmentation progressive de la rigidité, des tremblements et de la dysarthrie au cours de la journée ? Pourquoi les symptômes sont-ils améliorés par une sieste ?
Nous y travaillons. Nous pensons que l’horloge biologique joue un rôle dans ces phénomènes. Si c’est la cas, alors des approches chronobiologiques pourront être testées. Dans tous les cas, restez à l’écoute, nous vous donnerons prochainement des nouvelles sur l’avancement de nos travaux.
Pour en savoir plus
Les lecteurs qui voudraient en savoir plus sur les mécanismes du sommeil et des rythmes biologiques peuvent consulter les ouvrages suivants, ils sont destinés au grand public et ne nécessitent aucunes connaissances préalables :
* Sylvie Royant-Parola, Claude Gronfier, Joelle Adrien. Les mécanismes du sommeil : rythmes et pathologies, Paris, Le Pommier/Cité des sciences et de l’industrie, 2007
* Marie-Josèphe Challamel, Marie Thirion. Le Sommeil, le rêve et l’enfant. Paris, Albin Michel, 2002.
* Michel Jouvet. Pourquoi rêvons-nous, pourquoi dormons-nous ? : où, quand, comment ? Paris, Odile Jacob, 2000.
* Sylvie Royant-Parola, Comment retrouver le sommeil par soi-même, Paris, Odile Jacob, 2002.
Remerciements
Un grand merci à Madame Colette Veguer pour son invitation à Rennes et l’organisation de la Conférence du 14 mai 2007. L’organisation était parfaite, le public était nombreux et chaleureux, et la collation qui a suivi était fort agréable. Merci aussi à Madame Jacqueline Géfard pour sa chaleureuse invitation à contribuer, par cet article, au journal « Le Parkinsonien Indépendant ».
Dr Claude Gronfier
Développement d’un nouveau modèle d’étude de la maladie de Parkinson
Publié le 29 octobre 2007 à 07:12Paru dans LE PARKINSONIEN INDÉPENDANT N°30 – septembre 2007
Développement d’un nouveau modèle d’étude de la maladie de Parkinson : le rat transgénique alpha-synucléine.
La maladie de Parkinson est une maladie neurodégénérative caractérisée par la perte progressive et massive des neurones dopaminergiques de la partie compacte de la substance noire. Actuellement, les mécanismes de la maladie restent méconnus. Dans la majorité des cas, la maladie est due à une combinaison de facteurs environnementaux comme une exposition à des pesticides associée à une susceptibilité génétique.
Cependant dans moins de 10 % des cas, la maladie de Parkinson est une pathologie héréditaire. Actuellement, une dizaine de gènes ont été associés à la maladie de Parkinson parmi lesquels il y a celui de l’alpha-synucléine. Ce gène présente des mutations responsables d’une forme dominante de la maladie. Trois mutations de ce gène ont été découvertes chez des familles de patients. Le mécanisme par lequel les mutations de l’α‑synucléine entraînent la mort des neurones dopaminergiques n’est pas élucidé. Il est donc nécessaire de continuer les recherches sur les modèles animaux.
Différents modèles ont déjà été développés notamment des modèles de lésions chimiques. Ainsi au laboratoire, le rat lésé à la 6‑hydroxydopamine est utilisé pour étudier la maladie de Parkinson. Cependant, ce type de modèles ne peut pas mimer le caractère progressif de la mort neuronale observée chez les patients. C’est pourquoi, nous proposons de développer un nouveau modèle de la maladie de Parkinson.
Notre modèle est un rat transgénique qui va exprimer l’α‑synucléine humaine doublement mutée. En effet, la construction que nous avons utilisée pour créer notre rat contient le gène humain de l’α‑synucléine avec deux des trois mutations connues chez l’Homme. Ce gène est placé sous le contrôle du promoteur de la tyrosine hydroxylase de rat, enzyme de la synthèse de la dopamine. Ainsi nous espérons que le transgène sera exprimé dans les structures dopaminergiques du cerveau de notre rat, telles que la substance noire.
Le but de l’étude est de développer et de caractériser différentes lignées de ce rat afin d’obtenir un modèle qui se rapprochera le plus possible de la maladie humaine. La construction d’animaux transgénique est un travail difficile. L’expression du transgène peut varier entre les animaux fondateurs qui, chacun, donneront une lignée. Nous souhaitons développer un rat qui va présenter tous les signes de la maladie de Parkinson, c’est-à-dire, les symptômes moteurs caractéristiques, l’altération des fonctions olfactive et gustative, les troubles cognitifs ainsi que les pertes cellulaires associées. A long terme, nous souhaitons tester de nouvelles stratégies thérapeutiques et notamment la greffe de cellules souches (mésenchymateuses, neurales).
Pour le moment, nous sommes dans la phase de caractérisation de notre modèle. Nous développons actuellement trois lignées de ce rat transgénique.
La première lignée compte aujourd’hui cinq générations et présentent des résultats très encourageants. Les premières expériences que nous avons réalisées sont des immunohistochimies sur des coupes de cerveaux. Ces expériences consistent à marquer, par l’intermédiaire d’anticorps, notre transgène. Nous pouvons alors cartographier l’expression de l’α‑synucléine humaine mutée dans le cerveau de nos rats. Ainsi, nous avons observé une forte expression de l’α‑synucléine humaine, dans un premier temps (à trois mois) au niveau des bulbes olfactifs. Puis chez les rats plus âgés, nous retrouvons une expression de plus en plus importante au niveau de la substance noire, la principale structure du cerveau atteinte dans la maladie de Parkinson, et au niveau du locus coeruleus, une autre zone du cerveau atteinte plus tardivement chez les patients. Un double marquage de l’α‑synucléine humaine et de la tyrosine hydroxylase de rat a permis de démontrer une colocalisation de l’α‑synucléine humaine mutée dans les neurones dopaminergiques au niveau des bulbes olfactifs et de la substance noire.
La forte expression du transgène au niveau des bulbes olfactifs est à mettre en relation avec une altération de la fonction olfactive de nos rats avec l’âge. Or, l’un des premiers signes observés chez les patients est une perte de l’olfaction. Notre rat présente donc les premiers symptômes de la maladie de Parkinson. Pour évaluer la fonction olfactive de nos rats, nous avons mis au point différents tests. Tout d’abord, à l’âge d’une semaine, nous testons tous les nouveaux nés de notre élevage pour savoir si nos rats présentent une altération de la fonction olfactive dès la naissance. Pour cela, nous avons mis au point un test basé sur la reconnaissance par le raton de l’odeur de sa mère. Pour cela, nous avons un dispositif à deux tiroirs (Fig 1). D’un côté, nous remplissons le tiroir avec de la sciure propre et de l’autre, avec de la sciure de la cage de la portée. Puis nous plaçons le raton au milieu du dispositif et nous observons son comportement sur deux minutes. À une semaine, les rats sont encore aveugles et vont donc se déplacer uniquement grâce à leur odorat. Tous nos rats, transgéniques et témoins, ont le même comportement. Ils passent la majorité du temps de l’expérience au dessus du tiroir contenant la sciure de leur cage et reconnaissent donc les odeurs de leur portée et notamment celle de leur mère. Nos rats ne présentent donc pas de troubles de la fonction olfactive à la naissance ce qui est encourageant puisque nous souhaitons que le rat développe la maladie avec le temps.

Ensuite nous avons testé la fonction olfactive de nos rats adultes. À l’âge adulte, les rats ne sont plus aveugles et vont donc se servir de leur vue pour se déplacer. Il nous faut alors mettre au point un test qui permet d’observer une réaction des rats vis-à-vis de l’odeur. Nous avons réalisé un premier test avec de l’acide acétique, une odeur répulsive. Pour cela, nous présentons au rat un morceau de papier filtre imbibé d’acide acétique à 40 % et nous observons les réactions du rat. S’il perçoit l’odeur, il va naturellement faire un mouvement de recul, s’il ne la perçoit pas, il va rester le museau au contact avec le papier filtre. Nous pouvons ainsi comparer les rats témoins avec les rats transgéniques. Nous avons pu observer que les rats transgéniques ne font pas de mouvement de recul à chaque fois que nous présentons le papier filtre imbibé d’acide acétique. Ils ont donc une altération de leur fonction olfactive. Cependant, après quelques mois, tous nos rats transgéniques et témoins se sont habitués au test. En effet, lorsque nous présentions le papier filtre imbibé d’acide acétique, les rats coupaient leur respiration pendant quelques secondes, ce qui ne permet plus de faire une différence entre les rats transgéniques et les rats témoins.
Nous avons donc mis au point un nouveau test basé sur la perception d’une odeur non plus répulsive mais attractive. Dans ce test, nous plaçons le rat dans une cage d’un mètre sur un mètre avec dans un des quatre coins un morceau de papier filtre imbibé d’eau et dans le coin opposé un autre papier filtre imbibé d’une solution de lait de coco (Fig 2). Ensuite nous observons pendant deux minutes le comportement du rat. Grâce à un système de capteurs, nous pouvons enregistrer les déplacements du rat. Nous comparons alors le temps passé du côté du papier filtre imbibé de la noix de coco par rapport à celui passé du côté du papier filtre imbibé d’eau. Nous avons ainsi observé une différence entre les rats transgéniques et les rats témoins. En effet, alors que les rats témoins passent la majorité du temps de l’expérience du côté de la noix de coco, les rats transgéniques explorent toutes les zones de la cage indifféremment. Ce test permet de mettre en évidence une altération de la fonction olfactive chez les rats transgéniques à l’âge adulte dès six mois.

En parallèle, des tests moteurs et neurologiques sont effectués tous les mois. Les animaux passent tous dans différents tests tels que le rotarod (cylindre tournant à vitesse constante ou accélérée qui permet d’évaluer la coordination motrice des rats), le stepping test (pour tester l’initiation du mouvement), le test d’entrée dans la cage, etc. Aucun trouble moteur n’a pour le moment été détecté chez nos rats transgéniques. Cependant les rats testés les plus âgés n’ont que 15 mois, ce qui correspond à un peu moins de la moitié de la vie d’un rat. Nous espérons donc qu’ils développent des symptômes moteurs très prochainement. Certains présentent quelques signes moteurs anormaux dits de « clasping ». Ces gestes sont observés lorsque nous tenons les rats par la queue, la tête en bas. Certains rats transgéniques vont alors s’accrocher les pattes entre elles alors que les rats témoins ne présentent aucun signe et gardent les pattes écartées.
Les deux autres lignées développées sont plus récentes et n’ont pour le moment donné que deux générations. Ces lignées doivent être développées suffisamment avant de pouvoir être caractériser. Cependant, pour l’une d’elles, nous avons exploré l’expression du transgène à 3 mois au niveau du cerveau. Nous avons pu observer une expression de l’α‑synucléine humaine au niveau de la substance noire plus importante par rapport aux rats de la première lignée. Le fait d’observer une expression plus forte de l’α‑synucléine humaine au niveau de la substance noire permet d’espérer une apparition plus précoce des symptômes moteurs dans cette lignée.
La recherche sur ces modèles animaux permet de mieux comprendre les mécanismes de la maladie de Parkinson et d’envisager de nouvelles stratégies thérapeutiques. L’étude de l’apparition des symptômes précoces tels que l’altération de la fonction olfactive devrait donner des informations sur l’origine de la perte neuronale au cours de la maladie de Parkinson.
Rédigé par Cécile BOYER, INSERM Nantes
Chercheuse financée par CECAP Recherche
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.