Qu’est-ce que la maladie de Parkinson (Par Parkinson Suisse du mois de décembre 2018)
Publié le 06 juillet 2019 à 13:26Article paru dans LE PARKINSONIEN INDÉPENDANT n°77
Epidémiologie du Parkinson
Fréquence
Le syndrome parkinsonien (maladie de Parkinson) figure parmi les neuropathologies les plus fréquentes. On dénombre près de 6,3 millions de patients dans le monde. Selon différentes études, leur nombre passera à près de 8,7 millions d’ici 2030. Plus de 15 000 parkinsoniens vivent en Suisse. Le Parkinson frappe environ 1 % des plus de 60 ans et 3 % des plus de 80 ans. Un patient sur cinq est âgé de moins de 60 ans lors du diagnostic. Les hommes et les femmes sont presque autant touchés les uns que les autres.
Transmissibilité
La maladie est héréditaire dans 5 à 10% des cas, pour lesquels la cause réside dans la déficience d’un certain gène. Pour autant, les facteurs de risque génétique jouent également un rôle dans la forme non héréditaire du Parkinson.
Espérance de vie
L’espérance de vie des parkinsoniens est presque aussi élevée que celle des personnes en bonne santé.
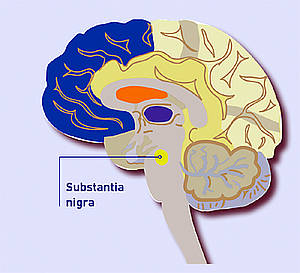
Ce qui se passe dans l’organisme
Le Parkinson est une maladie neurodégénérative qui provoque la disparition progressive des neurones dans le cerveau. Au cours des premières années de la maladie, c’est la destruction des neurones responsables de la production de dopamine (neurotransmetteur) dans la substantia nigra (substance noire, située dans le cerveau moyen) qui figure au premier plan. La carence en dopamine qui en résulte est à l’origine de divers troubles de la motricité.
Ces derniers peuvent être traités de manière adéquate par administration de L‑Dopa, le précurseur de la dopamine. Toutefois, relativement tôt dans l’évolution de la maladie, des neurones qui n’ont rien à voir avec la production de dopamine meurent dans d’autres régions du cerveau. Ce processus génère une série de symptômes (par ex. troubles végétatifs, douleurs, troubles du sommeil, symptômes psychologiques) qui deviennent de plus en plus pénibles pour les patients au fur et à mesure que la maladie progresse. Malheureusement, les possibilités thérapeutiques pour lutter contre ces symptômes sont encore très limitées.
Causes du Parkinson
Bien que la maladie de Parkinson ait été décrite pour la première fois en 1817 par le médecin anglais James Parkinson, et malgré les importants efforts déployés par la recherche, ses causes restent inexpliquées. Il semble néanmoins qu’elle résulte d’une combinaison de facteurs environnementaux et d’une prédisposition génétique. Jusqu’à présent, aucun facteur particulier n’a pu être identifié comme étant le seul déclencheur. Il est possible d’en atténuer les symptômes, mais à ce jour rien ne permet de ralentir ou de stopper sa progression.
Les symptômes du Parkinson
Les symptômes de la maladie de Parkinson varient considérablement d’une personne à l’autre. De même, la maladie ne progresse pas au même rythme chez toutes les patientes et tous les patients. Chacun est atteint de « son » Parkinson, caractérisé par une symptomatologie unique.
- Ralentissement des mouvements (bradykinésie, akinésie) Les successions de mouvements fluides sont de plus en plus difficiles. Ce sont principalement les automatismes primaires comme la marche ou l’écriture – que les personnes en bonne santé effectuent sans réfléchir – qui défaillent, mais la motricité fine est également affectée. Cette akinésie augmente au fur et à mesure que la maladie progresse.
- Rigidité (raideur) La maladie de Parkinson accroît en permanence la tonicité des muscles, notamment dans les bras et les jambes. Les patients ont l’impression que leurs membres sont « paralysés » et souvent, ils souffrent de crampes douloureuses. Leur position voûtée est elle aussi une expression de la raideur musculaire accrue.
- Tremblements de repos Les tremblements de repos, qui se manifestent chez près des deux tiers des parkinsoniens, sont souvent plus prononcés d’un côté aux stades précoces de la maladie. Les bras sont généralement plus fortement touchés que les jambes. Les tremblements disparaissent lors des mouvements ciblés.
- Instabilité posturale L’équilibre est assuré par un système de régulation complexe, dans lequel les réflexes automatiques posturaux et stationnaires jouent un rôle central. Aux stades avancés de la maladie de Parkinson, sa perturbation peut entraîner des chutes dangereuses.
- Autres symptômes Parmi les autres symptômes fréquents de la maladie de Parkinson, on compte les problèmes psychologiques (par ex. les dépressions), les troubles du rythme circadien veille-sommeil et les troubles du système nerveux végétatif (régulation de la tension artérielle, digestion et régulation de la température). Aux stades avancés, les troubles cognitifs ne sont pas rares.
Évolution du Parkinson
L’atrophie cellulaire dans la substantia nigra progressant constamment, les symptômes se multiplient également. Les foulées rapetissent. Les tâches de précision (se laver les dents, fermer des boutons, écrire, bricoler) sont de plus en plus pénibles, la voix devient souvent plus basse et elle perd de son intelligibilité. La mimique diminue, le corps a parfois tendance à se courber vers l’avant. Il faut savoir que la progression de la maladie et sa symptomatologie sont très personnelles.
Son évolution et son degré de gravité varient considérablement selon les patients. Les deux à cinq premières années de la maladie, pendant la phase dite de « lune de miel », le traitement antiparkinsonien médicamenteux est simple, fiable et efficace ; la plupart des patients peuvent vivre quasiment normalement. Au cours de cette première phase, l’action médicamenteuse est très équilibrée pendant la journée ; les fluctuations sont rares, voire complètement absentes,
Malheureusement, à mesure que la maladie progresse, l’effet des médicaments s’affaiblit. Le contrôle des symptômes devient plus difficile et varie pendant la journée. Les mouvements excessifs involontaires (dyskinésies), qui alternent avec des phases d’immobilité marquée, constituent une conséquence des fluctuations d’action. À ce stade, il n’est pas rare que les symptômes non moteurs (dépressions, troubles cognitifs, troubles de la digestion, fluctuations de la tension artérielle, etc.) augmentent également
Compte tenu des variations d’action, les intervalles entre les prises de médicaments doivent être réduits. Il est également possible d’utiliser les médicaments en association avec des substances qui prolongent leur action. Afin d’optimiser le réglage, les neurologues traitants doivent laisser à la personne concernée suffisamment de temps pour décrire ses symptômes et le moment de leur apparition. Une étroite collaboration entre le médecin et le patient est indispensable.
Aux stades avancés, il peut s’avérer utile de procéder à des bilans stationnaires dans un centre Parkinson spécialisé. Au cours du séjour, l’effet des médicaments et les symptômes peuvent être contrôlés précisément sur une plus longue période et le traitement peut être adapté en conséquence. Par ailleurs, la neuroréadaptation (logopédie, ergothérapie et physiothérapie) est essentielle. Les programmes d’exercices et de traitement ciblés qui sont élaborés peuvent aider les parkinsoniens à mieux gérer leur quotidien
Quand les médicaments par voie orale ne permettent plus de contrôler les symptômes de manière satisfaisante, les thérapies par pompe (apomorphine ou Duodopa®) ou les méthodes chirurgicales (stimulation cérébrale profonde) peuvent être envisagées. Ces traitements invasifs ont fait la preuve de leur efficacité.
Aujourd’hui, les patients ont une espérance de vie presque normale et leur qualité de vie peut être stabilisée très longtemps à un bon niveau ou tout au moins à un niveau acceptable.
Diagnostic du Parkinson
La maladie de Parkinson commence presque toujours par des phénomènes d’indisposition physique. Ils ne sont pas caractéristiques et ils ne se précisent que peu à peu. Au cours de cette phase, le médecin traitant est l’interlocuteur privilégié. Il est essentiel d’observer les changements et les symptômes sur une longue période, tout en les consignant dans un « journal » qui sera ensuite présenté au médecin. En effet, ce dernier a besoin du plus grand nombre d’informations possible. Plus le diagnostic est établi rapidement, mieux c’est.
À l’heure actuelle, le diagnostic du syndrome parkinsonien idiopathique est principalement clinique. Il repose sur les antécédents symptomatiques et les investigations neurologiques. Les examens complémentaires tels que l’IRM crânienne, la tomographie par émission de simples photons (TEMP) et l’échographie apportent une confirmation.
Pour établir le diagnostic clinique, la bradykinésie et au moins un autre symptôme (par exemple les tremblements ou la raideur) doivent être présents. La réaction à la L‑Dopa est un important critère d’aide pour diagnostiquer la maladie de Parkinson.
Syndromes parkinsoniens atypiques
Quatre parkinsoniens sur cinq souffrent du syndrome parkinsonien idiopathique (ou maladie de Parkinson). Beaucoup plus rares, les autres syndromes parkinsoniens atypiques sont moins connus. De nombreux syndromes parkinsoniens atypiques (SPA) gravitent dans l’orbite de la maladie de Parkinson, c’est-à-dire du syndrome parkinsonien idiopathique, forme la plus fréquente et la plus connue. Ils se différencient difficilement les uns des autres. On distingue : l’atrophie multi-systématisée (AMS), la paralysie supranucléaire progressive (PSP), la dégénérescence cortico-basale (DCB), la démence à corps de Lewy (DCL)
Pour diagnostiquer à coup sûr un syndrome parkinsonien atypique (SPA), seul le diagnostic pathologique du tissu cérébral (par biopsie ou autopsie) est fiable. Il est impossible de le réaliser sur des patients en vie. Aussi, de nos jours le diagnostic repose-t-il uniquement sur des critères cliniques – et le taux d’erreur peut atteindre 30 %. L’existence de plusieurs listes de critères pour un même groupe de symptômes dans le cas de différents syndromes parkinsoniens atypiques prouve l’incertitude qui prévaut lors de l’établissement du diagnostic.
Il en va de même des révisions internationales récurrentes des critères de diagnostic clinique en vigueur (DCB, PSP). À ce jour, jamais ces critères n’ont été validés de manière prospective ni confirmés sur le plan clinique-pathologique pour chaque SPA. En outre, les études publiées ces dernières années ont révélé un élargissement du champ des symptômes et troubles cliniques possibles, ce qui accroît la complexité du diagnostic précoce de tous les SPA.
La différenciation des différents SPA entre eux et par rapport au syndrome parkinsonien idiopathique (SPI) est cruciale, surtout aux stades précoces de la maladie. Il serait en effet possible d’établir plus aisément un pronostic et de mettre en place un traitement adéquat. Par ailleurs, un diagnostic précoce univoque est fondamental pour le progrès scientifique et une meilleure connaissance des causes de la maladie, ainsi que pour la recherche de nouvelles options thérapeutiques. Malgré plusieurs décennies de recherche, l’étiologie et les mécanismes pathologiques des SPA restent incertains. Sur le plan thérapeutique, les possibilités actuelles sont encore très limitées
Les procédés d’imagerie médicale (IRM) et les méthodes de diagnostic de laboratoire disponibles actuellement ne permettent guère d’établir un diagnostic précoce fiable. En conséquence, la recherche s’oriente vers de nouveaux biomarqueurs (mesures spécifiques à un SPA). Ils sont par exemple intégrés dans des analyses génétiques ou des méthodes d’essai en laboratoire permettant l’examen du sérum ou du liquide céphalo-rachidien. On les utilise aussi dans des procédés d’imagerie fonctionnelle spécifiques
Prof. Dr méd. Mathias Sturzenegger
Numéro 132 du Parkinson Suisse décembre 2018
Jean Graveleau
4 Commentaires Cliquer ici pour laisser un commentaire
Laisser un commentaire
Flux RSS des commentaires de cet article. Rétrolien URI
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.
@Bernard92
Le résultat est impressionnant ! Bravo, belle trouvaille Bernard. Malheureusement cette opération peu invasive n’est pas pratiquée dans nos contrées et le coût… c’est bien triste que les malades français ne puissent pas en profiter.
Tout comme J‑C PREVOST pour le patch du Pr Fourtillan, je regrette votre scepticisme sur la lumière rouge infra rouge et proche infra rouge. Vous n’avez pas dû lire mon commentaire sur une étude expérimentale suisse ayant mesuré la diffusion transcranienne des ondes proche infra rouge sur un vrai crâne humain…
Commentaire by Brainstorming — 4 mars 2020 #
Bernard bonjour, bien vu pour cette information.
En effet cela parait intéressant, fallait y penser. Une tractotomie pallidothalamique. En claire le circuit qui commande les influx moteurs (réflexes) d’un des deux noyaux du thalamus est sectionné. Si les tremblements étaient coté droit et pied droit , mieux vaut éviter de conduire la personne ne pourra plus freiner à temps, pardon c’est mon sens critique…
Bravo cela apporte du confort.
Votre critique au sujet des patchs du Pr Fourtillan(Valentonine) n’est pas justifiée et repose sur des ragots journalistiques.
Cordialement
Commentaire by Jean- claude PREVOST — 3 mars 2020 #
Bonjour, Nous sommes par notre condition de malades très exposés aux charlatans (Vieleight, la lumière rouge, les patch’s miraculeux de Sœur Josepha etc… ) mais pour une fois, une solution destinée aux « tremblements dominants » réfractaires aux traitements semble bien réelle. Il s’agit d’une intervention, la tractotomie pallidothalamique (PTT), désolé pour le jargon, mise au point en Suisse puis aux États Unis en utilisant la technique de l’échographie focalisée guidée par RM (MRgFUS): très approximativement expliqué, l’échographie est focalisée très précisément sur la zone du cerveau à traiter sans aucune chirurgie
Si vous êtes dans ce cas (tremblements dominants réfractaires aux traitements) il est peut-être utile de vous documenter :
https://sonimodul.ch/?lang=fr
https://www.frontiersin.org/articles/10.3389/fsurg.2019.00002/full ?
https://www.sciencedirect.com/science/article/abs/pii/S1878875018323520?via%3Dihub
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4266014/
https://m.facebook.com/summercopeland92/videos/10155807347485432/
Je crois que ça n’a pas encore été signalé sur GP29.
Malheureusement c’est encore très coûteux ( 35000 Francs suisse). C’est la Suisse!!!
Bonne chance.
Commentaire by Bernard92 — 1 mars 2020 #
Pouvez vous me dire et m informer ce que je dois faire moi même depuis 2 ans est la maladie de Parkinson. Je suis un peu perdu et en plus j ai de l anxiété depuis longtemps j ai un antidépresseur mais je me sens mal dans ma peau ’ j aurai que quelqun m aide. Il surment des clinique pour casino.merci
Commentaire by Dominique Lancon — 17 juillet 2019 #