Pharmacocinétique appliquée : notions élémentaires
Publié le 20 avril 2002 à 18:10Aucun médicament efficace n’est anodin (Aspirine comprise)
L’utilisation prolongée, dans le traitement des maladies chroniques, entraîne des effets indésirables parfois sévères qui justifient l’observation d’une thérapie aussi prudente et réfléchie que possible.
Beaucoup de prescripteurs, souvent sous la pression des malades eux-mêmes, ont tendance à forcer les doses et à simplifier leur administration. C’est le danger de la pratique du « qui peut le plus, peut le moins » et du « matin, midi et soir ». N’accablons pas les médecins, la routine guette toutes les professions techniques et la médecine n’est pas seulement un art !
Beaucoup de médecins de familles et de spécialistes connaissent très bien leurs patients et savent les soigner, aussi notre intention n’est pas d’interférer dans cette relation de confiance.
Si cela peut être utile, nous donnons ici quelques rudiments pour faciliter le dialogue entre le praticien et le malade et obtenir un traitement satisfaisant, évoluant de façon prudente avec la maladie.
Le livre de J.P Labaune : « Pharmacocinétique », Edit. Masson, est la source essentielle des notions de base résumées ci-après.
1) Trajectoire du médicament vers la cible et perte en route (fig. 1)
La figure 1 résume le sort du médicament administré par voie orale.
Une partie seulement parvient à la circulation générale (41 % dans notre exemple), c’est la biodisponibilité.
Véhiculée par le sang, cette partie disponible, en partie fixée et neutralisée est distribuée dans tous les organes et tissus, dont l’organe cible (qui reçoit seulement 6.1 % de la dose dans notre exemple).
L’organisme se débarrasse du produit par la fonction d’excrétion. Cette « auto-épuration » se caractérise par le paramètre de clairance. La ½ vie est l’intervalle de temps durant lequel une concentration X de médicament est réduite de moitié.
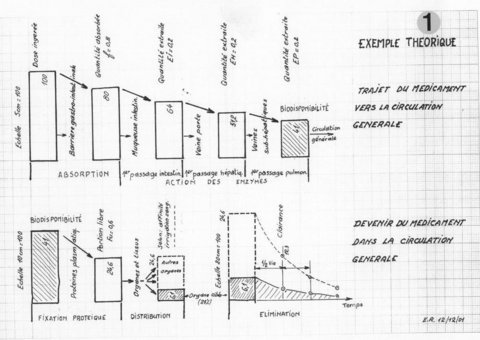
Généralement, ces paramètres sont indépendants de la dose administrée, la cinétique est dite linéaire, mais varient avec les individus.
2) Dose administrée (fig. 2)
L’effet thérapeutique d’un médicament est surtout lié à la valeur des concentrations plasmatiques. On peut définir :
‑Un seuil thérapeutique, en dessous duquel aucun effet n’est obtenu,
‑Une limite supérieure, au delà de laquelle apparaissent des effets indésirables,
‑Entre les deux, un intervalle thérapeutique dans lequel les concentrations sont actives et non toxiques.
3) Fréquence d’administration (fig. 3)
Problème posé :
‑Parvenir rapidement à l’efficacité thérapeutique.
‑Maintenir une concentration active, dans l’intervalle thérapeutique.
‑Eviter les accumulations toxiques.
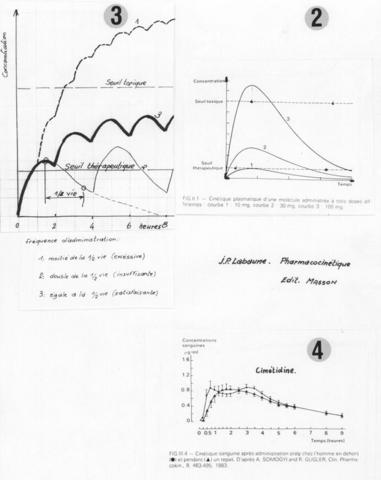
Règle générale :
La dose unitaire étant bien adaptée, l’intervalle entre deux prises doit être proche de la ½ vie du produit.
4) Facteurs influençant la pharmacocinétique (fig. 4,5 et 6)
De nombreux facteurs influencent les paramètres pharmacocinétiques : âge, insuffisance rénale et hépatique, facteurs génétiques, interactions médicamenteuses… Nous évoquerons seulement ici l’alimentation et les rythmes biologiques.
Alimentation.
Elle peut influencer l’absorption et l’effet de premier passage, c’est à dire la biodisponibilité :
‑On peut en faire un bon usage : ainsi dans le cas de la cimétidine (traitement de l’ulcère gastrique), l’alimentation ne modifie pas le coefficient d’absorption mais retarde le premier pic d’absorption et élimine le second(fig. 4). Pour être plus efficace, la cimétidine doit être administrée au cours du repas, de manière que le pic de concentration coïncide avec le pic de sécrétion gastrique.
-A l’inverse, il faut privilégier la prise de L‑Dopa (traitement du Parkinson) en dehors des repas pour éviter d’en ralentir la vidange gastrique et pour limiter sa dégradation dans l’estomac.
Pour la sieste ou le coucher suivant de près les repas, se coucher sur le côté droit facilite et accélère la vidange gastrique
Rythmes biologiques. Chronocinétique.
Les plus familiers concernent le caractère saisonnier du développement des espèces animales et végétales (rythme circannuel) et l’alternance veille/sommeil (rythme circadien, de période 24 heures).
Ce phénomène affecte bien des fonctions et la médecine a appris à les connaître et à les utiliser (en chimiothérapie par exemple).
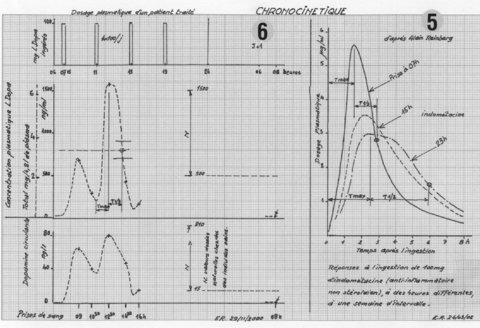
Sur l’exemple de la figure 5, entre les prises de 07 heures et 23 heures, les paramètres pharmacocinétiques : pic de concentration, temps de montée au pic : T max et demi-vie : T ½, varient dans un rapport de 1 à 2. La dose unitaire peut être insuffisante à certaines heures.
L’exemple de la figure 6, donne les résultats pour un Parkinsonien en cours de traitement. Les six prises de sang ne permettent pas une analyse complète et détaillée, on retiendra :
-La confirmation du diagnostic par le dosage de 08 heures à J+1 : pas de dopamine naturelle ou endogène.
-La plus grande efficacité relative de la L‑Dopa prise à 10 heures.
-La brièveté relative de son action
5) Application pratique (fig. 7 et 8)
Dans cet exemple réel, pour adapter le traitement à l’évolution de la maladie, il s’agissait de tirer le meilleur profit d’une augmentation de 25 % de la dose journalière, établie depuis 3 ans et ½ et de passer de 4x125 mg Modopar soit 500 mg/jour à 625 mg/jour, soit en L‑Dopa, de 400 mg à 500 mg/jour. Passons sur le détail des essais successifs, toujours prolongés sur 5 jours pour bien juger de leur effet, pour en arriver à la solution préférée par le malade et validée par le neurologue (Cf. fig. 8) :
‑Maintien des horaires des prises et des repas (le laboratoire fabricant recommande un délai minimum de ½ heure avant le repas et 1 heure après)
‑Maintien de 4 prises.
‑Modulation des doses unitaires.
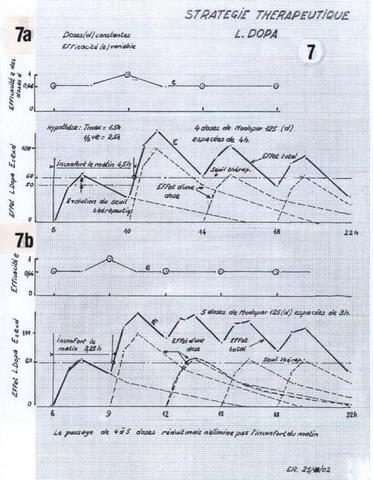
Le choix est basé sur les manifestations de la maladie et les considérations techniques exposées dans les paragraphes précédents, traités dans le graphique que nous préconisons (fig.7).
Pour un tracé plus facile, la courbe en cloche représentative de l’effet de tout médicament absorbé, est schématisée par 4 segments de droite (voir exemple sur la prise de 18 heures. Fig. 7b).
Les valeurs de base : temps de montée au pic : T max et ½ vie : T ½ , ne sont généralement pas fournies sur les notices d’utilisation, mais elles sont dans le Vidal que vous pouvez demander au médecin ou au pharmacien de consulter.
La cinétique du médicament étant linéaire, l’effet total © est la somme des effets des doses successives (A+B). Le passage de 4 à 5 doses par jour de Modopar 125, donne en principe un meilleur effet total, plus élevé et plus lisse que la thérapie antérieure : 4x125 mg, devenue insuffisante. Son essai a été infructueux.
Les données des figures 5 et 6 invitaient dès lors à penser que la dose unitaire de Modopar, de 125 mg, était insuffisante à certaines heures, passant à un effet inférieur au seuil thérapeutique, ce qui fait intervenir la chronocinétique, représentant une efficacité variable des prises (e).
On peut prendre en compte cette variation d’efficacité (e) comme indiqué sur les figures 7 et 8, l’effet (E) de chaque prise (d) résultant du produit (e x d).
E = e x d
Cette correction permet de se référer à un seuil thérapeutique invariable dans la journée.
Le dosage plasmatique (figure 6) indique pour ce patient, une efficacité inférieure de la première prise par rapport à la seconde (dosage de la dopamine circulante).
En compensation, on a ajouté une gélule de 62.5 mg deModopar à cette première prise et, sans justificatif particulier, un second supplément de 62.5 mg de Modopar à la troisième prise. L’amélioration a été très sensible et les doses successives 187.5, 125, 187.5 et 125 mg, ont été adoptées pendant 1 mois environ, avec satisfaction (fig. 8a).
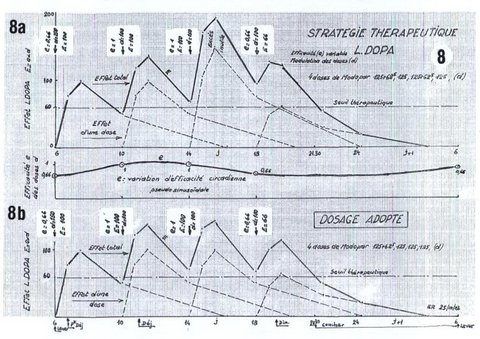
Le neurologue et le patient voulurent dès lors s’assurer que l’augmentation de la dose journalière (2x50 mg de L‑Dopa) était pleinement justifiée. Le doute concernait la prise additionnelle de 62.5 mg de L‑Dopa à 14 heures. Elle a pu être supprimée sans conséquence (fig. 8b).
Ce constat est en accord avec l’hypothèse d’une variation d’effet circadienne simple, pseudosinusoïdale, schématisée sur la figure 8. Cette hypothèse mériterait d’être confirmée par une étude plus complète du dosage plasmatique.
La dose journalière finalement adoptée n’est donc que de 450 mg de L‑Dopa. L’amélioration ressentie semble surtout résulter de l’effet de « booster » de la dose additionnelle de 50 mg de L‑Dopa le matin, qui évite un long sous-dosage, pénalisant toute la journée du patient.
L’inconfort nocturne étant jugé acceptable, il reste une courte période de manque le matin pendant une demi-heure, acceptée également et il est conseillé de se coucher avant 21 heures 30.
Avril 2002, modifié en octobre 2002. E. Rainon
Émile Rainon
27bis route de Limours
78470 Saint Rémy Les Chevreuse
Tél. : 01 30 52 94 82
Principales sources :
§J.P Labaune. Dr en Pharmacie. Pharmacocinétique. Edit. Masson.
§A. Reinberg. Dr de recherche au CNRS. Les rythmes biologiques. P.U.F (Que sais-je ?)
§Vidal professionnel 2000.
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.