Nicotinothérapie : aidez-nous !
Publié le 31 janvier 2014 à 00:22Un député, Mr Thierry Benoît, a interpelé, le 29 octobre 2013, la ministre des affaires sociales et de la santé sur la pertinence du remboursement par la sécurité sociale du protocole de la nicotinothérapie, mis au point afin de lutter contre les effets de la maladie de Parkinson.
À ce jour, pas de réponse (voir ici)
Il est peut-être possible de faire avancer les choses. Écrire au Ministère, ou même l’appeler, en lui expliquant que l’urgence est là, par exemple. La question écrite porte le numéro 41198.
Ministère des Affaires sociales et de la Santé
14, avenue Duquesne
75350 PARIS 07 SP
Standard : 01 40 56 60 00
Maintenant, peut-être qu’il faudrait aussi que d’autres députés se penchant sur la question. Pour trouver l’adresse de VOTRE député : c’est ici.
[vu sur le net] Pesticides : 1200 médecins lancent l’alerte
Publié le 30 janvier 2014 à 12:40Article trouvé sur le site pourquoidocteur
Les études et les rapports sur les dangers des pesticides pour la santé se multiplient, mais pour 1200 médecins, ce n’est manifestement pas suffisant. Ces derniers viennent de lancer un appel pour alerter sur la dangerosité des pesticides.
autre article analogue, sur le site du Parisien
Pour lire l’article dans son intégralité, suivez ce lien…
Infos régionales : association de parkinsoniens de Finistère
Publié le 21 janvier 2014 à 14:04Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Nous avons nos quatre points rencontre qui fonctionnent très bien à Brest, Quimper, Quimperlé et Morlaix ainsi que nos quatre points-gymnastique adaptés pour les Parkinsoniens et encadrés par des kinésithérapeutes motivés sur Brest, Ploudaniel, Plouguerneau, Quimper. Nous envisageons la création d’un cinquième point-gym à Morlaix en 2014.
Une porte ouverte est programmée à Plouguerneau le 30 novembre pour promouvoir la nouvelle salle de sport. Notre association participera avec la tenue d’un stand. (Diaporama, distributions de documents, échanges avec le public).
Nous préparons Noël, pensons à nos adhérents qui ne peuvent plus se déplacer. Comme chaque année nous leur apporterons une boite de chocolat, des douceurs pour oublier un temps la maladie et partager un moment de convivialité.
2014 sera l’Anniversaire de notre Association, trente ans au service des malades de Parkinson, du public, des aidants, des professionnels de santé.
Après la Manche, que nous remercions pour leur accueil chaleureux et la réussite de l’A.G. CECAP, c’est à notre tour de nous y atteler. Nous nous préparons activement à recevoir nos amis du CECAP. Les dates ont été définies pour la semaine de vacances CECAP : ce sera du dimanche 5 octobre au samedi 11 octobre 2014. Les assemblées générales du CECAP et AGP se feront à Kerbeuz dans un centre de vacances « CAP France ». Vous ne serez aucunement déçu de notre choix, il y aura à la fois la mer, la campagne, la forêt, la rivière, la montagne, une grande piscine couverte (28°c), jacuzzi, sauna, Fitness (à volonté !), Repas gastronomiques (écrivez-nous au sujet de l’inscription et le programme des festivités); nous espérons vous voir nombreux en vacances dans le Finistère.
Nous continuons les informations auprès de la formation professionnelle des futurs travailleurs sociaux, AFPA de Brest, Maison Familiale rurale de Plouvenez-Lochrist et l’Association junior senior sur Quimperlé grâce à des équipes enthousiastes. Merci à tous ceux qui œuvrent pour la bonne marche de notre Association.
J’ai participé à la demande de la directrice de l’INSERM à la relecture de protocoles de recherche sur Parkinson. Pour le moment j’ai corrigé deux protocoles : Purpan Toulouse et La Salpêtrière Paris. La relecture consiste à traduire le langage scientifique en langage commun, Le but étant de simplifier la lecture de protocole, qu’il soit lisible pour tout public. Nous sommes actuellement en France 70 relecteurs toutes associations confondues inscrits à INSERM-ASSOCIATIONS.
Nous avons organisé le 12 octobre 2013 une conférence animée par le Professeur Pascal Derkinderen et le chercheur Thomas Clairambault. Environ 160 personnes se sont déplacées pour écouter les explications de la recherche sur les intestins. Le public a pu échanger avec les chercheurs et poser leurs questions. L’après midi s’est terminé autour d’un café. Merci à eux pour leur disponibilité et leur gentillesse.
Au nom de tous les Finistériens, nous vous souhaitons de joyeuses fêtes de fin d’année,
Vivons d’espoir ! Prenez soin de vous !
Dominique Bonne Président de l’Association Parkinsoniens du Finistère
La douleur d’un deuil profond mais apaisé par G. S.
Publié le 16 janvier 2014 à 12:39Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Jamais, elle ne se serait mise en avant. Mais, aujourd’hui, je me permets de retracer ses douze années avec la maladie et son combat au quotidien pour conserver au mieux sa dignité.
Nous étions ensemble depuis 10 ans lorsque peu à peu tu t‘es sentie moins bien, tu es devenue plus fatigable et sujet à la dépression. Tu as fini par consulter. Le diagnostic est tombé : « Parkinson ». Quelques mois plus tard, en raison de fortes hallucinations, une scintigraphie venait confirmer les soupçons de Maladie du Corps de Lewy. Nous étions en 2002 mais la maladie était déjà présente depuis plusieurs années.
Avec méthode, tu t’es renseignée sur cette maladie neurodégénérative ; mais c’était difficile d’obtenir des informations précises, cette pathologie atteignant en général des sujets plus âgés. Très rapidement, tu as pris contact avec l’association de Parkinsoniens. Dans un souci d’honnêteté et de clarté, tu as tenu à informer toi-même ton entourage car tu savais que tes fonctions cognitives allaient s’altérer progressivement. Plus tard, tu exprimeras le désir d’adhérer à l’ADMD (association pour le droit à mourir dans la dignité).
Nous avons été amenés à revoir nos projets à la baisse : moins de randonnées, remplacer le petit camion par un camping-car plus confortable. Les journées étaient rythmées par la prise de médicaments : « tes petites graines » comme on disait.
Malgré tout, en 2005, nous avons fait un super voyage en Guyane avec ton fils Ronan.
En 2006, nous devions aller dans les Alpes, nous n’avons pas été plus loin que la Bourgogne : c’étaient nos dernières grandes vacances…
En 2007, tout s’est précipité, tout est devenu soudain compliqué. Tu étais devenue incohérente, tu te mettais en danger : le matin, je partais au travail en veillant à bien fermer l’arrivée du gaz. Il a fallu élaborer un plan d’aide dans l’urgence.
En 2008, les neuroleptiques (LEPONEX) ont permis de retrouver un peu d’apaisement mais j’ai quand même quitté mon travail pour pouvoir être disponible auprès de toi.
Depuis, on pourrait presque dire que ta vie se déroulait au rythme de tes chutes. Pour reprendre l’expression du neurologue, « tu avais la tension dans les chaussettes », ce qui entraînait des malaises, des petites syncopes. La maison garde des traces de tes nombreuses chutes : lampes rafistolées, rideaux déchirés, poignée du Frigo arrachée… deux cuvettes de WC explosées inondant à chaque fois la maison. Mais aussi, bien avant, deux voitures transformées en épaves : deux accidents auxquels tu as eu la chance de t’en sortir indemne.
Mais tu n’as pas échappé aux séjours à l’hôpital : mai 2010 fracture à la cheville, septembre 2011 col du fémur. La maladie n’a jamais cessé de progresser, avec parfois des paliers qui donnaient l’impression de répit. Le passage par les stades de GIR 3, GIR 2, GIR 1, venait confirmer ta perte d’autonomie.
Jamais tu ne t’es exprimée sur ton ressenti.
A plusieurs reprises, tu as fait des tentatives mais à chaque fois tu buttais, tu disais que tu ne trouvais pas les mots justes pour exprimer ce que tu vivais.
En août 2010, j’ai écrit quelques mots, des « bouts de phrases pour essayer de te rejoindre », pour t’inciter à en dire plus. Bien sûr, cela n’a pas eu l’effet escompté mais je sais que tu as relu à plusieurs reprises le petit cahier d’écolier. Peut-être y as-tu trouvé un peu de réconfort ?
Voici quelques unes de ces réflexions.
Elles donnent un éclairage sur ta maladie, sur ton quotidien…
Impression d’être condamné
A trouver tout seul les réponses
Quitte à me tromper totalement.
Parce que les mots ne sont plus tes alliés
Tu les as remisés
Comme les outils d’un autre temps
Reste ton regard : il faut y plonger
Pour trouver des mondes incertains.
La nuit, dans tes rêves agités,
Tu libères le trop-plein d’inquiétude
Tout le jour contenu.
Ton silence tes silences sont lourds de sens
Ta douceur est déroutante,
Jamais tu ne te rebelles.
Soumission, résignation
Ou profonde sagesse ?
De la patience, tu es la rude école.
Te bousculer ne sert à rien.
Une chose à la fois
Le temps pour chaque chose.
Derrière ton silence, tu es une énigme.
Comment t’en vouloir ?
Personne n’est à l’abri d’une sale maladie.
A travers ton silence,
Tu es encore plus touchante.
Parfois on dirait que tu traînes ton corps
Comme un fardeau tellement lourd
Qu’il emporte ton esprit.
Obsédée du mot juste, tu n’arrives plus
A exprimer ce que tu ressens.
Peut-être qu’il n’y a plus
De mots pour décrire ce que tu vis.
Dans tes yeux, je vois
Toute ta force, toute ta fragilité.
Résignée à la dépendance,
Tu consacres toute ton énergie
Pour conserver ta dignité.
Que d’humilité requiert le handicap :
Accepter l’aide,
Laisser son corps au soin des autres
Toujours plus de simplicité.
Autrefois, nous vivions de voyages.
Désormais, nous nous contentons
De la qualité d’une présence
Que saurai-je de tes angoisses ?
Ces réveils difficiles où tu avoues
Pudiquement avoir de mauvais rêves.
Mais bloquée derrière la barrière des mots,
Tu n’as d’autre recours qu’à un comprimé
Pour baisser la tension
Drapée de ton silence, tu as la noblesse
Des grandes dames.
Et moi, qui suis-je ? Tantôt bouffon,
Agité autour de sa reine.
Tantôt moine domestique
Consacré aux tâches répétitives
Mille façons de célébrer l’amour toujours.
Dans ton monde la tendresse n’a nul besoin
De s’extérioriser. Les mots, les caresses
Seraient un luxe pour bien-portants
Seule une lueur dans ton regard exprime
Ta reconnaissance, ta gentillesse.
Alors, comment te rejoindre
Lorsque baisers et caresses
Sont mon mode d’expression ?
Depuis j’ai été amené à me poser la question suivante : Et si ton silence était ton dernier espace de liberté ? Alors, j’ai décidé de le respecter.
Il ne nous restait plus qu’un geste, un regard pour communiquer. De la tendresse, beaucoup de tendresse, des overdoses de tendresse… à tel point que je me suis demandé si la tendresse n’était pas une drogue. Cela nous a permis de tenir jusqu’au bout.
A la fin, tout était devenu compliqué, surtout les repas. Tu dormais de plus en plus et les moments où tu étais présente se faisaient de plus en plus rares. La maladie nous a appris à vivre au présent, à profiter de l’instant. Aux premiers beaux jours, nous avons fait le tour de l’étang de Gruellau. A Pâques, tu as été un peu mieux pendant quelques jours ce qui t’a permis de participer à l’AG de l’association et de partager le repas avec nos amis parkinsoniens.
A la pentecôte, une infection pulmonaire a failli t’emporter. Depuis, tu étais en soins palliatifs. Tu as pris ton temps pour partir ; tes amis, tes proches ont pu ainsi te dire au revoir.
Depuis, au fond d’un tiroir, j’ai trouvé un papier plié en quatre au dos duquel tu avais écrit ces quelques mots au crayon :
« Soyez attentifs à ce que vous vivez, à ce que vous ressentez. C’est comme cela que vous allez vous construire petit à petit, vous connaître, connaître les sentiments qui sont en vous, les capacités, et c’est à partir de cela que vous allez les enrichir, les développer, écartant les erreurs, les reconnaissant, allant toujours plus loin.
Respectez-vous, écoutez-vous, ne vous laissez pas aller dans quelque chose qui n’est pas vous, qui est contre votre « sens », votre route, votre nature. Chacun est différent, ne vous comparez pas, ne cherchez pas à être comme… Pour plaire vous vous détruiriez. Ne vous sentez ni moins ni plus, sentez-vous vous-mêmes. Chacun a sa propre valeur.
Si vous vous reconnaissez vous-mêmes, vous acceptez vous-mêmes, vous serez reconnus, acceptés, vous serez heureux. Sinon vous serez toujours malheureux. Mais tout ceci n’est pas facile, sachez le. Cela nécessite un travail sur soi. Plus vous le ferez régulièrement, mieux vous vivrez. »
C’était comme un dernier cadeau. Cette ligne de vie, tu te l’aies toujours appliquée, veillant à être juste en toute circonstance. Merci pour cette leçon de vie.
Parmi les nombreux mots de sympathie que j’ai reçus, je voudrais citer cette phrase de l’équipe de Vivre à Domicile, les aides soignant(e)s qui l’ont accompagnée pendant cinq ans et demi : « Nous garderons l’image de son humanité et la bienveillance de son regard ».
Oui, c’est bien ce souvenir que nous voulons garder d’elle.
Rédigé par G. S.
Comment le cerveau se nettoie pendant le sommeil
Publié le 14 janvier 2014 à 12:31Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Dormir permet au cerveau de se débarrasser des toxines accumulées pendant la période de veille
On savait déjà que le sommeil permet de consolider les données apprises dans la journée. Il semblerait qu’il permet aussi au cerveau de se débarrasser de ses toxines
Des chercheurs américains pensent avoir compris pourquoi l’homme est programmé pour dormir plusieurs heures chaque nuit, alors que le sommeil le laisse vulnérable aux prédateurs. Le repos permettrait au cerveau de se débarrasser des toxines produites pendant les phases d’éveil, explique l’équipe de l’Université de Rochester (Etat de New York) dans un article publié dans la revue Science.
« La nature récupératrice du sommeil résulterait de l’élimination des déchets produits par l’activité neuronale qui s ‘accumulent pendant la période d’éveil », explique le Dr Malken Nedergaard, le principal auteur des travaux.
Le rôle essentiel du sommeil dans l’apprentissage et la mémoire était déjà connu, mais les chercheurs ont cette fois expliqué l’intérêt chimique d’alterner les phases d’éveil et de repos. « Cette recherche a permis de voir que le cerveau a deux états de fonctionnement distincts. Il est soit éveillé et alerte, soit dormant et en mode nettoyage. Comme il ne dispose que de ressources énergétiques limitées, il est contraint d’alterner entre l’un et l’autre ».
Dans le reste du corps, c’est le système lymphatique qui élimine les déchets cellulaires. Mais il n’inclut pas le cerveau, qui reste en vase clos, protégé par un système complexe de portes d’accès moléculaires contrôlant entrées et sorties. Le cerveau utilise lui un système unique appelé « glymphatique » dix fois plus actif pendant le sommeil qu’en éveil, ont montré les chercheurs.
Les chercheurs ont pu observer pour la première fois ce système de nettoyage cérébral grâce à une nouvelle technologie d’imagerie, utilisée sur des souris dont le cerveau est similaire à celui des humains.
Le mécanisme est intégré dans le système sanguin du cerveau. Il pompe le fluide cérébro-spinal à travers les tissus et le renvoie purifié, les déchets étant transportés par le sang jusqu’au foie où ils sont éliminés. De plus, les chercheurs ont découvert que les cellules cérébrales réduisaient leur taille de 60% quand on dort, permettant aux déchets d’être enlevés plus efficacement.
Tout cela permet notamment de nettoyer les toxines responsables de la maladie d’Alzheimer et d’autres pathologies neurologiques.
Article relevé dans le Figaro Santé du 18 Octobre 2013 par F. Vignon
La Levodopa Equivalent Dose (LED), ou comment déterminer la L‑dopa reçue par le malade
Publié le 13 janvier 2014 à 11:37Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Par Claire Smith
Les traitements médicamenteux de la maladie de Parkinson Idiopathique ont pour but de compenser le déficit dopaminergique au niveau du striatum, en administrant :
- soit un précurseur de la dopamine
- soit un agoniste dopaminergique
- ou bien en inhibant les métabolismes de la dopamine MAO‑B et COMT.
Dans un article paru dans Le Parkinsonien Indépendant n°53 de Juin 2013, des conseils d’utilisation des différents médicaments antiparkinsoniens sont donnés aux patients. (Dossier réalisé par l’Agence Nationale de Sécurité du Médicament et des Produits de Santé).
Pour établir la prescription, le neurologue va choisir parmi une panoplie d’une quinzaine de médicaments ceux qui correspondent le mieux au traitement des troubles du patient. Puis, il lui faudra doser chaque médicament, et déterminer l’efficacité globale du traitement. Au final, l’ordonnance journalière se présente comme une liste de plusieurs médicaments (de 3 à 5 par exemple), très souvent à libération immédiate, mais parfois à libération prolongée (LP) avec des dosages de plus en plus variés. Il devient alors peu évident de comparer l’efficacité de deux traitements ou de prévoir la substitution d’un médicament par un autre. C’est ici qu’intervient la notion de LED (Levodopa Equivalent Dose). C’est le sujet de l’article qui suit, rédigé à partir de comptes rendus de travaux réalisés à l’Université de Birmingham (UK) et publiés par Claire Smith.
Définition de la LED :
La LED d’un médicament est définie comme la quantité de ce médicament qui a le même effet antiparkinsonien que 100 mg de Lévodopa à libération immédiate. Dans cet article, le Sinemet 100 constitue la référence. L’effet antiparkinsonien est estimé par mesure de la motricité du patient (section III de l’UPDRS grille déterminant le degré de handicap).
Quelques exemples de Led :
- Led du Sinemet 100 mg : 100 mg
- Led du Sinemet LP 100 mg : 133 mg
- Led du Requip : 5 mg
- Led du Sifrol (sel) : 1 mg
Suite à la réaction de certains lecteurs, il parait nécessaire de fournir des explications complémentaires .Reprenons donc la comparaison entre le Sinemet à libération immédiate et la forme à libération prolongée LP, moins efficace (25 % de perte, selon Claire Smith). Si l’on compare l’effet de 2 comprimés de Sinemet, l’effet antiparkinsonien du comprimé classique est de 100, alors que celui du comprimé LP est de 75. Si on compare les Led de ces deux Sinemet, on notera qu’il faut une dose plus grande de Sinemet LP pour obtenir le même effet qu’avec du Sinemet classique (Led = 100 mg).
La Led du Sinemet LP 100 mg est donc plus grande, soit (100/75) X 100 = 133 mg
Les travaux de l’Université de Birmingham :
Il s’agit de travaux de collecte et de traitement de données sur l’ensemble des médicaments antiparkinsoniens sur le marché, jusqu’en 2009. La démarche suivie consiste tout d’abord, à collecter, à partir de mots clés « levodopa » et « equivalency », toute information de 1980 à 2009 sur l’efficacité des antiparkinsoniens, et cela pour tous les types d’études publiées en anglais. Les données ont fait ensuite l’objet de traitements statistiques (mean et mode), pour aboutir à l’obtention de Led pour tous les antiparkinsoniens.
L’étude a fourni les résultats suivants en Led, exprimés en mg, pour une quinzaine de médicaments antiparkinsoniens. Alors que les auteurs désignent chaque médicament, par le nom de sa molécule (Pramipexole, Ropinirole etc..), nous avons volontairement conservé les dénominations commerciales (Sifrol®, Requip® etc..) plus familières aux lecteurs francophones :
Médicaments à base de Levodopa :
- Sinemet 100 à libération immédiate : 100 mg
- Sinemet 100 à libération prolongée LP : 133 mg
- Modopar 125 à libération immédiate : 100 mg
- Stalevo : 77 mg
- Duodopa : 90 mg
Agonistes dopaminergiques :
- Sifrol (sel) 1 mg
- Requip 5 mg
- Neupro 3,3 mg
- Trivastal 100 mg
- Parlodel 10 mg
- Célance 1 mg
- Dopergine 1 mg
Inhibiteurs :
- Deprenyl 10 mg
- Otracel 1,25 mg
- Azilect 1 mg
- Mantadix 100 mg
Les valeurs fournies par Claire Smith sont commentées et parfois contestées dans la revue NeuroTalk, par des blogueurs qui fournissent par ailleurs quelques informations complémentaires. Signalons aussi que ces valeurs retenues sont corroborées par un tableau d’équivalence de dose fourni par Defebvre et Vérin, à la page 163, de leur livre « La maladie de Parkinson ».
Utilisation de la Led :
Désormais, on connait la Led de chacun des médicaments composant une ordonnance journalière. On peut alors calculer l’équivalent Levodopa pour chaque médicament en appliquant la formule : (Posologie journalière / Led) X 100 en mg. Exemple : pour une prescription de 2 comprimés de Requip 4 mg : 8/5 X 100 = 160 mg. On peut ensuite calculer la dose globale journalière, en additionnant les équivalents Lévodopa.
Soit une ordonnance comprenant :
3 comprimés de Sinemet à 100 mg soit : 100/100 X 300 = 300 mg
1 comprimé de Sinemet LP à 100 mg, soit : 100/133 X 100 = 75 mg
1 comprimé de Azilect 1 mg soit : 1/1 X 100 = 100 mg
1 comprimé de Requip à 8 mg soit : 8/5 X 100 = 160 mg
Soit un total d’équivalent Levodopa par jour de : 635 mg
Il s’agit d’une dose journalière plutôt moyenne. Cette dose peut excéder 1 000, voire 1 500.
Bibliographie :
— Levodopa Dose Equivalency par Claire Smith du Clinical Trials Unit de l’Université de Birmingham (UK).
— Levodopa Dose Equivalency dans la revue NeuroTalk
Traduit et transmis par Jean Pierre Lagadec jpmo5@orange.fr
[vu sur le net] Maladie de Parkinson : premiers résultats prometteurs pour une thérapie génique
Publié le 10 janvier 2014 à 19:45Article vu sur le site du Monde
Déjà expérimentée chez l’animal, une thérapie génique a fait l’objet d’un essai chez quinze patients souffrant depuis au moins cinq ans d’une maladie de Parkinson et présentant les complications motrices classiquement observées avec le traitement médicamenteux.
Pour lire cet article dans son intégralité, suivez ce lien…
Ça aussi, c’est bon pour les neurones !
Publié le 07 janvier 2014 à 10:46Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
« Quand le corps soigne l’esprit » Relevé dans Ca m’intéresse de Décembre 2013
Relaxer son corps pour relancer son cerveau :
La relaxation est la capacité du corps à relâcher ses muscles, ralentir le rythme cardiaque et la respiration. Les méthodes sont multiples, partant du corps (relaxation musculaire progressive, respiration profonde) ou de l’esprit (méditation, visualisation).
Elle permet de s’opposer aux effets du stress et de l’anxiété, améliore le sommeil ainsi que les performances cognitives lors de tâches simples. Ses effets passeraient par une modification de l’expression de certains gènes. Une étude parue en 2013 montre ainsi que ceux qui pratiquent la relaxation, même novices, expriment moins certains gènes impliqués dans le stress et l’inflammation, et d’avantage d’autres gènes, engagés dans le métabolisme énergétique.
Mobiliser les muscles du sourire pour se sentir joyeux :
Une étude de juin 2012 de l’Université du Kansas l’a confirmé : sourire déstresse et rend heureux. Ce simple mouvement d’environ 17 muscles faciaux a suffi à déclencher dans le cerveau des participants, bien qu’ils soient plongés dans une activité stressante, des modifications biochimiques libérant les tensions. Il favoriserait la production d’endorphines. « Sourire envoie un message positif à notre cerveau, qui nous transmet en retour une sensation de bien être », renchérit le Dr Nathalie Rapoport-Hubschman. Ces vertus n’ont pas échappé aux maître yogis et taoïstes qui recommandent la pratique du « sourire intérieur ». Il suffit de visualiser une situation positive, ce qui se solde par un mouvement vers le haut de la commissure de nos lèvres.
Déstresser en se faisant masser :
Circulation sanguine, oxygénation du cerveau… Les études du Touch Research Institute de Miami prouvent qu’un massage de quinze minutes bihebdomadaire chez les adultes, diminuent le stress ressenti au travail. « Le taux de cortisol, hormone du stress, chute tandis que l’ocytocine (hormone de la confiance et du bien-être, ndlr) augmente » précise Isabelle Bachelet, praticienne en massage tuina. L’interaction entre peau et cerveau s’explique, selon le Pr Didier Anzieu car « tous deux proviennent d’un tissu unique, l’ectoderme, qui se forme au 21ième jour de l’embryon ».
S’hydrater pour irriguer ses méninges :
On sait qu’il est nécessaire d’hydrater régulièrement notre corps, composé à 60% d’eau. Notre cerveau, lui, en compte 80%. Certaines études concluent qu’une perte d’eau sévère (équivalente à 5% ou d’avantage du poids corporel) ou plus modéré (2%) mais rapide (qui s’installe en quelques heures) altérerait les fonctions cognitives, entraînant une confusion, des difficultés à se concentrer, des céphalées, une plus grande irritabilité. Ces effets seraient particulièrement perceptibles chez les enfants et les personnes âgées. Des études ont montré que des enfants de 6 à 9 ans étaient moins performants pour effectuer des exercices faisant appel à la mémoire et l’attention s’ils n’avaient pas assez bu.
par Soizic Vignon soize.vignon@orange.fr
Le Dipraglurant® Une arme contre les dyskinésies
Publié le 03 janvier 2014 à 09:25Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Depuis plusieurs années, la firme pharmaceutique Suisse Addex Pharmaceuticals (SIX:ADXN), spécialisée en « modulation allostérique », travaille sur l’étude et le développement de molécules destinées à traiter les dystonies et les dyskinésies chez les patients Parkinsoniens.
C’est le cas du Dipraglurant® pour des patients souffrant de dyskinésie induite par la L‑dopa dans la maladie de Parkinson. La dyskinésie induite par la L‑dopa est un trouble moteur débilitant engendré par l’administration à long terme de traitements contenant de la L‑dopa, thérapie standard de référence pour la maladie de Parkinson.
L’étude conduite en parallèle aux Etats-Unis et en Europe est financée en partie par une subvention de la Fondation Michael J. Fox pour la Recherche contre la maladie de Parkinson.
Les dyskinésies :
Le Dipraglurant® ayant pour indication le traitement des dyskinésies Parkinsoniennes, rappelons pour les nouveaux lecteurs, de quoi il s’agit. Les dyskinésies font partie des mouvements anormaux (ou involontaires), dont peuvent être victimes les Parkinsoniens. Elles peuvent être décrites comme des mouvements soudains, incontrôlables, souvent désordonnés. Elles affectent les membres, la tête, les lèvres, et la langue. Elles sont en général, dues à un surdosage de la L Dopa. Or, il n’y a pas de produit pouvant remplacer la L Dopa avec les mêmes avantages.
Cela a des conséquences fâcheuses :
- Le patient (souvent en présence de son entourage ou en public) subit des crises dévalorisantes et fatigantes.
- A mesure que la maladie s’aggrave, il est de plus en plus difficile pour le neurologue d’ajuster la prescription afin d’éviter périodes de blocage et périodes de dyskinésie, l’espace thérapeutique étant de plus en plus réduit. Cette difficulté a justifié la réalisation de logiciels d’optimisation des traitements, à partir de données pharmacocinétiques (cf. article sur le Led ci-dessus et feuille de calcul présentée dans le P. I. n°32).
- Pendant de nombreuses années (après le consensus de Mars 2000), on a essayé dans certains cas bien définis de différer le début de prise de la L‑dopa pour retarder les survenues de dyskinésies.
Sait-on traiter les dyskinésies ? On reparle actuellement d’un médicament ancien, le Mantadix. On parle aussi de chirurgie à partir de la stimulation du globus pallidum. Mais les solutions les plus séduisantes seraient obtenues par l’arrivée sur le marché de 3 nouvelles molécules. L’une d’elles est le Dipraglurant®.
Changer la stratégie thérapeutique :
Si les essais cliniques à venir confirment les résultats déjà obtenus et après obtention de l’Autorisation de Mise sur le Marché (en 2014), le Dipraglurant® pourrait constituer une arme efficace contre les dyskinésies, dont il pourrait pallier, en tout ou partie, les inconvénients que nous avons évoqués précédemment. Il serait alors plus facile d’utiliser la L‑Dopa, qui est le médicament de référence pour la maladie de Parkinson.
Par ailleurs, l’arrivée sur le marché de produits contre les dyskinésies, comme le Dipraglurant®, constitue un argument en faveur du changement de la stratégie thérapeutique qui avait été définie dans le consensus 2000. On pourra en effet traiter à la L‑dopa, précocement dans la phase initiale de la maladie, si on a moins ou pas de risques de dyskinésies à long terme.
Rédigé par Jean Pierre Lagadec jpmo5@orange.fr
Bilan des deux boursières soutenues par CECAP (2/2)
Publié le 02 janvier 2014 à 09:56Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Bilan de Julie Meffre : Rôle du Noyau Subthalamique dans la Prise de Décision
A — PROJET DE RECHERCHE
1. Contexte de l’étude
Alors que la maladie de Parkinson a été longtemps abordée sur la base de ses symptômes moteurs, les troubles non moteurs qui lui sont associés font, depuis quelques années seulement, l’objet de recherches plus approfondies. La stimulation à haute fréquence (SHF) du noyau subthalamique (NST), utilisée avec succès pour traiter les troubles moteurs, peut cependant être à l’origine d’effets secondaires cognitifs comme un comportement impulsif ou risqué (tendance au jeu pathologique) chez certains patients. Il a été mis en évidence que la SHF altère la capacité à « freiner » la prise de décision face à une situation conflictuelle, conduisant les patients à prendre une décision hâtive et impulsive (Frank et al. 2007). Parmi les ganglions de la base, le NST semble être impliqué dans le contrôle de l’impulsivité/inhibition comportementale (Frank 2006 ; Eagle and Baunez 2010). La voie hyperdirecte, reliant les aires corticales frontales au NST pourrait être à l’origine de la régulation des processus décisionnels. Le NST semble agir en élevant le seuil de décision dans le cas d’une situation conflictuelle ou ambiguë, conduisant ainsi à différer la prise de décision, jusqu’à ce que suffisamment d’indices aient été accumulés.
2. But de l’étude
Afin de pouvoir améliorer l’anticipation d’éventuels effets secondaires de la stimulation à haute fréquence du NST sur la prise de décision chez les patients parkinsoniens, il est indispensable de bien comprendre le rôle de cette structure dans les processus décisionnels. L’objectif de notre travail de recherche, soutenu par la CECAP, a été de déterminer chez le rat
- comment le NST contribue à la prise de décision grâce à une approche comportementale réalisée chez des rats intacts versus des rats ayant subit une lésion du NST (mimant l’effet de la SHF du NST utilisée chez le patient parkinsonien)
- quelle est l’influence du système dopaminergique dans ce processus, et
- le potentiel thérapeutique d’un traitement visant le système sérotoninergique, système impliqué dans l’inhibition comportementale.
3. Procédures expérimentales utilisées
Animaux : 10 rats mâles Long Evans, maintenus dans un cycle 12h jour/nuit, ont été utilisés pour ces expériences. Ils ont été soumis à une restriction alimentaire, avec un accès à 85% de leur ration quotidienne. L’eau était accessible ad libitum.
Expérience : Mesure de la prise de décision impliquant l’évaluation d’un risque (en terme de probabilité de gain)
Les animaux sont placés dans une boîte opérante comportant trois leviers. Au démarrage de l’essai, seul le levier central est sorti, et les rats ont été entraînés à maintenir leur patte sur le levier central pendant une durée fixe de 1 seconde. 400 ms après le début de l’appui et pendant 600 ms, une combinaison de deux lumières s’allume au-dessus des leviers et indique quelle sera la probabilité d’obtenir 0.1 ml de sucrose 32% en cas de choix du levier correspondant à la récompense en grande quantité mais incertaine. Au bout de 600 ms, un signal sonore retentit, indiquant la possibilité d’aller appuyer sur le levier de gauche ou de droite, au choix, afin d’obtenir une récompense (0.05 ml de sucrose 32 % toujours délivré ou 0.1 ml sucrose 32 % délivré avec une probabilité variable et indicée, respectivement).
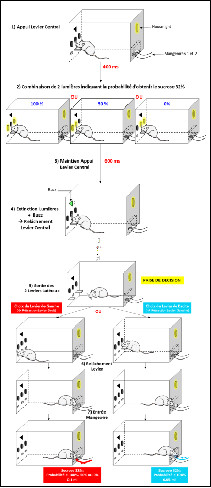
Trois combinaisons de deux lumières sont possibles, aléatoirement. Il existe trois spots lumineux situés au-dessus des leviers :
- Si la lumière de gauche et la lumière de droite s’allument, la probabilité d’obtenir 0.1 ml de sucrose 32 % en choisissant le levier de droite est de 100 %.
- Si la lumière de gauche et la lumière centrale s’allument, la probabilité d’obtenir 0.1 ml de sucrose 32 % en choisissant le levier de droite est de 50 %.
- Si la lumière de droite et la lumière centrale s’allument, la probabilité d’obtenir 0.1 ml de sucrose 32 % en choisissant le levier de droite est de 0 %.
A la fin de la seconde d’appui, le levier central se rétracte et les deux leviers latéraux sortent.
- Si l’animal choisit le levier de droite, il appuie puis peut relâcher immédiatement le levier et une dose de 0.05 ml de sucrose 32 % est délivrée dans la mangeoire dans 100 % des cas.
- Si l’animal choisit le levier de gauche, le résultat de cette action sera incertain, en fonction de la probabilité d’obtenir 0.1 ml de sucrose 32%, indiquée précédemment par la combinaison de lumière.
La condition 100% et la condition 0% permettent de vérifier la bonne compréhension de la tâche par le rat. La condition 50% permet d’évaluer le comportement à tendance risquée ou non de l’animal. Ainsi, si dans la condition où la probabilité d’obtenir la grande récompense est de 50%, le rat choisi préférentiellement le levier associé à cette grande récompense, il sera considéré comme un individu au comportement risqué et joueur.
La moitié des animaux est conditionnée avec cette règle. Pour l’autre moitié, la petite récompense est délivrée lorsque l’animal choisit le levier droit.
Chirurgie : Lésion du NST
Lorsque les animaux ont atteint un niveau de performance stable durant au moins 5 sessions consécutives, ils ont été soumis au protocole chirurgical suivant :
Tous les animaux ont été anesthésiés avec de la kétamine (50 mg/kg, i.m.) et de la médétomidine (0.26 mg/kg, i.m.) et positionnés dans un appareil de stéréotaxie.
Les rats reçoivent une injection bilatérale d’acide iboténique (9.4 µg/µl (53 mM); rats avec lésion du NST) ou de solution contrôle (tampon phosphate, 0.1 M ; rats intacts) aux coordonnées suivantes : antéropostérieur, 3.8 mm (depuis le bregma); latéral, 2.4 mm ; dorsoventral, 8.35 mm (depuis le crâne). Le volume d’injection était de 0.5 microlitres par côté injecté pendant 3 minutes avec une seringue Hamilton fixée sur une micropompe. A la fin de l’injection, les injecteurs ont été laissés en place pendant 3 min pour permettre la diffusion de l’acide iboténique.
Les animaux ont récupéré des suites de l’opération pendant une semaine avant d’être à nouveau soumis au test (dans la même tâche que celle précédent la chirurgie)
B — RÉSULTATS PRÉLIMINAIRES
près apprentissage de la tâche, les animaux ont été soumis au test de prise de décision, et le pourcentage de prise de décision risquée (évaluée par le nombre d’appui sur le levier associé à la grande récompense dans la condition où la probabilité de l’obtenir est de 50%) a été mesuré. Nous avons ainsi mesuré le pourcentage de prise de décision risquée de base chez le rat, avant lésion du NST. Nous avons pu vérifier que les performances moyennes des rats avant l’opération ne présentaient pas de différences significatives, tous les individus choisissant de manière équivalente la petite récompense certaine et la grande récompense risquée.
Les animaux ont ensuite été soumis au protocole chirurgical. Après une période de récupération, ils ont été à nouveau soumis au même test que celui précédent la chirurgie. Après lésion du NST, on observe une modification profonde du comportement des rats, qui choisissent alors préférentiellement la condition risquée (dans 80% des cas environ). Une altération du NST conduit donc à une altération de la prise de décision, favorisant un comportement impulsif et risqué. Ces résultats semblent donc indiquer que les effets secondaires cognitifs de type impulsivité et développement du jeu pathologique chez les patients traités par la SHF du NST pourraient résulter de l’inactivation du NST.
Afin d’évaluer l’influence du système dopaminergique, cible des traitements médicamenteux dans la maladie de Parkinson, dans ce processus, nous avons procédé à une injection intrapéritonéale d’un inhibiteur de recapture de dopamine, 20 minutes avant le début du test. De façon très intéressante, nous avons pu observer que ce traitement conduit, chez les rats intacts, à une très forte augmentation du nombre de prise de décision risquée, celui-ci passant de 40% à 80% environ après traitement pharmacologique aigue avec un inhibiteur de
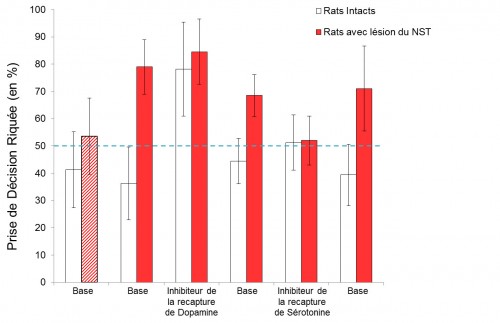
recapture de dopamine. Les rats intacts soumis à ce traitement dopaminergique présentent donc un comportement risqué similaire à celui des rats ayant subit une lésion totale du NST. Il semblerait donc que le système dopaminergique et le noyau subthalamique soient impliqués dans ce processus décisionnel.
Suite à ce traitement, les animaux ont été à nouveau soumis au test avec après avoir subit une injection de solution contrôle (sérum physiologique), afin de vérifier un retour à la normale (niveau de base) de leur performance comportementale.
Il a été mis en évidence que la SHF du NST, de même que les traitements à la L‑DOPA, induisent une diminution du taux de sérotonine, système impliqué dans l’inhibition comportementale et dans la physiopathologie de différents troubles. Afin d’évaluer le potentiel thérapeutique d’un traitement visant ce système, nous avons suivi le même protocole en utilisant cette fois un inhibiteur sélectif de recapture de la sérotonine. Il s’agit de la fluoxétine, antidépresseur couramment utilisé chez l’Homme. La fluoxétine a été administrée par injection aigue intrapéritonéale, réalisée 30 minutes avant le début du test. Nous avons pu observer que ce traitement, conduisant à une augmentation du taux de sérotonine, a pour conséquence de contrecarrer l’effet délétère de la lésion du NST sur la prise de décision : les animaux lésés présentent en effet un comportement semblable au comportement de base des animaux contrôles (c’est à dire un nombre d’appui environ équivalent entre le levier petite et grande récompense). La fluoxétine réduit donc les effets pro-impulsifs induits par l’inactivation du NST. Le système sérotoninergique pourrait donc également être impliqué dans l’altération du processus décisionnel chez les patients parkinsoniens. L’utilisation d’un inhibiteur sélectif de sérotonine, déjà couramment utilisé pour traité la dépression et d’autres troubles chez l’Homme, pourrait donc potentiellement être une perspective thérapeutique envisageable.
C — JUSTIFICATION DE L’ÉTUDE ET PERSPECTIVES
Cette étude nous a déjà permis de clarifier le rôle du NST dans les processus décisionnels chez le rat, puisque nous avons pu montrer que la perturbation de l’activité du NST par lésion de la structure, conduit à un comportement plus risqué.
Afin d’approfondir d’avantage cette étude, nous souhaiterions également étudier l’effet d’un traitement à la L‑Dopa sur cette tâche chez le rat. Ce traitement sera réalisé seul, ou en combinaison avec un antagoniste des récepteurs dopaminergiques, mimant la déplétion dopaminergique présente chez le patient parkinsonien.
Avec pour objectif de confirmer et approfondir nos recherches, nous souhaiterions vérifier la reproductibilité de ces résultats sur un nouveau groupe de rats, qui sont d’ores et déjà en cours d’apprentissage de la tâche permettant de mesurer la prise de décision.
La poursuite de ce projet nous permettrait une meilleure compréhension de l’implication du NST et des différents systèmes de neurotransmission dans les processus de prise de décision altérés chez certains patients parkinsoniens. Pouvoir anticiper et apporter une solution thérapeutique aux troubles cognitifs qui pourraient résulter du traitement chirurgical et dopaminergique chez le patient atteint de la maladie de Parkinson représente un enjeu majeur.
Lu par Jean Graveleau graveleau.jean2@orange.fr
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.