[vu sur le net] La maladie de Parkinson pourrait-elle être déclenchée par une infection intestinale ?
Publié le 27 juillet 2019 à 11:49article trouvé sur le site Santé Magazine
Une nouvelle étude publiée par des scientifiques montréalais révèle qu’une infection intestinale peut entraîner une pathologie semblable à la maladie de Parkinson chez des souris dépourvues de gènes liés à la maladie humaine.
Pour lire cet article dans son intégralité, suivez ce lien …
[vu sur le net] Percée dans le diagnostic et le traitement précoce du Parkinson à l’Université de Tel-Aviv
Publié le 26 juillet 2019 à 11:19article trouvé sur le site des amis de l’université de Tel-Aviv
Une nouvelle méthode mise au point par le Dr. Dana Bar-On, sous la direction du Prof. Uri Ashery, directeur de l’Ecole des neurosciences de l’Université de Tel-Aviv ouvre la voie à un diagnostic précoce qui permettra un traitement de la maladie de Parkinson dès son premier stade. L’étude, basée sur une technologie innovante de microscopie à super-résolution, a permis d’identifier, dès le début de la maladie, des dépôts de protéines toxiques de petite taille qui se multiplient avec sa progression.
Pour lire cet article dans son intégralité, suivez ce lien …
[vu sur le net] Une vie sexuelle active pourrait aider à ralentir la maladie de Parkinson
Publié le 26 juillet 2019 à 10:59article trouvé sur le site Doctissimo
Une nouvelle étude menée par des chercheurs italiens révèle que la maladie de Parkinson serait moins sévère chez les hommes dont la vie sexuelle est plus active que les autres.
Pour lire cet article dans son intégralité, suivez ce lien …
Pesticides : la maladie de Parkinson d’un ex-employé arboricole Reconnue d’origine professionnelle
Publié le 22 juillet 2019 à 08:54Article paru dans LE PARKINSONIEN INDÉPENDANT n°77
Il n’existe aucune donnée statistique publique, à l’échelle nationale, sur les maladies professionnelles liées aux produits phytosanitaires.
Marcel Geslin, un ancien employé arboricole mort en 2018 à 74 ans, a obtenu lundi 11 mars la reconnaissance par la justice de l’origine professionnelle de sa maladie de Parkinson. « Ce n’est pas qu’une victoire pour l’honneur. Nous souhaitons qu’elle contribue à faire évoluer la législation sur les maladies professionnelles liées aux produits phytosanitaires, afin que ce qui est arrivé à mon frère n’arrive plus », a commenté Michel Geslin, frère et tuteur de Marcel, qui a mené le combat administratif pour obtenir cette reconnaissance devant le tribunal des affaires de Sécurité sociale (TASS) du Maine-et-Loire.
Employé pendant trente-sept ans dans la même entreprise arboricole à Loiré, à l’ouest d’Angers, où il a passé toute sa vie, Marcel Geslin était préposé à l’entretien des vergers, la taille, l’éclaircissage, la cueillette… « Il ne manipulait pas lui-même les produits phytosanitaires. Mais comme tous les employés à l’époque il travaillait dans les rangs pendant et après les traitements », rapporte Michel Geslin.
Apparus en 2008 après son départ en retraite, ses troubles ont été diagnostiqués « de type Alzheimer » avant d’être requalifiés en « maladie de Parkinson » quelques années plus tard, entraînant l’ouverture d’une demande de reconnaissance en maladie professionnelle provoquée par les pesticides.
« Cette reconnaissance nous a été refusée une première fois en 2017 parce que le certificat initial de son médecin traitant n’avait fait mention que de “troubles de mémoire”. Alors même que la MSA [Mutualité sociale agricole] disposait de tous les avis des spécialistes », regrette Michel Geslin. Un deuxième refus a été opposé à la famille en 2018 pour des questions de délai d’instruction. C’est l’avis du Comité régional de reconnaissance des maladies professionnelles de Bretagne, où le cas de Marcel Geslin a été délocalisé, qui s’est révélé décisif.
« C’est un cas emblématique car il montre que les organismes de protection sociale agricole, bien que parfaitement informés, préfèrent laisser filer. Pour qui veut faire reconnaître sa maladie, c’est un parcours du combattant », assure Michel Besnard, porte-parole du Collectif de soutien aux victimes des pesticides de l’Ouest, lequel revendique 14 reconnaissances auprès des TASS de la région depuis sa création il y a quatre ans.
A l’échelle nationale, il n’existe aucune donnée statistique publique sur les maladies professionnelles liées aux produits phytosanitaires. En 2017, Patrice Heurtaut, directeur de la santé et de la sécurité au travail de la MSA avait expliqué qu’elles représentaient « 2 % des maladies professionnelles déclarées au titre du régime agricole ». Phytovictimes, autre association d’aides aux victimes professionnelles, a recensé 429 dossiers depuis sa création, en 2011, dont 92 pour des maladies de Parkinson.
Lire aussi Agriculture : « Comprendre pourquoi l’usage de produits chimiques ne baisse pas »
Le Monde avec AFP Publié le
Transmis par Emilienne Six
Lu par Françoise Vignon
Parkinson : une étude confirme que la VR peut aider les malades
Publié le 19 juillet 2019 à 10:12Article paru dans LE PARKINSONIEN INDÉPENDANT n°7t
Selon une étude menée par des chercheurs de l’université de l’Utah, la réalité virtuelle aide véritablement les malades atteints de Parkinson à retrouver l’équilibre. L’équipe a observé un gain significatif sur des patients ayant suivi un programme de six semaines.

Qui a dit que la réalité virtuelle n’est réservée qu’aux “Gamers” avec une arobase ? Une nouvelle fois, une étude scientifique vient prouver les bénéfices de cette technologie d’un point de vue médical.
Des chercheurs de l’Université de l’Utah, aux États-Unis, l’ont utilisé pour voir ses effets sur des patients atteints de la maladie de Parkinson. Pour rappel, celle-ci provoque des tremblements des membres, mais surtout un déséquilibre constant qui entraîne régulièrement des chutes. La vie quotidienne empire en même temps que la maladie attaque les muscles.
Parkinson : une rééducation en réalité virtuelle
Les scientifiques ont donc mis au point un système de réalité virtuelle de type CAVE. Celui-ci leur offre un espace sécurisé afin d’améliorer leur contrôle musculaire et leur équilibre. L’appareil bénéficiait notamment d’une protection antichute. Évidemment, le fait d’essayer la VR ne suffit pas. Ce sont 10 patients qui ont profité d’un programme étalé sur six semaines.
Pendant trois séances de 30 minutes, ils devaient marcher sur un tapis roulant tout en évitant des obstacles dans le monde virtuel. Plus, ils contournaient les objets, plus ceux-ci grossissaient lors du tour suivant. Grossièrement, il faut s’imaginer le jeu du navigateur Google Chrome quand il est hors ligne, mais projeté sur un écran incurvé au sol et au plafond.
Contrairement à ce que l’on pourrait penser, les chercheurs ont remarqué l’effet bénéfique cette thérapie VR sur les malades de Parkinson. Au lieu de perdre l’équilibre comme certains, eux ont amélioré leur réactivité musculaire ainsi que leur maintien. Les observateurs ont noté une plus grande amplitude des mouvements de la hanche et de la cheville. Cela leur permet d’éviter plus facilement les chutes.
L’avenir : adapter la technologie à des casques VR
Cette recherche a été présentée entre les 6 et 9 avril, lors de la réunion annuelle de l’American Association of Anatomists, en Floride. Les chercheurs espèrent que le dispositif permettra aux patients de diminuer le nombre de chutes. Bien conscients que Parkinson est une maladie progressive, ils considèrent qu’une telle technologie améliorerait la vie des personnes concernées.
Par ailleurs, les scientifiques ne veulent pas se limiter à l’utilisation d’un système CAVE. En effet, cet environnement virtuel performant coûte cher et demande une logistique particulière. Ils comptent adapter leur outil à des casques VR, plus facile à déployer auprès des patients dans des centres de soins.
Enfin, les experts veulent maintenant comparer les progrès des malades de Parkinson ayant effectué le programme VR avec ceux qui bénéficient d’une autre méthode de rééducation, et ceux qui n’en ont pas du tout.
Pourquoi le vieillissement cérébral ?
Publié le 17 juillet 2019 à 10:55Article paru dans LE PARKINSONIEN INDÉPENDANT n°77
Les conséquences
La première réponse à cette question de la dégénérescence du cerveau du « Parkinsonien » et de « l’Alzheimerien » est la constatation de la diminution des neurones et cellules gliales situées dans la substance noire, locus Niger pour la première pathologie, le stress cellulaire qui forment les fibrilles en régions temporale et de l’hippocampe, pour la seconde. Certains parkinsoniens ont malheureusement le risque de développer aussi cette diminution avec la dégénérescence neurofibrille. Le stockage mnésique est perturbé puis bloqué par les plaques Amyloïdes qui entravent les connexions et l’hippocampe est privé de communications ainsi que la perte des neurofibres. La cellule intrinsèque sera remplacée un temps par la protéine Amyloïde puis béta-Amyloïde puis la plaque du même nom faisant écran. Un éclairage supplémentaire sur l’Alzheimer, cette pathologie chez les anglo-saxons est appelée diabète type 3, simple à comprendre et nous met tout de suite « la puce à l’oreille » par un excès de certains nutriments et le manque d’élimination vont occasionner un stock cytotoxique.
Le scénario des causes au commencement de la maladie de Parkinson est quasi identique à l’Alzheimer même si la frontière paraît encore floue pour de nombreux spécialistes car ils se focalisent sur l’origine physiologique des symptômes, à mon humble avis le commencement n’est pas aux premiers signes mais bien avant, pourquoi ? Les zones touchées sont seulement différentes par le fait du hasard. Les récepteurs dopaminergiques ne sont plus réceptifs, une carence en dopamine progressive, car le cellulaire se meurt par l’inclusion des intrus (ex : excès de calcium d’origine mammifère). Les cellules dopaminergiques ont moins de protection. Les cellules du mouvement sont défaillantes comme les cellules nerveuses de la mémoire. Il faut noter que ce scénario est « joué » avec une grande variabilité d’un sujet à l’autre avec une réponse de « gravité » à « sévère ».
Les causes
La seconde réponse rarement développée vient étayer la première car, en moyenne le désordre apparait 40 à 50 ans après l’adolescence, suite d’une consommation déséquilibrée en nutriments essentiels et sans équilibre ACIDO-BASIQUE. Pour les officiels : « nous vivons plus longtemps qu’autrefois, [et ces maladies sont le] résultat d’une fatalité du vieillissement ». Cela plaît aux politiques et arrange bien les lobbies de l’agroalimentaire qui doucement nous empoisonnent par profits. Les années ont passé, la qualité nutritive des légumes et des fruits s’est appauvrie par les croisements, la productivité.
Une pomme d’un verger à grand rendement a 100 fois moins de vitamine C que la même variété produite il y a 50 ans. Sans vous détailler les pesticides, fongicides et engrais chimiques pour ces deux groupes. Le lait de vache (sauf lait cru bio) sous toutes ses formes, après la puberté est à bannir, car responsable de nombreux troubles.
Eviter l’alimentation acidifiante et oxydante, les barbecues, viandes grillées du week-end « carbonées = molécules de Maillard », alcool, cigarettes et les boissons avec ajout de gaz carbonique qui se balade dans le sang et ne sera pas expectoré en totalité. L’acidose que génèrent les barres sucrées chocolatées caramélisées. (Contenant bien souvent des nano particules d’aluminium, pour exemple : la mini surface de la coupe d’un cheveu représente équivalent de cent nano particules).
Quand l’acidose tissulaire devient chronique
Il faut impérativement équilibrer la consommation d’aliments acides oxydatifs par d’autres basiques alcalins (Ex : aliments antioxydants : Goyave, cassis, fraises, orange, citron, poivron rouge, betterave, brocoli, chou-fleur, noix, noisette, épinard, carotte, patate douce, tomate crue (de saison), foie de veaux, bœuf rôti ou cru, blanc de poulet, œuf, gingembre, cacao, thé vert… ). Dans toute pathologie le pH(pH Potentiel Hydrogène, facilement contrôlable avec des languettes de papier dédiées, vendues en pharmacie.) urinaire est acide, alors que pour le bien portant le pH est neutre, proche du pH sanguin. L’acidose tissulaire complexe peut se définir comme l’évidence de l’intoxication des tissus et de l’encrassage de l’organisme surtout d’origine alimentaire, ainsi que la production excessive d’acides endogènes, comme l’acide lactique produit par un effort sportif intense.
Les acides sont libérés par la fermentation dans l’intestin due à la consommation excessive de protéines animales et de produits laitiers génératrice d’acide sulfurique. L’excès de ce mauvais calcium sur les neurones dopaminergiques agit comme un empoisonnement, ils deviennent donc plus vulnérables à l’oxydation. La caséine, les peptides et débris bactériens dans l’intestin vont perturber le système immunitaire, celui-ci va donc fabriquer des anticorps, or ces anticorps vont finir par faire la confusion avec les structures de l’individu, et vont se retourner contre elles créant ainsi une affection auto-immune.
La gravité même, puisque ces cellules blanches vont s’attaquer à certains organes et empêcher l’absorption de minéraux. D’autres acides viendront amplifier le problème. Mais il existe la parade, l’équilibre se maintient par l’apport normalement de ions alcalins, comme le potassium ou le magnésium provenant des légumes et des fruits d’une bonne qualité nutritive. Or l’alimentation dite moderne n’apporte plus suffisamment de micronutriments, comme les minéraux alcalinisant ainsi que toute la panoplie des vitamines et enzymes. En revanche, le Bio est notre salut ainsi que le jardin potager sans ajout, dit phytosanitaire, sans oublier les maraîchers engagés dans l’agriculture dite responsable.
Le corps devient un producteur d’acides pour le cerveau bien que l’acidose soit métaboliquement régulée par tout un système tampon (Glutathion), l’organisme s’acidifie avec les années et ne s’alcalinise que très rarement pour les raisons expliquées plus avant. Les catalyseurs activateurs des enzymes sont carencés en vitamines et micronutriments, les acides aminées ne parviennent plus aux cellules de notre cerveau, ces acides ne sont pas évacués car non reconnues ; ils se fixent sur les fibres des tissus conjonctifs – la structure tissulaire de soutien de tous les organes – empêchant une bonne oxygénation et l’alimentation des cellules.
Cette fixation des déchets bloque les échanges indispensables avec les cellules des organes. L’acidification tissulaire provoque un enraidissement généralisé bloquant en partie les échanges de la nutrition : des fibrilles, des corps de Lewy, des protéines Tau, vont former une enveloppe de gel qui tend à se rigidifier plus ou moins hermétiquement, bloquant en partie les échanges de la nutrition, et privant ainsi le cerveau de « carburant protéines glucose ». Avec les années, le déroulement de ce scénario provoque une diminution du cerveau : la sénilité en sera malheureusement la fin.
Conclusion : Il se produit, alors, petit à petit un état de souffrance des organes avec anoxie, malnutrition, auto-intoxication cellulaire qui aboutissent à cette mort cellulaire des neurones et cellules nerveuses. Pour une explication plus simple nos cellules baignent dans une lymphe toxique acidifiée avec déchets. C’est le processus de dégénérescence, le mécanisme du vieillissement accéléré (sénescence), Alzheimer, Parkinson, Sclérose en Plaques, douleurs articulaires, arthrose, maladies auto-immunes, asthme, allergies, diabète type 1, 2, 3 ! Etc.
Et notre patrimoine génétique alors ?
Le patrimoine génétique a une infime part de « responsabilité de protection ou pas » la grande majorité de personne est protégée, en fonction de la susceptibilité du génome, qui va retarder au maximum le déséquilibre de cette inflammation chronique, à condition de ne pas abuser d’une mauvaise hygiène de vie. Il existe une exception que je qualifie de malheureuse : « les sujets porteurs d’une mutation monogéniques de la maladie de Parkinson, la mutation dite PARK2 sur le gène d’une protéine du nom de parkine et de la mutation PARK6 protéine du nom de PINK1. Dans ces deux cas la maladie à un début très précoce, vers la vingtième année, l’évolution est très lente et répond bien à la L‑Dopa », (Professeur A. Nieoullon).
Une seule solution nourrissez bien votre cerveau.
Essai pilote de nicotine transnasale dans la maladie de Parkinson
Publié le 14 juillet 2019 à 09:20Article paru dans LE PARKINSONIEN INDÉPENDANT n°77
Description de l’étude
La relation inverse largement observée entre le tabagisme et la maladie de Parkinson et les résultats de nombreuses études précliniques indiquant des effets neuroprotecteurs de la nicotine suggèrent une nouvelle intervention possible dans la maladie. À notre avis, une thérapie nicotinique optimale dans la MP consisterait en une administration pulsatile de nicotine (par exemple, par pulvérisation nasale) similaire à la nicotine pulsatile obtenue par le tabagisme. Les enquêteurs estiment que la stimulation pulsatile des récepteurs nicotiniques centraux (réalisable par pulvérisation nasale) aurait une incidence beaucoup plus favorable sur la dynamique des récepteurs nicotiniques et serait similaire à celle du tabagisme par rapport à l’administration continue de nicotine par timbre, ce qui pourrait entraîner une désensibilisation continue des récepteurs nicotiniques.
Cet essai pilote vise donc à évaluer l’efficacité du spray nasal à la nicotine (Nicotrol NS®) dans la symptomatologie de la MP. À cette fin, un total de 6 patients non-fumeurs au stade intermédiaire de la maladie (2 – 3 sur l’échelle de Hoehn et Yahr) et recevant un traitement conventionnel de la MP seront recrutés à l’Instituto Nacional de Neurologie et Neurologie (Manuel Velasco Suárez) « à Mexico. Les schémas posologiques de Nicotrol NS® à doses incrémentielles (jusqu’à 10 mg / jour) seront ajoutés aux médicaments actuels de chaque patient au cours de la première semaine. Cela sera maintenu jusqu’à 1 mois. Les aspects moteurs et non moteurs de la MP seront évalués. Les investigateurs s’attendent à une amélioration significative des symptômes moteurs et non moteurs chez tous les patients traités par Nicotrol NS® pendant le traitement et une inversion au cours du sevrage.
Description détaillée :
La maladie de Parkinson (MP), deuxième trouble neurodégénératif progressif le plus fréquent, est associée à une perte de neurones dopaminergiques dans la substance noire paralysante qui conduit à une carence en dopamine striatale. Cette perte dopaminergique entraîne des déficits moteurs caractérisés par : une akinésie, une rigidité, des tremblements au repos et une instabilité posturale, ainsi que des symptômes non moteurs pouvant également impliquer d’autres systèmes de neurotransmetteurs.
Les symptômes non moteurs peuvent inclure : déficits cognitifs (déficience de la mémoire légère à sévère, par exemple), changements affectifs (dépression, apathie et anxiété), troubles du sommeil (insomnie / hypersomnie), dysfonctionnement autonome (troubles de la vessie, hypotension orthostatique, transpiration), symptômes sensoriels (douleur, déficits visuels et olfactifs, par exemple) et gastro-intestinaux (constipation, nausée).
Le traitement de choix actuel contre la maladie de Parkinson consiste à remplacer la dopamine par son précurseur, la lévodopa (L‑Dopa), qui perd malheureusement son efficacité et peut provoquer une dyskinésie après un usage prolongé. Ce fait motive la recherche de nouvelles stratégies pharmacologiques pour mieux contrôler les symptômes et / ou la progression de la maladie.
La relation inverse entre le tabagisme et la MP a été confirmée par plusieurs études épidémiologiques. De plus, de nombreuses études précliniques indiquent des effets neuroprotecteurs de la nicotine. Ainsi, la nicotine peut offrir une nouvelle intervention dans la MP. Bien que l’utilisation d’un timbre à la nicotine ait été suggérée dans certaines maladies neurodégénératives, y compris la MP, les chercheurs estiment que la clé du succès de l’intervention nicotinique, en particulier de la MP, dépend du mode d’administration de la nicotine.
À leur avis, une thérapie nicotinique optimale dans la MP consisterait en une administration pulsatile de nicotine (par exemple, par pulvérisation nasale) similaire à la nicotine pulsatile obtenue par le tabagisme. Une stimulation pulsatile des récepteurs nicotiniques centraux (réalisable par pulvérisation nasale) affecterait beaucoup plus favorablement la dynamique des récepteurs nicotiniques que l’administration continue de nicotine via un patch, ce qui peut entraîner une désensibilisation continue des récepteurs nicotiniques. Les enquêteurs estiment également que la nicotine administrée par pulvérisation nasale, en plus de son utilité potentielle pour améliorer les dysfonctionnements moteurs, pourrait également être utile pour les symptômes non moteurs (p. Ex. Le déclin cognitif et la dépression) associés aux troubles neurologiques tels que la MP.
Ainsi, cet essai clinique pilote vise à évaluer l’efficacité d’un traitement avec un spray nasal à la nicotine (Nicotrol NS®) pendant un mois sur les aspects moteur et non moteur de la MP
Hypothèse : Les scores de l’échelle d’évaluation unifiée de la maladie de Parkinson de la Société des troubles du mouvement (MDS-UPDRS) pour la symptomatologie motrice et non motrice diminuent après un mois de traitement par spray nasal à la nicotine (Nicotrol) chez les patients atteints de MP (stades 2 et 3 de Hoehn) & Yahr).
Transmis par Dominique Bonne
Un nouveau traitement à l’essai
Publié le 11 juillet 2019 à 08:35Article paru dans LE PARKINSONIEN INDÉPENDANT n°77
Des personnes souffrant d’un stade avancé de la maladie de Parkinson retrouvent espoir grâce à un nouveau traitement développé par des chercheurs de la Western University de Londres, en Ontario (Canada).
Les scientifiques ont testé sur un petit nombre de patients un implant chargé d’envoyer une impulsion électrique au niveau des vertèbres thoraciques afin de stimuler la colonne vertébrale. Le professeur Mandar Jog de la Western University a expliqué à la BBC que l’ampleur de ce nouveau traitement allait « au-delà de ses rêves les plus fous ».
Lorsque l’on se déplace, le cerveau envoie les instructions aux jambes. En retour, celui-ci reçoit le signal une fois que le mouvement a été réalisé. Le professeur Mandar Jog explique que la maladie de Parkinson affaiblit le signal retour, « cassant la boucle » et empêchant ainsi le patient de continuer à se déplacer. Ce phénomène est appelé le freezing.
Le stimulus électrique semble contrer, ou du moins réduire, ce blocage, en améliorant le mécanisme de retour vers le cerveau des informations sensorielles issues de jambes. Cette avancée rejoint les progrès réalisés par la stimulation cérébrale profonde, une technique développée dans les années 1990 par des Français et qui a déjà aidé de nombreuses personnes atteintes de la maladie de Parkinson.
Une avancée porteuse d’espoir
Surpris de leur trouvaille, les chercheurs ont aussi découvert que les effets bénéfiques de l’implant persistaient même après l’arrêt de la stimulation de la moelle épinière. Autre point positif : un regain de confiance chez les patients dans leur capacité à marcher.
Il s’agit bien là d’une avancée, qui pourrait effectivement se traduire par une amélioration de l’état de certains malades”, souligne André Nieoullon, professeur de Neurosciences à l’Université d’Aix-Marseille, interrogé par le site d’information Atlantico.
L’ancien président du Conseil scientifique de France-Parkinson tempère : « Bien que les résultats soient encourageants, il ne s’agit pour le moment que d’études pilotes, sur un très faible nombre de malades. » En France, près de 160.000 personnes sont atteintes de la maladie de Parkinson, et environ 8.000 nouveaux cas sont détectés chaque année.
Journal le HUNTINGTON POST 24/04/2019
Par Martine Delmond
La démence à corps de Lewy est l’un des syndromes parkinsoniens atypiques. Elle est caractérisée par une attention fluctuante, des troubles moteurs et des hallucinations.
Publié le 08 juillet 2019 à 21:46Article paru dans LE PARKINSONIEN INDÉPENDANT n°77
La démence à corps de Lewy (DCL) se manifeste par un déclin des fonctions cognitives qui interfère avec la vie sociale ou professionnelle. Des troubles de la mémoire peuvent être présents au stade précoce ou terminal de la maladie. Ils sont parfois associés à des troubles de l’attention et à des troubles des fonctions dites « exécutives » (qui permettent de gérer les situations complexes ou imprévues), ainsi qu’à des difficultés à traiter des informations visuelles dans l’espace.
Un syndrome parkinsonien généralement peu sévère, akinéto-rigide et tremblant, peut se manifester au début ou en fin de maladie. Souvent précédé de chutes inopinées sans raison apparente, il répond partiellement à de faibles doses de dopamine. D’importantes fluctuations de l’attention et instabilités psychiques, parfois au cours d’une même journée ou sur plusieurs jours, accompagnées d’une confusion intermittente voire de périodes de quasi-absence, distinguent la DCL de la maladie d’Alzheimer.
Citons également les critères de distinction suivants : hallucinations visuelles précoces, récurrentes, bien formées et détaillées, dans certains cas interprétations délirantes comme le syndrome de Capgras (le conjoint n’est pas le conjoint mais un sosie), dysperceptions, besoin de sommeil accru, troubles du comportement du sommeil paradoxal présents depuis plus de dix ans (cris, paroles, rires, ou agression du conjoint en raison d’un défaut d’inhibition des mouvements générés par les rêves), fortes variations de la tension artérielle, sensations de vertiges au lever, incontinence, anxiété fluctuante et épisodes dépressifs avec apathie. On observe souvent des réactions paradoxales à certains médicaments (par exemple neuroleptiques).
On peut la diagnostiquer grâce à des procédés d’imagerie comme la tomographie par émission de positons (PET scan FDG), qui met en évidence une diminution du signal plus postérieure que celle de la maladie d’Alzheimer (pariétooccipitale préservant le cortex cingulaire postérieur). En cas de DCL, la scintigraphie de type DaT-scan ou le SPECT au bêta-CIT révèlent une perte globale de la captation de la dopamine dans les noyaux gris. L’examen du cerveau des patients parkinsoniens révèle que les corps de Lewy, observés essentiellement dans le tronc cérébral, le système végétatif et les viscères, sont diffus dans tout le cerveau. Une forme mixte associée à la maladie d’Alzheimer et une variante d’évolution très rapide sont également décrites.
Traitement :
Le traitement consiste à administrer de faibles doses de dopamine et des inhibiteurs de la cholinestérase (rivastigmine en premier choix), plus efficaces qu’en cas de maladie d’Alzheimer. Les hallucinations, les délires et les troubles comportementaux sont traités par quétiapine ou clozapine. Compte tenu d’une éventuelle hypersensibilité, ces médicaments doivent toutefois être utilisés avec parcimonie. Les troubles du comportement du sommeil paradoxal sont traités par clonazépam, gabapentine ou mélatonine.
Prof. Dr méd. Joseph-André Ghika
Membre du comité consultatif de Parkinson Suisse, est le médecin-chef du service de neurologie à l’Hôpital du Valais.
Lu dans « Parkinson Suisse »
N° 132 décembre 2018
Par Jean Graveleau
La maladie à corps de Lewy, colloque 8 janvier 2019
Publié le 07 juillet 2019 à 11:16Article paru dans LE PARKINSONIEN INDÉPENDANT n°77
Elle est la seconde maladie neurodégénérative à impact cognitif la plus fréquente après la maladie d’Alzheimer. La maladie à corps de Lewy (MCL) est une maladie complexe qui remprunte certains symptômes à la maladie d’Alzheimer et d’autres à la maladie de Parkinson. Elle est donc difficile à reconnaître ou à diagnostiquer. Moins connu que la maladie d’Alzheimer ou la maladie de Parkinson, la maladie à corps de Lewy atteint pourtant plus de 200 000 personnes en France et l’on estime à ce jour que 67% des personnes malades ne sont pas, à ce jour, diagnostiquées.
S’il est une caractéristique de la maladie à corps de Lewy c’est bien le phénomène des fluctuations dont il s’agit. Ces fluctuations sont des changements imprévisibles dans la concentration, l’attention, la vigilance et l’éveil. Ils peuvent apparaître d’un jour à l’autre ou même d’une heure l’autre. Une personne atteinte de la MCL peut regarder dans le vide pendant une longue période ou sembler somnolente ou léthargique et passer beaucoup de temps à dormir. Les idées peuvent être confuses sans logique apparente ou aléatoires. Mais à d’autres moments, la même personne sera alerte, capable de mener une conversation lucide, rire d’une blague ou même suivre un film. Bien que ces fluctuations soient courantes, elles ne se produisent généralement pas en présence d’un professionnel de santé, ce qui peut rendre le diagnostic encore plus difficile.
Face à la complexité de la maladie, à ses manifestations cliniques particulières, comme les fluctuations mais aussi les hallucinations ou les troubles du sommeil paradoxal les professionnels de santé eux-mêmes sont parfois démunis. En collaboration avec le ministère de la Santé, France Alzheimer et maladies apparentes s’est naturellement associée à France Parkinson et au réseau des aidants de la maladie à corps de Lewy pour organiser le premier colloque sur la maladie. Il s’est tenu le 8 janvier 2019 dans les locaux du ministère de la Santé regroupant : experts de la maladie, psychiatre, neurologue, gériatre, médecin généraliste, kinésithérapeute, orthophoniste et expert psychologue mais aussi personnes malades et proches aidants ont apporté leur concours à cette journée exceptionnelle.
Un dépliant résumant les symptômes et les démarches à faire face à cette maladie à corps de Lewy est actuellement à disposition de chacun auprès de France Parkinson : faites-en la demande.
Actes du colloque lus
par jean Graveleau
Qu’est-ce que la maladie de Parkinson (Par Parkinson Suisse du mois de décembre 2018)
Publié le 06 juillet 2019 à 13:26Article paru dans LE PARKINSONIEN INDÉPENDANT n°77
Epidémiologie du Parkinson
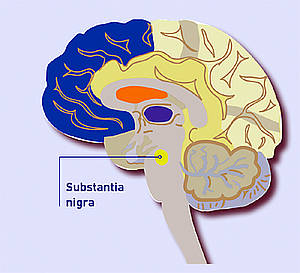
Fréquence
Le syndrome parkinsonien (maladie de Parkinson) figure parmi les neuropathologies les plus fréquentes. On dénombre près de 6,3 millions de patients dans le monde. Selon différentes études, leur nombre passera à près de 8,7 millions d’ici 2030. Plus de 15 000 parkinsoniens vivent en Suisse. Le Parkinson frappe environ 1 % des plus de 60 ans et 3 % des plus de 80 ans. Un patient sur cinq est âgé de moins de 60 ans lors du diagnostic. Les hommes et les femmes sont presque autant touchés les uns que les autres.
Transmissibilité
La maladie est héréditaire dans 5 à 10% des cas, pour lesquels la cause réside dans la déficience d’un certain gène. Pour autant, les facteurs de risque génétique jouent également un rôle dans la forme non héréditaire du Parkinson.
Espérance de vie
L’espérance de vie des parkinsoniens est presque aussi élevée que celle des personnes en bonne santé.
Ce qui se passe dans l’organisme
Le Parkinson est une maladie neurodégénérative qui provoque la disparition progressive des neurones dans le cerveau. Au cours des premières années de la maladie, c’est la destruction des neurones responsables de la production de dopamine (neurotransmetteur) dans la substantia nigra (substance noire, située dans le cerveau moyen) qui figure au premier plan. La carence en dopamine qui en résulte est à l’origine de divers troubles de la motricité.
Ces derniers peuvent être traités de manière adéquate par administration de L‑Dopa, le précurseur de la dopamine. Toutefois, relativement tôt dans l’évolution de la maladie, des neurones qui n’ont rien à voir avec la production de dopamine meurent dans d’autres régions du cerveau. Ce processus génère une série de symptômes (par ex. troubles végétatifs, douleurs, troubles du sommeil, symptômes psychologiques) qui deviennent de plus en plus pénibles pour les patients au fur et à mesure que la maladie progresse. Malheureusement, les possibilités thérapeutiques pour lutter contre ces symptômes sont encore très limitées.
Causes du Parkinson
Bien que la maladie de Parkinson ait été décrite pour la première fois en 1817 par le médecin anglais James Parkinson, et malgré les importants efforts déployés par la recherche, ses causes restent inexpliquées. Il semble néanmoins qu’elle résulte d’une combinaison de facteurs environnementaux et d’une prédisposition génétique. Jusqu’à présent, aucun facteur particulier n’a pu être identifié comme étant le seul déclencheur. Il est possible d’en atténuer les symptômes, mais à ce jour rien ne permet de ralentir ou de stopper sa progression.
Les symptômes du Parkinson
Les symptômes de la maladie de Parkinson varient considérablement d’une personne à l’autre. De même, la maladie ne progresse pas au même rythme chez toutes les patientes et tous les patients. Chacun est atteint de « son » Parkinson, caractérisé par une symptomatologie unique.
- Ralentissement des mouvements (bradykinésie, akinésie) Les successions de mouvements fluides sont de plus en plus difficiles. Ce sont principalement les automatismes primaires comme la marche ou l’écriture – que les personnes en bonne santé effectuent sans réfléchir – qui défaillent, mais la motricité fine est également affectée. Cette akinésie augmente au fur et à mesure que la maladie progresse.
- Rigidité (raideur) La maladie de Parkinson accroît en permanence la tonicité des muscles, notamment dans les bras et les jambes. Les patients ont l’impression que leurs membres sont « paralysés » et souvent, ils souffrent de crampes douloureuses. Leur position voûtée est elle aussi une expression de la raideur musculaire accrue.
- Tremblements de repos Les tremblements de repos, qui se manifestent chez près des deux tiers des parkinsoniens, sont souvent plus prononcés d’un côté aux stades précoces de la maladie. Les bras sont généralement plus fortement touchés que les jambes. Les tremblements disparaissent lors des mouvements ciblés.
- Instabilité posturale L’équilibre est assuré par un système de régulation complexe, dans lequel les réflexes automatiques posturaux et stationnaires jouent un rôle central. Aux stades avancés de la maladie de Parkinson, sa perturbation peut entraîner des chutes dangereuses.
- Autres symptômes Parmi les autres symptômes fréquents de la maladie de Parkinson, on compte les problèmes psychologiques (par ex. les dépressions), les troubles du rythme circadien veille-sommeil et les troubles du système nerveux végétatif (régulation de la tension artérielle, digestion et régulation de la température). Aux stades avancés, les troubles cognitifs ne sont pas rares.
Évolution du Parkinson
L’atrophie cellulaire dans la substantia nigra progressant constamment, les symptômes se multiplient également. Les foulées rapetissent. Les tâches de précision (se laver les dents, fermer des boutons, écrire, bricoler) sont de plus en plus pénibles, la voix devient souvent plus basse et elle perd de son intelligibilité. La mimique diminue, le corps a parfois tendance à se courber vers l’avant. Il faut savoir que la progression de la maladie et sa symptomatologie sont très personnelles.
Son évolution et son degré de gravité varient considérablement selon les patients. Les deux à cinq premières années de la maladie, pendant la phase dite de « lune de miel », le traitement antiparkinsonien médicamenteux est simple, fiable et efficace ; la plupart des patients peuvent vivre quasiment normalement. Au cours de cette première phase, l’action médicamenteuse est très équilibrée pendant la journée ; les fluctuations sont rares, voire complètement absentes,
Malheureusement, à mesure que la maladie progresse, l’effet des médicaments s’affaiblit. Le contrôle des symptômes devient plus difficile et varie pendant la journée. Les mouvements excessifs involontaires (dyskinésies), qui alternent avec des phases d’immobilité marquée, constituent une conséquence des fluctuations d’action. À ce stade, il n’est pas rare que les symptômes non moteurs (dépressions, troubles cognitifs, troubles de la digestion, fluctuations de la tension artérielle, etc.) augmentent également
Compte tenu des variations d’action, les intervalles entre les prises de médicaments doivent être réduits. Il est également possible d’utiliser les médicaments en association avec des substances qui prolongent leur action. Afin d’optimiser le réglage, les neurologues traitants doivent laisser à la personne concernée suffisamment de temps pour décrire ses symptômes et le moment de leur apparition. Une étroite collaboration entre le médecin et le patient est indispensable.
Aux stades avancés, il peut s’avérer utile de procéder à des bilans stationnaires dans un centre Parkinson spécialisé. Au cours du séjour, l’effet des médicaments et les symptômes peuvent être contrôlés précisément sur une plus longue période et le traitement peut être adapté en conséquence. Par ailleurs, la neuroréadaptation (logopédie, ergothérapie et physiothérapie) est essentielle. Les programmes d’exercices et de traitement ciblés qui sont élaborés peuvent aider les parkinsoniens à mieux gérer leur quotidien
Quand les médicaments par voie orale ne permettent plus de contrôler les symptômes de manière satisfaisante, les thérapies par pompe (apomorphine ou Duodopa®) ou les méthodes chirurgicales (stimulation cérébrale profonde) peuvent être envisagées. Ces traitements invasifs ont fait la preuve de leur efficacité.
Aujourd’hui, les patients ont une espérance de vie presque normale et leur qualité de vie peut être stabilisée très longtemps à un bon niveau ou tout au moins à un niveau acceptable.
Diagnostic du Parkinson
La maladie de Parkinson commence presque toujours par des phénomènes d’indisposition physique. Ils ne sont pas caractéristiques et ils ne se précisent que peu à peu. Au cours de cette phase, le médecin traitant est l’interlocuteur privilégié. Il est essentiel d’observer les changements et les symptômes sur une longue période, tout en les consignant dans un « journal » qui sera ensuite présenté au médecin. En effet, ce dernier a besoin du plus grand nombre d’informations possible. Plus le diagnostic est établi rapidement, mieux c’est.
À l’heure actuelle, le diagnostic du syndrome parkinsonien idiopathique est principalement clinique. Il repose sur les antécédents symptomatiques et les investigations neurologiques. Les examens complémentaires tels que l’IRM crânienne, la tomographie par émission de simples photons (TEMP) et l’échographie apportent une confirmation.
Pour établir le diagnostic clinique, la bradykinésie et au moins un autre symptôme (par exemple les tremblements ou la raideur) doivent être présents. La réaction à la L‑Dopa est un important critère d’aide pour diagnostiquer la maladie de Parkinson.
Syndromes parkinsoniens atypiques
Quatre parkinsoniens sur cinq souffrent du syndrome parkinsonien idiopathique (ou maladie de Parkinson). Beaucoup plus rares, les autres syndromes parkinsoniens atypiques sont moins connus. De nombreux syndromes parkinsoniens atypiques (SPA) gravitent dans l’orbite de la maladie de Parkinson, c’est-à-dire du syndrome parkinsonien idiopathique, forme la plus fréquente et la plus connue. Ils se différencient difficilement les uns des autres. On distingue : l’atrophie multi-systématisée (AMS), la paralysie supranucléaire progressive (PSP), la dégénérescence cortico-basale (DCB), la démence à corps de Lewy (DCL)
Pour diagnostiquer à coup sûr un syndrome parkinsonien atypique (SPA), seul le diagnostic pathologique du tissu cérébral (par biopsie ou autopsie) est fiable. Il est impossible de le réaliser sur des patients en vie. Aussi, de nos jours le diagnostic repose-t-il uniquement sur des critères cliniques – et le taux d’erreur peut atteindre 30 %. L’existence de plusieurs listes de critères pour un même groupe de symptômes dans le cas de différents syndromes parkinsoniens atypiques prouve l’incertitude qui prévaut lors de l’établissement du diagnostic.
Il en va de même des révisions internationales récurrentes des critères de diagnostic clinique en vigueur (DCB, PSP). À ce jour, jamais ces critères n’ont été validés de manière prospective ni confirmés sur le plan clinique-pathologique pour chaque SPA. En outre, les études publiées ces dernières années ont révélé un élargissement du champ des symptômes et troubles cliniques possibles, ce qui accroît la complexité du diagnostic précoce de tous les SPA.
La différenciation des différents SPA entre eux et par rapport au syndrome parkinsonien idiopathique (SPI) est cruciale, surtout aux stades précoces de la maladie. Il serait en effet possible d’établir plus aisément un pronostic et de mettre en place un traitement adéquat. Par ailleurs, un diagnostic précoce univoque est fondamental pour le progrès scientifique et une meilleure connaissance des causes de la maladie, ainsi que pour la recherche de nouvelles options thérapeutiques. Malgré plusieurs décennies de recherche, l’étiologie et les mécanismes pathologiques des SPA restent incertains. Sur le plan thérapeutique, les possibilités actuelles sont encore très limitées
Les procédés d’imagerie médicale (IRM) et les méthodes de diagnostic de laboratoire disponibles actuellement ne permettent guère d’établir un diagnostic précoce fiable. En conséquence, la recherche s’oriente vers de nouveaux biomarqueurs (mesures spécifiques à un SPA). Ils sont par exemple intégrés dans des analyses génétiques ou des méthodes d’essai en laboratoire permettant l’examen du sérum ou du liquide céphalo-rachidien. On les utilise aussi dans des procédés d’imagerie fonctionnelle spécifiques
Prof. Dr méd. Mathias Sturzenegger
Numéro 132 du Parkinson Suisse décembre 2018
Jean Graveleau
Le dernier éditorial de Jean Graveleau
Publié le 03 juillet 2019 à 08:19Article paru dans LE PARKINSONIEN INDÉPENDANT n°77
Nous allions fêter le vingtième anniversaire du Parkinsonien Indépendant. Pourtant nous sommes sur le point d’interrompre la publication pour des raisons financières. En effet, notre équilibre n’est plus assuré et un don de chaque association du CECAP va nous permettre de « boucler » cette année et ainsi de respecter nos engagements vis-à-vis de vous, chers abonnés
.
Pourquoi en sommes-nous là ? Nous vivons que des abonnements sans aide des Pouvoirs Publics ni de sponsors potentiels (par exemple des dons de laboratoires). Ceci nous permet d’exprimer sans détours notre opinion et de diffuser des informations quelquefois difficiles à entendre pour les responsables des laboratoires et des Pouvoirs Publics : nous avons toujours voulu être indépendants afin d’exprimer au mieux les intérêts des malades.
Or malheureusement, le nombre d’abonnés diminue régulièrement du fait du vieillissement de la population, des décès, mais aussi à cause du succès du site GP29, le site internet qui reprend, en plein accord avec nous, toutes nos informations gratuitement. Une augmentation du prix de l’abonnement pourrait peut-être pallier à ce déficit chronique. Cela devrait être évoqué par les responsables des associations qui suivent notre évolution dans les mois qui viennent. De même nous envoyons des numéros gratuits à des médecins, des établissements sociaux ou des professionnels de la santé : nous leur faisons appel pour qu’ils s’abonnent si ils trouvent quelque intérêt à notre revue.
Voilà tout est dit : c’est avec une grande tristesse que nous vons annonçons la fin possible d’une belle aventure qui nous a permis de grandir et d’apprendre dans chaque numéro les dernières informations collectées par tous nos correspondants. Ceci m’a permis de vivre 25 ans de traotement avec une autonomie tout à fait acceptable.
Je souhaite vivement qu’une réelle solution soit apportée vous lecteurs et abonnés qui êtes les « propriétaires » de cette revue que nous avons voulue
Jean Graveleau
Les mots nous manquent.
Jean nous manque.
Jean va nous manquer.
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.