[vu sur le net] Parkinson : 15 patients traités par thérapie génique
Publié le 31 octobre 2012 à 12:46Article trouvé sur le net du Figaro
Quinze malades atteints d’une forme avancée de la maladie de Parkinson ont été traités en France et ailleurs en Europe par une thérapie génique, grâce aux recherches menées par l’équipe de Stéphane Palfi, professeur en neurochirurgie de l’hôpital Henri-Mondor à Créteil et chercheur CEA/Inserm.
Pour lire cet article dans son intégralité, suivez ce lien…
La greffe intracérébrale : comprendre et combattre le rejet.
Publié le 25 octobre 2012 à 07:46Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
La maladie de Parkinson est une maladie progressive caractérisée par la dégénérescence bilatérale des neurones dopaminergiques de la voie nigrostriée. La destruction des neurones dopaminergiques de la substance noire a pour conséquence une diminution de la sécrétion de dopamine au niveau du striatum.
Actuellement, il n’existe pas de traitement curatif de la maladie, mais différents traitements symptomatiques sont utilisés. L’administration par voie orale de L‑DOPA (lévodopa), précurseur de la dopamine capable de traverser la barrière hémato-encéphalique, est l’un des traitements les plus couramment prescrits. Un inconvénient majeur de la prise de L‑DOPA est l’apparition, au bout de quelques années, de dyskinésies (mouvements anormaux). Une autre stratégie basée sur la stimulation électrique du noyau subthalamique, montre une efficacité sur les troubles moteurs, dans la plupart des cas, mais les risques chirurgicaux et les critères d’inclusion en font une opération accessible à un très faible nombre de patients. De plus, de nombreux symptômes ne sont pas corrigés par ces thérapies.
Aussi, il apparaît important de poursuivre les recherches sur les stratégies restauratrices, notamment la greffe intracérébrale de neuroblastes.
Des neuroblastes mésencéphaliques issus d’embryons humains (8 à 9 semaines) et transplantés dans le striatum de patients parkinsoniens ont conduit à des améliorations cliniques basées, entre autres, sur la production de dopamine par les neurones greffés. Cependant, le recours à des embryons humains est freiné par des considérations éthiques et logistiques qui limitent l’accès à ces greffes. D’où l’intérêt d’utiliser des neuroblastes d’origine animale telle que le porc. En effet, le porc présente de nombreux avantages pour la xénotransplantation : un grand nombre d’embryons à chaque portée, une facilité d’élevage, la possibilité de contrôler la reproduction des animaux et de pouvoir pratiquer des manipulations génétiques. De plus, son cerveau étant de grande taille, les neurones porcins ont la capacité d’émettre des neurites sur de longues distances comme chez l’Homme. Une survie des cellules greffées, une réinnervation du striatum ainsi qu’une récupération des fonctions motrices ont été observées lors d’essais cliniques menés chez certains patients parkinsoniens traités par des immunosuppresseurs (molécules permettant de limiter l’activité du système immunitaire). Mais le problème rencontré reste le rejet de ces greffes.
En effet, en l’absence d’immunosuppresseur comme la cyclosporine A, les greffes de neuroblastes porcins dans le striatum de rat sont systématiquement rejetées au bout de 7 – 8 semaines. Les traitements par des immunosuppresseurs prolongent la survie de la greffe, mais de manière transitoire, de plus, utilisés à fortes doses, ceux-ci entraînent des effets secondaires, notamment une toxicité rénale. Il est donc important de comprendre et d’étudier les mécanismes en cause dans le rejet pour envisager une survie à long terme de la greffe.
Diverses études ont mis en évidence un rôle important de la réponse immunitaire cellulaire dans le rejet. En effet, en l’absence d’immunosuppresseur, on observe vers 7 à 8 semaines, une forte infiltration de la greffe par des lymphocytes T et des cellules dendritiques. Cette réaction immune est accompagnée d’une activation des cellules microgliales. Elle a pour conséquence le rejet de la greffe.
Outre la réponse cellulaire, il a été observé un dépôt d’anticorps et de complément au niveau du greffon. Cette observation suggère une réponse humorale, caractérisée par la production d’anticorps, dirigés contre la greffe, qui, à ce jour, a été très peu étudiée.
Une partie de mon travail au sein de l’INSERM U1064 de Nantes a eu pour but de caractériser le rôle de la réponse humorale dans le rejet des xénogreffes intracérébrales.
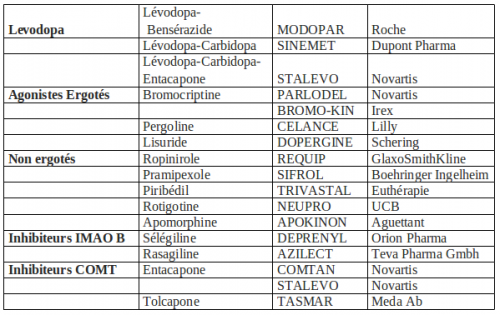
Les anticorps produits suite à la greffe vont venir se fixer sur les cellules porcines du greffon et le détruire. Nous avons pu mettre en évidence que la production d’anticorps augmentait en fonction du délai post greffe et du statut de la greffe. En particulier, une forte concentration d’anticorps est observée dans le sérum de rats pour qui la greffe est rejetée. Ces anticorps ayant la capacité de cibler différentes populations cellulaires telles que les neurones et les astrocytes.
Evolution de la production d’anticorps au cours des différents stades du rejet.
De plus, des résultats préliminaires ont montré une meilleure survie des xénogreffes dans des modèles de rats dépourvus d’anticorps. Ces données vont donc dans le sens d’un rôle de la réponse humorale dans le phénomène de rejet même s’il est important de confirmer ce résultat sur un plus grand nombre d’animaux.
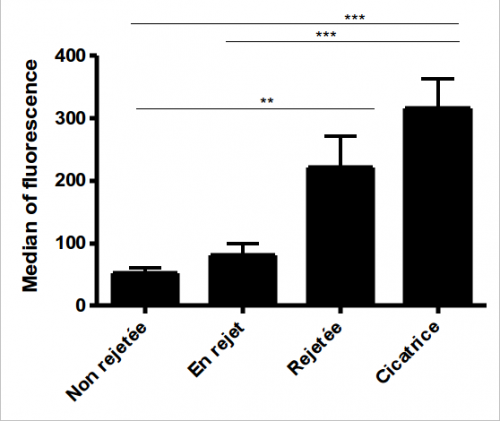
Une autre partie de mon travail a été d’envisager de nouvelles stratégies immunosuppressives afin de limiter le rejet, en particulier, par l’étude des propriétés immunosuppressives des cellules souches neurales. En effet, outre leur capacité de prolifération et de différenciation en neurones, une production de molécules immunomodulatrices par les cellules souches neurales permettrait d’induire au niveau du site de greffe une immunosuppression locale, limitant le recours à des immunosuppresseurs systémiques. Une première étude nous a permis de mettre en évidence que les cellules souches neurales de rat (NSPC) avaient des propriétés immunosuppressives limitant la prolifération des lymphocytes T, et que cet effet s’effectuait via l’hème oxygénase.
Inhibition de la prolifération des lymphocytes T par les cellules souches neurales de rat.
La suite de ce travail va se focaliser sur les propriétés immunosuppressives des populations de cellules souches neurales humaines dérivées d’IPSC (induced pluripotent stem cells). Cette étude est d’autant plus importante que l’utilisation des cellules souches neurales dérivées d’IPSCs humaines est une des voies thérapeutiques envisagées pour effectuer des auto- ou des allotransplantations à grande échelle. En effet, ces cellules sont issues de la reprogrammation de cellules somatiques adultes (ex : cellules de la peau) en cellules pluripotentes capables de s’auto-renouveler et de se différencier en différents types cellulaires. Elles peuvent donc être prélevées chez le patient pour être reprogrammées, différenciées en cellules souches neurales avant d’être greffées dans le cerveau de ce même patient (autogreffe).
La transplantation intracérébrale reste donc une thérapie prometteuse pour la maladie de Parkinson. Une meilleure compréhension des phénomènes du rejet et du potentiel immunosuppressif des cellules souches permettra d’envisager une survie à long terme de la greffe.
Je tenais à remercier tous les membres de l’association CECAP pour leur soutien dans la réalisation de ce travail.
Réalisé par Elodie Mathieux
Présentation de la maladie de Parkinson (seconde partie)
Publié le 21 octobre 2012 à 17:31Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
LES TRAITEMENTS DANS LA MALADIE DE PARKINSON
Actuellement on ne guérit pas la maladie de Parkinson, le traitement va chercher à compenser le déficit en dopamine :
- par voie orale : en apportant de la dopamine (Lévodopa) ou en stimulant directement les récepteurs dopaminergiques (agonistes) ou en réduisant la dégradation naturelle de la dopamine (IMAO B et ICOMT),
- par injection sous-cutanée (pompe à Apokinon©)
- par sonde gastrique (sonde à Duodopa),
- par intervention chirurgicale (stimulation cérébrale profonde).
La dopamine : La dopamine ne passe pas la barrière hématoencéphalique, la lévodopa, précurseur de la dopamine, est absorbée dans le duodénum et est ensuite décarboxylée en dopamine. La L‑dopa représente le traitement de référence et elle sera prescrite en première intention chez les patients de plus de 70 ans. Elle est le médicament le mieux toléré et dont l’effet moteur est le meilleur. En début de traitement, pour éviter les problèmes de nausées et chute de pression artérielle au lever, on prescrit du MOTILIUM©.
Les doses de L‑dopa seront progressives :
- une dose minimale de 300 mg/j pour pouvoir mesurer un effet,
- une posologie aux alentours de 500 mg/j est considérée comme moyenne,
- au-delà de 1000 mg/j, il s’agit d’une forte posologie.
Il est important de respecter les horaires de prescription (plus ou moins une ½ heure), jamais d’arrêt brutal (particulièrement en cas de chirurgie), prendre les doses de préférence une ½ heure avant les repas ou 1½ à 2 heures après les repas pour une meilleure efficacité.
Les effets secondaires : la L‑dopa :
- stimule les récepteurs dopaminergiques sur les artères (hypotension orthostatique),
- stimule les récepteurs du centre du vomissement situés à la base du cerveau (nausées, vomissements),
- stimule les voies de la motivation et du plaisir : risque de 15% chez les patients jeunes de troubles du contrôle des impulsions ou d’addictions au traitement ; risque de confusion et d’hallucinations chez le sujet âgé.
Les agonistes dopaminergiques : Les agonistes « miment » l’effet de la dopamine en stimulant directement les récepteurs dopaminergiques. Avantages : leur durée d’action est plus longue que la L‑dopa et permet de diminuer le nombre de prises. Inconvénients : on note une moindre efficacité sur les symptômes moteurs et des risques accrus : troubles de contrôle des impulsions chez le patient jeune, confusions, cauchemars, hallucinations chez le patient âgé. Parmi les agonistes on distingue :
- les dérivés de l’ergot de seigle qui présentent tous des risques sur le plan pulmonaire, rénal et cardiaque. On évite donc de les utiliser,
- les agonistes non ergotés. Il s’agit d’une famille hétérogène mais qui partage l’avantage sur les ergotés de ne pas induire de fibrose.
Les agonistes partagent les mêmes effets indésirables que la lévodopa mais avec une plus grande sévérité probablement du fait de la stimulation directe des récepteurs dopaminergiques. Comme pour la lévodopa, le sevrage doit être progressif. Quelque soit l’agoniste choisi : ne pas prescrire chez le sujet âgé ou en cas de troubles cognitifs, posologie progressive, hormis le cas particulier de l’apomorphine, ne pas associer d’agonistes dopaminergiques entre eux du fait du risque de potentialisation des effets indésirables, en particulier en cas de confusion hallucinatoire. Pour les agonistes non ergotés, on trouve : le ropinirole©, le pramipexole©, le piribédil©, la rotigotine© et l’apomorphine©.
L’apomorphine est un puissant agoniste d’efficacité comparable à la lévodopa. Elle est utilisée en administration sous-cutanée soit sous forme de stylo injecteur, soit sous forme d’ampoule pour utilisation de perfusion sous-cutanée en continu à l’aide d’une pompe. L’absorption sous-cutanée est rapide, l’efficacité motrice apparaissant dès les 10 à 15 minutes. Sa durée d’action est courte, de l’ordre 30 minutes à une heure, mais en terme d’efficacité, 10 mg d’apomorphine serait l’équivalent de 100 mg de lévodopa. Les troubles psychiques sont moindres qu’avec les autres agonistes.
Les inhibiteurs de la MAO B : La Sélégiline® (DEPRENYL©) et la Rasagiline® (AZILECT©) sont des inhibiteurs sélectifs de la MAO B (monoamine oxydase B) et donc réduisent la dégradation de la dopamine au niveau du cerveau et renforcent ainsi l’efficacité de la L‑dopa (10%). Les effets secondaires sont identiques à la lévodopa. On note un effet potentiellement « ralentisseur » pour la Rasagiline. Indications : soit en monothérapie (sans la lévodopa) pour un parkinson peu évolué, soit en association avec la lévodopa chez les patients présentant des fluctuations motrices de fin de dose.
Les inhibiteurs de la COMT : La COMT (cathécol-O-méthyltransférase) est une enzyme présente dans la paroi intestinale, elle diminue la biodisponibilité de la dopamine. En administrant un ICOMT avec la lévodopa, on augmente à la fois la biodisponibilité de la lévodopa et sa demi-vie.
L’entacapone® (COMTAN© ou STALEVO©) en association avec la lévodopa : augmente de plus de 10% l’efficacité motrice, colore les urines en jaune orangé ; effets indésirables : nausées, diarrhées, douleurs intestinales.
La tolcapone® (TASMAR©) : efficacité de 30%, soupçonné d’hépatotoxicité, nécessite un bilan hépatique ; effets indésirables identiques à tout traitement à la lévodopa.
L’amantadine® (MANTADIX©) : L’amantadine était utilisée comme antiviral. Son efficacité antiparkinsonienne a été découverte par hasard, elle est plus faible que celle de la lévodopa. Il a été montré un effet antidyskinétique intéressant. Sa demi-vie est longue ; pas de prise après 17H du fait du risque d’insomnie. Ses effets indésirables : hypotension orthostatique et nausées. Elle peut provoquer des hallucinations et des confusions.
La clozapine® (LEPONEX©) : La clozapine est le seul neuroleptique compatible avec un traitement antiparkinsonien. Elle est indiquée lors des psychoses dopa-induites dans la maladie de Parkinson. On a observé des effets antidyskinétiques. Elle est utilisée en cas de troubles hallucinatoires.
Pour tous les autres symptômes :
- constipation : laxatifs
- chute de tension : en priorité, utiliser des bas de contention puis Motilium, Gutron, Fludrocortisone
- Mouvements brusques ou agitation nocturne : RIVOTRIL en gouttes
- salivation excessive : injection botulique
- difficultés de mémoire, manque de motivation : EXELON
- anxiété, dépression : SEROPLEX, EFFEXOR
- sensation de déprime ou hallucinations : LEPONEX
- Freezing, instabilité ou chute : Kinésithérapie
- Voix chuchotée, difficile à comprendre : orthophonie
La pompe à apomorphine : La pompe délivre en permanence en sous-cutané de l’apomorphine, avec la possibilité d’ajouter une quantité supplémentaire (bolus) en cas de blocage. Elle s’adresse au patient fluctuant (phases ON/OFF) ou en cas de phases de dyskinésie prolongées. Elle permet : de réduire le traitement oral, d’améliorer la qualité de vie du patient et de renforcer son autonomie, de diminuer les fluctuations motrices, de diminuer progressivement les dyskinésies.
Le bénéfice thérapeutique est très net, l’impression clinique globale d’amélioration se situe entre 50 et 70%, tant d’après le patient que d’après son entourage. En dehors d’une détérioration cognitive sévère et de symptômes psychotiques, il n’y a pas de contre-indications, en particulier l’âge n’est pas une limitation. La pompe à apomorphine représente une alternative en cas de contre-indication à la stimulation cérébrale profonde.
La première mise en place nécessite un séjour hospitalier (environ 10 jours). Ensuite, au domicile, une infirmière ou une personne de l’entourage intervient pour la mise en place quotidienne de la pompe. Il faut compter près de 6 mois pour arriver au bon débit (environ 3 mg par heure). Elle est posée le matin au réveil et retirée le soir au coucher. Il faut éviter de la poser 24h/24h, sauf en cas d’akinésie douloureuse nocturne sévère, en raison du risque d’échappement thérapeutique au fur et à mesure du temps (perte de l’effet du traitement au fur et à mesure du temps lorsque la pompe est posée 24h/24). Il faut changer régulièrement de site d’injection pour éviter les nodules. Du fait de son coût, la pompe à apomorphine est mal acceptée dans les EHPAD (Etablissement hospitalier pour personnes âgées dépendantes).
La sonde à Duodopa : La sonde permet une administration intestinale en continu de lévodopa en suspension dans un gel. Elle assure un débit continu 24/24 H avec la possibilité de bolus si besoin. Cette technique est réservée au patient à un stade avancé, répondant bien à la dopathérapie : lorsqu’il n’y a pas de résultats avec les antiparkinsoniens oraux, lorsque la pompe à apomorphine est mal tolérée ou insuffisamment efficace, lorsque le patient est exclu de la stimulation cérébrale profonde.
Après des tests à l’aide d’une sonde nasoduodénale pour mesurer l’efficacité de la Duodopa, une sonde à demeure est mise en place lors d’une gastrotomie endoscopique percutanée. La Duodopa en continu permet de réduire les périodes OFF aussi bien que les dyskinésies. Les contre-indications sont les mêmes que celles de la lévodopa. L’utilisation de cette technique est limitée par son coût.
La stimulation cérébrale profonde : Avant la découverte de la dopathérapie, le traitement neurochirurgical de la maladie de Parkinson se limitait à de la chirurgie lésionnelle, jusqu’aux années 1970/1980. Puis vers les années 1990, face aux limites du traitement dopaminergique et grâce aux progrès de la connaissance et des techniques, la stimulation cérébrale profonde (SCP) a pu être envisagée.
Au niveau des ganglions de la base, le déficit en dopamine de la voie négrostriée entraîne une hyperactivité du pallidum et du noyau subthalamique. Le courant électrique de la stimulation à haute fréquence inhibe la suractivité de ces zones et permet d’améliorer les symptômes moteurs parkinsoniens. La 1ère SCP a été pratiquée en 1993 à Lyon.
La stimulation cérébrale profonde se fait sur 3 cibles précises :
- le thalamus : la stimulation du noyau central intermédiaire du thalamus (VIM) permet de contrôler le tremblement de repos et s’adresse à des patients présentant un tremblement invalidant résistant au traitement à la lévodopa,
- le pallidum : la stimulation du globus pallidum interne (GPI) a une action efficace sur les dyskinésies. Elle est indiquée chez les patients présentant une contre-indication au NST. Elle est réalisable jusqu’à l’âge de 75 ans, sous réserve d’un bon état général. Elle ne permet pas de réduire le traitement.
- le noyau subthalamique (NST) : la stimulation bilatérale du NST est la stimulation de référence, elle est la plus pratiquée. Elle permet d’améliorer l’ensemble des symptômes moteurs de la triade parkinsonienne, elle est efficace dans 8 cas sur 10. Elle n’est pas efficace sur les troubles non dopaminergiques (freezing, dysarthrie…). Le rapport bénéfice/risque doit être bien évalué. Moins de 10% des malades peut prétendre à la SCP du NST. Le patient doit répondre à des critères stricts : présenter un parkinson idiopathique sans aucun autre argument en faveur d’un autre syndrome parkinsonien, sujet jeune de préférence, en tous les cas inférieur à 65/70 ans, avoir au moins 5 ans d’évolution de la maladie, présenter des dyskinésies et des fluctuations motrices, avoir une bonne réponse à la dopathérapie, n’avoir aucun trouble cognitif, pas de signes axiaux en condition ON, pas de troubles psychiatriques, pas de maladie générale grave.
La chirurgie n’est pas une solution miracle et ne fera pas du patient un homme nouveau. L’amélioration apportée se limite au mieux atteint avec le traitement à la lévodopa.
L’opération se déroule en plusieurs étapes : un repérage par IRM 3 ou 4 mois avant, l’implantation des électrodes (1,27 mm de diamètre). L’intervention dure en moyenne 5h sous anesthésie locale. Le malade ne doit pas bouger mais participe activement. La pose du stimulateur en région sous claviculaire sous anesthésie générale (SOLETRA – KINETRA). La durée des piles varie entre 6 et 10 ans.
Les étapes du suivi : opérabilité, bilan d’inclusion, chirurgie, contrôle à 3, 6 et 12 mois
Parmi les effets secondaires, on note : complications motrices, instabilité posturale, difficulté d’initiation au pas, freezing, festination, chute, dysarthrie (trouble de l’articulation), accès de confusion, perte de motivation, syndrome dépressif, aggravation des capacités de concentration.
Par Tiphaine ROUAUD, neurologue à l’hôpital de NANTES
Intervention à la Maison des Aidants à Nantes en janvier 2012.
Présentation de la maladie de Parkinson (première partie)
Publié le 18 octobre 2012 à 08:41Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
PRESENTATION DE LA MALADIE DE PARKINSON
Par Tiphaine ROUAUD, neurologue à l’hôpital de NANTES
Intervention à la Maison des Aidants à Nantes en janvier 2012.
I – COMPRENDRE LA MALADIE
Définition : la maladie de Parkinson est une affection neurodégénérative qui se caractérise par des troubles moteurs (tremblement, akinésie et hypertonie) et des troubles non moteurs (troubles de l’odorat, troubles gastro-intestinaux, dysautonomie). Les troubles moteurs sont la conséquence d’un déficit de dopamine dans le striatum. Ce déficit en dopamine résulte de la dégénérescence progressive des neurones dopaminergiques de la substance noire.
Fréquence : 2ème maladie neurodégénérative après Alzheimer, on compte plus de 150000 parkinsoniens en France. Elle concerne plus de 2% des hommes de plus de 65 ans et un peu moins pour les femmes.
Origine : l’origine est mal connue. Il existe des formes génétiques (5 à 10%), une dizaine de gènes ont été identifiés. On a aussi évoqué l’implication de substances neurotoxiques : les pesticides sont les seuls facteurs de risque reconnus. Dans la plupart des cas, il y aurait une combinaison d’une susceptibilité individuelle (facteurs génétiques) et de facteurs environnementaux.
Rôle de l’alpha-synucléine : Dans la maladie de Parkinson, on constate une accumulation anormale d’une protéine, l’alpha-synucléine. Cette protéine naturellement présente dans le cerveau ne serait plus éliminée et se concentre sous la forme d’agrégats dont la toxicité entraînerait la mort neuronale. Or, ces agrégats se retrouvent précocement au niveau du bulbe olfactif et dans le système nerveux entérique, avant même l’atteinte de la substance noire. Les atteintes du bulbe olfactif et du système nerveux entérique expliqueraient en partie le manque d’odorat et les troubles gastro-intestinaux (dont la constipation), très fréquents et précoces dans la maladie. D’où l’hypothèse d’une implication d’un toxique environnemental, inhalé ou ingéré, qui traverse la muqueuse nasale ou la barrière épithéliale intestinale.
L’effet protecteur du tabac est très discuté : le tabagisme serait protecteur chez les sujets jeunes mais ne le serait plus chez les sujets âgés.
Déclaration : avec un âge moyen de début entre 57 et 62 ans, rare avant 40 ans (moins de 10% ces cas), la maladie débute rarement après 80 ans (moins de 10% des cas). 80% des cas débutent entre 40 et 75 ans.
Comment apparaît la maladie ? Dans la maladie de Parkinson, l’atteinte n’est pas limitée à la substance noire. Elle affecte d’autres structures ce qui explique les aspects non moteurs. La maladie débute par :
- le bulbe olfactif : perte de l’odorat,
- le noyau dorsal du vague : troubles gastro-intestinaux (dyspepsie, ralentissement de la vidange gastrique, constipation), troubles cardio-vasculaires (hypotension orthostatique), troubles vésico-sphinctériens (mictions fréquentes, urgences mictionnelles)
- le complexe coeruleus/subcoeruleus : perturbation du sommeil (rêves nocturnes agités).
Elle atteint la substance noire dans un second temps, puis les structures qui régissent l’équilibre, la qualité de la parole, la déglutition, les capacités attentionnelles, le raisonnement et les émotions. Ces symptômes ne sont pas dopa sensibles, d’où l’importance de la kinésithérapie et de l’orthophonie.
Le début de la maladie est progressif. Lorsque l’on pose un diagnostic, la maladie est installée depuis au moins 6 ans et environ 70% des neurones dopaminergiques de la substance noire sont détruits. Le diagnostic est clinique et ne justifie aucun examen complémentaire. Les 3 signes majeurs sont :
- le tremblement, présent dans 70% des cas, est un tremblement de repos, il apparaît lorsqu’il y a relâchement musculaire et disparaît lors de l’exécution d’un mouvement volontaire. Il peut être unilatéral ou très asymétrique. Il concerne la main, le poignet ou un membre supérieur ou inférieur. Le tremblement à tendance à s’aggraver en cas de stress,
- l’akinésie, difficulté à initier ou à exécuter un mouvement,
- l’hypertonie extrapyramidale ou rigidité.
L’akinésie et la rigidité se traduisent par une gêne à exécuter des mouvements volontaires accompagnées d’un ralentissement et d’une réduction de l’amplitude des mouvements. On relève une perturbation dans l’exécution des mouvements automatiques : perte de la gestuelle, de la mimique (visage inexpressif), perte du balancement d’un bras à la marche. Parfois la micrographie apparaît précocement avec une écriture de plus en plus petite où les lettres tentent de se télescoper. La perte des automatismes oblige le patient à penser chacun de ses gestes et rend difficile l’exécution de deux actes simultanément.
Les signes non moteurs :
- perte de l’odorat,
- troubles du sommeil,
- douleurs : pseudo sciatique, douleurs au niveau des cervicales ou des épaules, crampes dans les mollets la nuit, orteils en griffe le matin,
- troubles végétatifs : digestion (inconfort gastrique, remontées acides, constipation), urinaires (mictions nocturnes, urgences), génitaux (problème de l’érection), vasculaires (chute de tension), sudation (sensation chaud/froid, transpiration excessive).
Comment évolue la maladie ? On distingue 3 phases :
- phase de bon contrôle, dite « lune de miel » qui peut durer 6 – 7 ans ou plus. Période pendant laquelle on constate une bonne efficacité du traitement et permet au patient de mener une vie pratiquement normale,
- phase des fluctuations motrices et dyskinésies. Au cours de la 2ème période, les complications motrices liées aux traitements apparaissent avec durant la journée des moments de bonne mobilité (on) et des moments de mobilité réduite (off) et également des dyskinésies, mouvements involontaires souvent plus gênants pour l’entourage que pour le malade lui-même. On explique ces fluctuations par la réduction de la capacité de stockage de la dopamine (la perte des neurones dopaminergiques) et aussi par une saturation au niveau des synapses des récepteurs dopaminergiques.
- phase d’aggravation des signes axiaux et des capacités d’organisation de la pensée. Progressivement, les signes tardifs accentuent le handicap : troubles de la marche (freezing, festination), troubles de la posture (dos voûté), troubles de la parole et de la déglutition. C’est à ce stade que les troubles cognitifs et psychiques sont susceptibles de se majorer.
- Au dernier stade, la marche est devenue impossible, le patient a perdu toute autonomie et il doit être aidé pour les gestes de la vie quotidienne. Les déformations articulaires et les douleurs augmentent le handicap.
Chaque patient est différent et développe son propre parkinson. Le niveau de handicap varie d’un patient à l’autre ainsi que la vitesse de progression. Il existe des formes d’évolution lente et des formes d’évolution rapide.
Informations régionales : le Finistère (gp29)
Publié le 15 octobre 2012 à 11:08Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
Rentrée studieuse et sportive dans le Finistère
Il a été décidé la création d’une nouvelle activité : « la marche nordique ». Annick Jaouen responsable du point-rencontre de Morlaix a testé cette technique de marche avec un groupe de marcheurs très motivé. Plus dynamique que la randonnée, la marche nordique a pour principe d’accentuer le mouvement de balancier naturel des bras à l’aide de deux bâtons. Le corps est ainsi propulsé vers l’avant. On va plus vite, plus loin avec moins de fatigue. Le plaisir de la pratique arrive dès les premières foulées car la technique est simple. Grâce aux bâtons, tous les muscles du corps sont sollicités. Le premier rendez-vous est fixé le 3 septembre 2012, cette activité est encadrée par un éducateur sportif qui adaptera les séances pour les Parkinsoniens, aidants et autres participants. Elle aura lieu dans un premier temps autour de Morlaix (ancienne voie de chemin de fer Morlaix / Carhaix aménagée en voie piétonne).
Les séances de gymnastique collective encadrées par un kinésithérapeute dans notre département remportent un succès. Nous étudions la possibilité de constituer un autre groupe de gymnastique sur Plouguerneau en partenariat avec le CLIC de Lesneven / les abers.
Notre Conférence automnale aura lieu le 20 octobre 2012 au Juvénat à Châteaulin et sera animée par Mme Véronique Rolland Orthophoniste à Rosporden certifiée dans la méthode LSVT et Mr Fabrice Bruel Kinésithérapeute à Lesneven.
Nous espérons que notre Projet « lundis de la santé » à Brest sur Parkinson sera retenu (avril 2013). Une réunion du « pôle Santé » se tiendra à la mairie de Brest courant novembre 2012.
Repas du 16 Juin 2012 à Châteauneuf du Faou : C’est toujours avec autant de plaisir que nous nous sommes retrouvés, avant la trêve d’été, autour d’une bonne table à Châteauneuf du Faou. Une nouvelle fois, Michel Margerte et son équipe nous ont merveilleusement préparé cette journée avec, cerise sur le gâteau : un orchestre d’orgue de Barbarie « sur un air d’autrefois » qui nous a accompagnés tout l’après-midi. Petit à petit, les uns chantaient, les autres dansaient sur des rythmes bien connus, tous avaient le sourire ! Comme cela fait du bien de fredonner des airs de sa jeunesse ! Bref, c’était la fête… on aurait aimé qu’elle dure longtemps ! Merci à tous pour cette belle journée. La promesse sera tenue… Nous nous retrouverons l’année prochaine…
Dominique BONNE, Président du GP29
Le parkinsonien indépendant n° 50 : éditorial
Publié le 15 octobre 2012 à 10:34Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre2012
Une revue consacrée à un rappel des éléments constitutifs de la maladie :
En effet, il nous est apparu judicieux de « redire la maladie et ses incidences » car un certain nombre des lecteurs sont de nouveaux « intéressés », récemment diagnostiqués et qui n’ont pas eu l’occasion de lire nos précédentes publications. Et puis, ça ne fait pas de mal de refaire de temps en temps le point sur les descriptions de la maladie avec de nouvelles voix qui ont le mérite de faire le point sur les dernières nouveautés.
Ainsi Thiphaine Rouaud, neurologue au CHU de Nantes, nous présente son regard sur la maladie et les dispositifs pour la combattre. Elodie Mathieu, jeune chercheuse de l’INSERM U1064 financée par CECAP Recherche, évoque le problème de la greffe intracérébrale et de son rejet par l’organisme objet de sa recherche.
Jean Pierre Lagadec et Renée Dufant évoquent un symptôme insuffisamment évoqué : le syndrome des jambes sans repos. Puis deux articles s’intéressent à des phénomènes psychologiques : Marie Bronnec, psychologue au CHU de Nantes, nous parle du lien entre le traitement de la maladie et le jeu pathologique et Guy Seguin nous communique un article sur un phénomène quasi inconnu le Punding proche des T.O.C. (Troubles Obsessionnels Compulsifs). Enfin, je vous évoque le phénomène de constipation et un moyen de la combattre.
Ce n’est pas très « emballant » comme programme, je vous le concède. Mais il semblait important de faire le point sans promesse de découvertes sensationnelles – il n’y en a pas à ce jour ! – ou la mise sur le marché de nouvelles molécules. Pourtant nous reproduisons deux articles qui ouvrent des perspectives en matière de soin (la stimulation mécanique plantaire) et de prévention test d’un vaccin thérapeutique), proposés par Jean Claude Moraines.
Recherche adhérent motivé pour renforcer notre équipe !
L’âge fait ressortir les méfaits de la maladie auprès de nos membres atteints par Parkinson et ils demandent à être déchargés d’une responsabilité trop lourde : Jean Maigné, Henri Minaret et Jackie Auger souhaitent prendre une « retraite » bien méritée… Nous leur devons beaucoup – depuis plus de dix ans pour certains – en tant que soutien et accompagnement de notre épopée ! Qu’ils en soient ici remerciés avec chaleur.
Nos statuts nous permettent de continuer notre route. Mais il est indispensable de penser la « relève » : un ou deux jeunes, diagnostiqués récemment, seraient les bienvenus. Cela donnerait du sang neuf à notre revue. Mais il faudra être coopté par les autres adhérents : c’est la spécificité de notre association. Qui seront les prochains équipiers de l’AGP ? Nous en parlerons à la prochaine Assemblée Générale qui se déroule le 2 octobre prochain.
[vu sur le net] Parkinson. Le labo connaissait-il les effets secondaires du médicament ?
Publié le 12 octobre 2012 à 08:05Article trouvé sur le site du Télégramme
Souffrant d’effets secondaires dont il attribue la cause à son traitement médical, un Nantais a obtenu, voici un an et demi, la condamnation du laboratoire. La cour d’appel de Rennes, saisie par le labo, évoquait cette affaire, hier. Le tribunal de Nantes jugeait que le laboratoire avait commis une faute en omettant de faire figurer, sur la notice du Requip, le risque d’effets secondaires qu’a connus Didier Jambart. Ce dernier avait obtenu 117.000€ de dommages et intérêts pour l’indemniser des pertes au jeu qu’il avait subies et des désagréments causés par son comportement sexuel inadapté.
Pour lire l’article dans son intégralité, suivez ce lien…
L’orthophonie — la kinésithérapie : Conférence du GP 29 le 20 octobre 2012
Publié le 10 octobre 2012 à 19:41L’orthophonie — la kinésithérapie. Pour connaitre tous les détails, cliquez sur l’affiche de la conférence du 20 octobre 2012
[vu sur le net] Addictions. Le Requip devant la cour d’appel de Rennes
Publié le 09 octobre 2012 à 07:48Article trouvé sur le site du Télégramme
Le laboratoire GSK comparaît mardi devant le cour d’appel de Rennes pour les effets secondaires de son médicament le Requip, destiné à soigner la maladie de Parkinson. En première instance, le laboratoire avait été condamné à verser des dommages et intérêts à Didier Jambart, dont le traitement avait résulté en une addiction au jeu et au sexe.
Pour lire cet article dans son intégralité, suivez ce lien…
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.