Présentation de la maladie de Parkinson (seconde partie)
Publié le 21 octobre 2012 à 17:31Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
LES TRAITEMENTS DANS LA MALADIE DE PARKINSON
Actuellement on ne guérit pas la maladie de Parkinson, le traitement va chercher à compenser le déficit en dopamine :
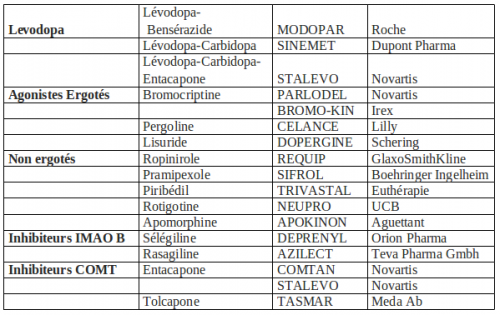
- par voie orale : en apportant de la dopamine (Lévodopa) ou en stimulant directement les récepteurs dopaminergiques (agonistes) ou en réduisant la dégradation naturelle de la dopamine (IMAO B et ICOMT),
- par injection sous-cutanée (pompe à Apokinon©)
- par sonde gastrique (sonde à Duodopa),
- par intervention chirurgicale (stimulation cérébrale profonde).
La dopamine : La dopamine ne passe pas la barrière hématoencéphalique, la lévodopa, précurseur de la dopamine, est absorbée dans le duodénum et est ensuite décarboxylée en dopamine. La L‑dopa représente le traitement de référence et elle sera prescrite en première intention chez les patients de plus de 70 ans. Elle est le médicament le mieux toléré et dont l’effet moteur est le meilleur. En début de traitement, pour éviter les problèmes de nausées et chute de pression artérielle au lever, on prescrit du MOTILIUM©.
Les doses de L‑dopa seront progressives :
- une dose minimale de 300 mg/j pour pouvoir mesurer un effet,
- une posologie aux alentours de 500 mg/j est considérée comme moyenne,
- au-delà de 1000 mg/j, il s’agit d’une forte posologie.
Il est important de respecter les horaires de prescription (plus ou moins une ½ heure), jamais d’arrêt brutal (particulièrement en cas de chirurgie), prendre les doses de préférence une ½ heure avant les repas ou 1½ à 2 heures après les repas pour une meilleure efficacité.
Les effets secondaires : la L‑dopa :
- stimule les récepteurs dopaminergiques sur les artères (hypotension orthostatique),
- stimule les récepteurs du centre du vomissement situés à la base du cerveau (nausées, vomissements),
- stimule les voies de la motivation et du plaisir : risque de 15% chez les patients jeunes de troubles du contrôle des impulsions ou d’addictions au traitement ; risque de confusion et d’hallucinations chez le sujet âgé.
Les agonistes dopaminergiques : Les agonistes « miment » l’effet de la dopamine en stimulant directement les récepteurs dopaminergiques. Avantages : leur durée d’action est plus longue que la L‑dopa et permet de diminuer le nombre de prises. Inconvénients : on note une moindre efficacité sur les symptômes moteurs et des risques accrus : troubles de contrôle des impulsions chez le patient jeune, confusions, cauchemars, hallucinations chez le patient âgé. Parmi les agonistes on distingue :
- les dérivés de l’ergot de seigle qui présentent tous des risques sur le plan pulmonaire, rénal et cardiaque. On évite donc de les utiliser,
- les agonistes non ergotés. Il s’agit d’une famille hétérogène mais qui partage l’avantage sur les ergotés de ne pas induire de fibrose.
Les agonistes partagent les mêmes effets indésirables que la lévodopa mais avec une plus grande sévérité probablement du fait de la stimulation directe des récepteurs dopaminergiques. Comme pour la lévodopa, le sevrage doit être progressif. Quelque soit l’agoniste choisi : ne pas prescrire chez le sujet âgé ou en cas de troubles cognitifs, posologie progressive, hormis le cas particulier de l’apomorphine, ne pas associer d’agonistes dopaminergiques entre eux du fait du risque de potentialisation des effets indésirables, en particulier en cas de confusion hallucinatoire. Pour les agonistes non ergotés, on trouve : le ropinirole©, le pramipexole©, le piribédil©, la rotigotine© et l’apomorphine©.
L’apomorphine est un puissant agoniste d’efficacité comparable à la lévodopa. Elle est utilisée en administration sous-cutanée soit sous forme de stylo injecteur, soit sous forme d’ampoule pour utilisation de perfusion sous-cutanée en continu à l’aide d’une pompe. L’absorption sous-cutanée est rapide, l’efficacité motrice apparaissant dès les 10 à 15 minutes. Sa durée d’action est courte, de l’ordre 30 minutes à une heure, mais en terme d’efficacité, 10 mg d’apomorphine serait l’équivalent de 100 mg de lévodopa. Les troubles psychiques sont moindres qu’avec les autres agonistes.
Les inhibiteurs de la MAO B : La Sélégiline® (DEPRENYL©) et la Rasagiline® (AZILECT©) sont des inhibiteurs sélectifs de la MAO B (monoamine oxydase B) et donc réduisent la dégradation de la dopamine au niveau du cerveau et renforcent ainsi l’efficacité de la L‑dopa (10%). Les effets secondaires sont identiques à la lévodopa. On note un effet potentiellement « ralentisseur » pour la Rasagiline. Indications : soit en monothérapie (sans la lévodopa) pour un parkinson peu évolué, soit en association avec la lévodopa chez les patients présentant des fluctuations motrices de fin de dose.
Les inhibiteurs de la COMT : La COMT (cathécol-O-méthyltransférase) est une enzyme présente dans la paroi intestinale, elle diminue la biodisponibilité de la dopamine. En administrant un ICOMT avec la lévodopa, on augmente à la fois la biodisponibilité de la lévodopa et sa demi-vie.
L’entacapone® (COMTAN© ou STALEVO©) en association avec la lévodopa : augmente de plus de 10% l’efficacité motrice, colore les urines en jaune orangé ; effets indésirables : nausées, diarrhées, douleurs intestinales.
La tolcapone® (TASMAR©) : efficacité de 30%, soupçonné d’hépatotoxicité, nécessite un bilan hépatique ; effets indésirables identiques à tout traitement à la lévodopa.
L’amantadine® (MANTADIX©) : L’amantadine était utilisée comme antiviral. Son efficacité antiparkinsonienne a été découverte par hasard, elle est plus faible que celle de la lévodopa. Il a été montré un effet antidyskinétique intéressant. Sa demi-vie est longue ; pas de prise après 17H du fait du risque d’insomnie. Ses effets indésirables : hypotension orthostatique et nausées. Elle peut provoquer des hallucinations et des confusions.
La clozapine® (LEPONEX©) : La clozapine est le seul neuroleptique compatible avec un traitement antiparkinsonien. Elle est indiquée lors des psychoses dopa-induites dans la maladie de Parkinson. On a observé des effets antidyskinétiques. Elle est utilisée en cas de troubles hallucinatoires.
Pour tous les autres symptômes :
- constipation : laxatifs
- chute de tension : en priorité, utiliser des bas de contention puis Motilium, Gutron, Fludrocortisone
- Mouvements brusques ou agitation nocturne : RIVOTRIL en gouttes
- salivation excessive : injection botulique
- difficultés de mémoire, manque de motivation : EXELON
- anxiété, dépression : SEROPLEX, EFFEXOR
- sensation de déprime ou hallucinations : LEPONEX
- Freezing, instabilité ou chute : Kinésithérapie
- Voix chuchotée, difficile à comprendre : orthophonie
La pompe à apomorphine : La pompe délivre en permanence en sous-cutané de l’apomorphine, avec la possibilité d’ajouter une quantité supplémentaire (bolus) en cas de blocage. Elle s’adresse au patient fluctuant (phases ON/OFF) ou en cas de phases de dyskinésie prolongées. Elle permet : de réduire le traitement oral, d’améliorer la qualité de vie du patient et de renforcer son autonomie, de diminuer les fluctuations motrices, de diminuer progressivement les dyskinésies.
Le bénéfice thérapeutique est très net, l’impression clinique globale d’amélioration se situe entre 50 et 70%, tant d’après le patient que d’après son entourage. En dehors d’une détérioration cognitive sévère et de symptômes psychotiques, il n’y a pas de contre-indications, en particulier l’âge n’est pas une limitation. La pompe à apomorphine représente une alternative en cas de contre-indication à la stimulation cérébrale profonde.
La première mise en place nécessite un séjour hospitalier (environ 10 jours). Ensuite, au domicile, une infirmière ou une personne de l’entourage intervient pour la mise en place quotidienne de la pompe. Il faut compter près de 6 mois pour arriver au bon débit (environ 3 mg par heure). Elle est posée le matin au réveil et retirée le soir au coucher. Il faut éviter de la poser 24h/24h, sauf en cas d’akinésie douloureuse nocturne sévère, en raison du risque d’échappement thérapeutique au fur et à mesure du temps (perte de l’effet du traitement au fur et à mesure du temps lorsque la pompe est posée 24h/24). Il faut changer régulièrement de site d’injection pour éviter les nodules. Du fait de son coût, la pompe à apomorphine est mal acceptée dans les EHPAD (Etablissement hospitalier pour personnes âgées dépendantes).
La sonde à Duodopa : La sonde permet une administration intestinale en continu de lévodopa en suspension dans un gel. Elle assure un débit continu 24/24 H avec la possibilité de bolus si besoin. Cette technique est réservée au patient à un stade avancé, répondant bien à la dopathérapie : lorsqu’il n’y a pas de résultats avec les antiparkinsoniens oraux, lorsque la pompe à apomorphine est mal tolérée ou insuffisamment efficace, lorsque le patient est exclu de la stimulation cérébrale profonde.
Après des tests à l’aide d’une sonde nasoduodénale pour mesurer l’efficacité de la Duodopa, une sonde à demeure est mise en place lors d’une gastrotomie endoscopique percutanée. La Duodopa en continu permet de réduire les périodes OFF aussi bien que les dyskinésies. Les contre-indications sont les mêmes que celles de la lévodopa. L’utilisation de cette technique est limitée par son coût.
La stimulation cérébrale profonde : Avant la découverte de la dopathérapie, le traitement neurochirurgical de la maladie de Parkinson se limitait à de la chirurgie lésionnelle, jusqu’aux années 1970/1980. Puis vers les années 1990, face aux limites du traitement dopaminergique et grâce aux progrès de la connaissance et des techniques, la stimulation cérébrale profonde (SCP) a pu être envisagée.
Au niveau des ganglions de la base, le déficit en dopamine de la voie négrostriée entraîne une hyperactivité du pallidum et du noyau subthalamique. Le courant électrique de la stimulation à haute fréquence inhibe la suractivité de ces zones et permet d’améliorer les symptômes moteurs parkinsoniens. La 1ère SCP a été pratiquée en 1993 à Lyon.
La stimulation cérébrale profonde se fait sur 3 cibles précises :
- le thalamus : la stimulation du noyau central intermédiaire du thalamus (VIM) permet de contrôler le tremblement de repos et s’adresse à des patients présentant un tremblement invalidant résistant au traitement à la lévodopa,
- le pallidum : la stimulation du globus pallidum interne (GPI) a une action efficace sur les dyskinésies. Elle est indiquée chez les patients présentant une contre-indication au NST. Elle est réalisable jusqu’à l’âge de 75 ans, sous réserve d’un bon état général. Elle ne permet pas de réduire le traitement.
- le noyau subthalamique (NST) : la stimulation bilatérale du NST est la stimulation de référence, elle est la plus pratiquée. Elle permet d’améliorer l’ensemble des symptômes moteurs de la triade parkinsonienne, elle est efficace dans 8 cas sur 10. Elle n’est pas efficace sur les troubles non dopaminergiques (freezing, dysarthrie…). Le rapport bénéfice/risque doit être bien évalué. Moins de 10% des malades peut prétendre à la SCP du NST. Le patient doit répondre à des critères stricts : présenter un parkinson idiopathique sans aucun autre argument en faveur d’un autre syndrome parkinsonien, sujet jeune de préférence, en tous les cas inférieur à 65/70 ans, avoir au moins 5 ans d’évolution de la maladie, présenter des dyskinésies et des fluctuations motrices, avoir une bonne réponse à la dopathérapie, n’avoir aucun trouble cognitif, pas de signes axiaux en condition ON, pas de troubles psychiatriques, pas de maladie générale grave.
La chirurgie n’est pas une solution miracle et ne fera pas du patient un homme nouveau. L’amélioration apportée se limite au mieux atteint avec le traitement à la lévodopa.
L’opération se déroule en plusieurs étapes : un repérage par IRM 3 ou 4 mois avant, l’implantation des électrodes (1,27 mm de diamètre). L’intervention dure en moyenne 5h sous anesthésie locale. Le malade ne doit pas bouger mais participe activement. La pose du stimulateur en région sous claviculaire sous anesthésie générale (SOLETRA – KINETRA). La durée des piles varie entre 6 et 10 ans.
Les étapes du suivi : opérabilité, bilan d’inclusion, chirurgie, contrôle à 3, 6 et 12 mois
Parmi les effets secondaires, on note : complications motrices, instabilité posturale, difficulté d’initiation au pas, freezing, festination, chute, dysarthrie (trouble de l’articulation), accès de confusion, perte de motivation, syndrome dépressif, aggravation des capacités de concentration.
Par Tiphaine ROUAUD, neurologue à l’hôpital de NANTES
Intervention à la Maison des Aidants à Nantes en janvier 2012.
1 Commentaire Cliquer ici pour laisser un commentaire
Laisser un commentaire
Flux RSS des commentaires de cet article. Rétrolien URI
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.
bonjour je viens de recevoir duodopa pas de changement pourquoi attendre aussi lontemps pour avoir la simulation cérébrale
Commentaire by laffon — 4 décembre 2017 #