Le rôle du podologue
Publié le 07 avril 2014 à 10:51Article paru dans LE PARKINSONIEN INDÉPENDANT n°56
Malmenés, négligés, quand nos pieds se rappellent douloureusement à nous, c’est qu’il est temps d’en prendre soin. Lorsqu’ils nous font souffrir, nous empêchent de marcher, danser, garder notre équilibre, monter les escaliers, l’évidence s’impose : nos pieds sont précieux ! Pourtant 67% des Français s’en plaignent. Il faut dire qu’ils sont mis à rude épreuve, entre des chaussures mal adaptées, des soins approximatifs, parfois quelques kilos en trop ou une mauvaise circulation sanguine qui les fait gonfler, sans parler de l’amincissement du capiton plantaire, au fil des ans, qui les rend plus sensibles. Au-delà des pieds eux-mêmes, ces troubles peuvent se manifester à différents niveaux – jambes, genou, cuisse, mais aussi hanche, bassin ou épaule‑, et sérieusement perturber la vie quotidienne. La solution pour y remédier ? S’en occuper, en les observant régulièrement, en les chaussant avec soin, et en les entretenant avec minutie !
Les observer avec attention :
C’est le premier bon réflexe : regarder chaque semaine nos pieds, dessus et dessous, afin de repérer les craquelures, gerçures, ampoules, callosités, verrues.… à soigner sans tarder. Observer aussi les ongles : s’ils épaississent, se colorent ou deviennent douloureux, il faudra consulter un podologue. Prendre garde également à la transpiration excessive, qui favorise la prolifération des bactéries et des champignons responsables de mauvaises odeurs et de mycoses. Si une hygiène rigoureuse ne suffit pas, des déodorants ou de la poudre absorbante spéciale pieds aide à normaliser le phénomène. Plus les pieds sont sensibles, plus il est important d’accorder une attention particulière au choix d’une bonne chaussure : il suffit parfois d’en changer pour voir disparaître ses douleurs. A l’achat, une chaussure se teste, bien sûr au pied, mais aussi à la main.
« Commencez par appuyer sur la coque du talon : elle s’écrase facilement ? Le contrefort arrière n’est pas assez rigide, la chaussure n’assurera pas un maintien suffisant du pied et de la cheville », indique Pierre Couvet, podologue. « Ensuite, pliez la chaussure en deux : si l’avant et l’arrière se rejoignent facilement, elle est trop souple, elle ne tiendra pas bien le pied. Enfin, le fait de pouvoir la tordre comme un linge à essorer, indique qu’elle n’est pas suffisamment stable. »
Le modèle idéal comporte un petit talon assez large, ne serre pas trop le pied pour éviter les frottements, est léger, et doté d’une semelle épaisse en gomme pour un bon amorti. En cas de pied plat, l’ajout d’une semelle orthopédique pour soutenir la voûte plantaire améliore le confort. La peau respire mieux avec des chaussures en toile ou en cuir et avec des chaussettes 100% coton. Il existe des chaussettes conçues pour favoriser l’évacuation de la transpiration, enfin marcher pieds nus aide à détendre le pied.
Les toiletter tous les jours :
Pour garder « bon pied », il est important d’en prendre soin chaque jour. « Lavez-les dans une eau tiède à 36° environ, avec un savon surgras, sans les laisser tremper plus de cinq à dix minutes pour éviter que la peau ramollisse, ce qui pourrait entraîner des plaies ». Les pieds doivent être bien rincés et minutieusement séchés avec une serviette propre, sans oublier les espaces entre les orteils. Ensuite, c’est le moment idéal de s’occuper des ongles : assouplis par l’eau, ils sont plus faciles à couper au carré. « Une pince à ongles tient mieux en main qu’un coupe-ongles ou qu’un petit ciseau. Arrondissez ensuite les bords afin d’éviter l’ongle incarné. Enfin appliquez une crème pieds secs qui hydrate l’épiderme et prévient des crevasses. »
Il est recommandé de consulter le podologue en prévention, une fois par an.
Article relevé dans « Notre Temps » par Soize Vignon
Syndrome des jambes sans repos (SJSR)
Publié le 03 avril 2014 à 16:03Article paru dans LE PARKINSONIEN INDÉPENDANT n°56
Petit rappel d’un article de Jean-Pierre Lagadec, paru dans le numéro 50 du Parkinsonien Indépendant et complément sur les recherches en cours.
Intervention du Dr Imad GHORAYEB (Bordeaux) le 6/04/2013 :
Le syndrome des jambes sans repos (maladie de Willis Ekbom) est une affection sensori-motrice qui se caractérise par des dysesthésies extrêmement désagréables, touchant préférentiellement les membres inférieurs et s’accompagnant d’un besoin irrépressible de bouger. Les symptômes nettement plus sévères en fin de journée, sont aggravés par l’immobilité prolongée et sont partiellement soulagés par le mouvement. Le SJSR apparaît ainsi comme l’une des plus fréquentes pathologies neurologiques, il n’en reste pas moins une des plus sous diagnostiquées et mal prises en charge.
La physiopathologie du SJSR reste mal connue.
Deux hypothèses, celle d’un dysfonctionnement du système dopaminergique et celle d’un trouble du métabolisme du fer, semblent cependant se complémenter pour rendre compte des mécanismes du SJSR. Dans l’état actuel des connaissances, aucune de ces hypothèses n’a pu être vérifiée de manière consensuelle et ne peut clairement expliquer les manifestations cliniques de ce syndrome.
L’efficacité du traitement dopaminergique, l’aggravation par les neuroleptiques et la fréquence élevée de survenue du SJSR dans la maladie de Parkinson sont à l’origine de l’hypothèse selon laquelle la physiopathologie du SJSR serait liée à un possible « déficit dopaminergique ». Actuellement, aucune donnée scientifique ne permet de confirmer cette hypothèse. Les études par imagerie cérébrale n’ont pas réussi à démontrer des modifications cohérentes en faveur d’un déficit dopaminergique, aucune perte de neurones dopaminergiques n’a été retrouvée dans les études anatomopathologiques et la recherche de marqueurs biologiques du métabolisme dopaminergique dans le liquide céphalo-rachidien a, de manière inattendue, montré une augmentation de la 3‑O-méthyldopa et de l’acide homovanillique en faveur plutôt d’une augmentation de l’activité dopaminergique.
L’hypothèse du fer est beaucoup plus convaincante dans le SJSR. Contrairement à « l’hypothèse dopaminergique », l’ensemble des études, qu’elles soient basées sur la recherche de paramètres biologiques, sur les données de l’imagerie cérébrale ou encore sur les résultats anatomopathologiques, confirment le lien entre carence en fer et SJSR.
Chez le petit animal carencé en fer, de fortes interactions ont été démontrées entre le métabolisme du fer et le système dopaminergique.
Les résultats préliminaires obtenus chez le primate non-humain (PNH) montrent une relation inverse entre la carence induite en fer et, d’une part, la production de dopamine in vivo et, d’autre part, l’augmentation de l’activité locomotrice globale de l’animal.
Basé sur des données de la littérature et sur les résultats de recherche fondamentale menée au sein de l’Institut des Maladies Neurodégénératives (Université Bordeaux 2 CNRS UMR 5293) une mise en place d’un projet est envisagée concernant la recherche clinique visant à confirmer, pour la première fois chez l’homme, les corrélations inverses entre métabolisme du fer et métabolisme dopaminergique à la fois sur le plan biologique et sur le plan de l’imagerie cérébrale. Les résultats devraient confirmer l’hypothèse d’une hyperactivation du système dopaminergique dans le SJSR dans un contexte de carence biologique en fer rendant compte ainsi du caractère circadien des symptômes du SJSR.
Les retombées de ce travail parfaitement translationnel sont évidentes tant du point de vue de la compréhension de la physiopathologie du SJSR que du point de vue de l’amélioration de la prise en charge thérapeutique des patients qui en sont affectés à travers des projets de recherche clinique futurs en rapport avec les résultats de ce projet.
Communication du Dr Christelle MONACA (Lille) le 12/04/2013 :
En ce qui concerne les traitements, il faut insister sur le fait qu’il est indispensable de traiter tout patient ayant une forme sévère à très sévère d’autant que certaines études récentes pourraient laisser supposer que le SJSR serait un facteur de risque cardio vasculaire et particulièrement hyper tension artérielle.
Le choix du traitement entre les trois agonistes dopaminergiques (Adartrel, Sifrol et Neupro) doit être fait (par le neurologue) en fonction de la durée des symptômes chez chaque patient car chaque molécule a une demie-vie (durée pendant laquelle elle agit) différente.
Il est important de ne pas dépasser les doses maximales autorisées du fait du risque de syndrome d’augmentation (apparition des symptômes dans d‘autres parties du corps et/ou plus tôt dans la journée).
Il faut noter également le fait qu’il ne faut pas traiter les cas de SJSR légers et modérés en particulier si ceux-ci ne surviennent que très ponctuellement.
Au niveau de la physiopathologie, des études génétiques ont permis de montrer l’implication de 4 loci (emplacement physique précis et invariable sur un chromosome).
Le fer et la dopamine gardent une place importante dans la physiopathologie du SJSR.
Une étude clinique en cours sur Strasbourg et Lille teste un produit naturel qui pourrait venir au moins en complément des traitements habituels pour permettre un meilleur soulagement. Ce produit, à base de fer pourrait ensuite, si les résultats de cette étude sont concluants, être testé à plus grande échelle avec un nombre de patients importants qui seraient alors suivis dans plusieurs centres (étude multicentrique).
Info transmises par Renée Dufant
La caféine nuit au développement du cerveau des souris
Publié le 02 avril 2014 à 09:37Article paru dans LE PARKINSONIEN INDÉPENDANT n°56
Une étude menée sur des souris indique que la prise de caféine pendant la gestation peut nuire au développement cérébral du fœtus. Or, s’il ne fait plus aucun doute que l’absorption – même mineure – d’alcool ou de tabac par la mère durant la grossesse ne va pas sans dégâts, la question reste en débat en ce qui concerne la caféine. Elle vaut autant pour le petit noir et le grand crème que pour tout produit contenant cette substance : thé, chocolat, boissons énergisantes et certains sodas.
Jusqu’ici, « la plupart des études sur le sujet ont été peu concluantes », déplore Pierre Gressens, chercheur de l’Institut national de la santé et de la recherche médicale (Inserm) à l’hôpital Robert-Debré de Paris et professeur de néonatalogie et de neurologie fœtale au King’s College de Londres. Pourtant, la caféine est une des substances « psychoactives » (c’est-à-dire capables de modifier l’activité des neurones, ces cellules excitables du cerveau) les plus consommées au monde, y compris chez la femme enceinte.
Mais une étude publiée le 7 août dans la revue Science Translational Medicine livre des résultats sans appel : la prise régulière de caféine par des souris gestantes (l’équivalent de deux à trois tasses de café par jour chez l’homme) affecte notablement le développement du cerveau de leur progéniture.
Deux effets délétères :
« Au cours du développement normal, les neurones naissent dans des régions cérébrales particulières, puis migrent vers les zones cérébrales où ces cellules sont destinées à fonctionner », explique Christophe Bernard, principal auteur de cette étude menée par l’Inserm à l’université d’Aix-Marseille. « Mais lorsque nous ajoutons de la caféine dans l’eau de boisson des souris femelles, tout au long de la gestation, cela retarde la migration d’une sous-population de neurones dans le cerveau des souriceaux. » La caféine ralentit de moitié la vitesse de migration de ces neurones.
Ce blocage a deux effets délétères, l’un à court terme et l’autre à long terme. Les souriceaux de moins d’une semaine sont plus sensibles aux crises d’épilepsie. Et une fois adultes, ces animaux présentent des troubles de la mémoire spatiale.
« C’est la première étude à démontrer les effets néfastes de la caféine durant la gestation sur le cerveau en développement, souligne M. Bernard. Cela justifie de futures études chez la femme enceinte. » Celles-ci seront délicates à conduire, car de nombreux biais peuvent fausser les résultats. D’autant qu’en février dernier, une étude scandinave menée chez près de 60 000 femmes enceintes montrait qu’une consommation de 125 mg de caféine par jour induisait un poids de naissance plus faible, cette réduction restant au demeurant plutôt faible.
Selon Christophe Bernard, on pourrait néanmoins progresser en interrogeant les familles, lorsqu’un enfant a fait une crise d’épilepsie, sur la consommation de caféine de sa mère durant la grossesse. Autre difficulté : « une même substance psychoactive peut avoir des effets opposés selon le stade du développement cérébral », souligne Pierre Gressens. En témoigne le fait que des dérivés de la caféine sont utilisés comme médicaments chez des nouveau-nés prématurés souffrant d’insuffisance respiratoire. Or ces produits semblent améliorer les troubles cognitifs de ces nourrissons.
Recommandations floues :
Les recommandations actuelles en la matière restent floues et variables selon les pays. En France, l’Institut national de prévention et d’éducation pour la santé préconise d’ « éviter de consommer trop de boissons contenant de la caféine (pas plus de trois tasses de café par jour) pendant la grossesse et la période d’allaitement ».
Faudra-t-il revoir ces recommandations ? Et peut-on tout interdire à la femme enceinte ? « Si les dangers de l’alcool durant la grossesse sont généralement bien compris, les fumeuses ont du mal à suivre les recommandations d’abstention totale vis-à-vis du tabac », note Marc Gamerre, chef du service de gynécologie-obstétrique à l’hôpital de la Conception à Marseille. Mais, pour Pierre Gressens, « cette étude vient étayer d’autres données qui poussent à limiter autant que possible la consommation de caféine lors d’une grossesse. Des consommations supérieures ou égales à 8 tasses par jour sont à déconseiller fortement aux femmes enceintes ».
Chez la souris, la caféine consommée par la femelle gestante retarde la migration de certains neurones dans le cerveau en construction du souriceau. Ces vidéos comparent, sur des cellules en culture, la migration de neurones en l’absence ou en présence de caféine. Christine Métin et Christophe Bernard, Inserm-Université Aix-Marseille.
Le Monde le 09.08.2013 à 11h56 Par Florence Rosier
Lu par Soizic Vignon
A souligner que, dans le numéro précédent de notre journal, nous indiquions les bénéfices de la caféine contre la maladie de Parkinson découverts par des neurologues canadiens… !
Jean Graveleau
Maladie de Parkinson, le coupable est démasqué : l’a‑synucléine
Publié le 01 avril 2014 à 11:46Article paru dans LE PARKINSONIEN INDÉPENDANT n°56
Injectée en petites quantités dans le cerveau d’animaux, la forme « malade » d’une protéine nommée a‑synucléine déclenche à elle seule la neurodégénérescence associée à la Maladie de Parkinson. C’est ce que viennent de démontrer des chercheurs de l’INSERM. Voilà une piste, une vraie, pour lutter contre la M.P. Des chercheurs de l’Institut des maladies neurodégénératives de Bordeaux, en collaboration avec des équipes espagnoles, viennent de montrer qu’une protéine présente sous la forme d’agrégats dans le cerveau des malades est capable, à elle seule, de déclencher et de propager la pathologie neurodégénérative chez l’animal.
Cette protéine, l’a-synucléine, est naturellement présente chez les sujets sains, mais pas sous sa forme agrégée. Elle était déjà soupçonnée de jouer un rôle important dans la maladie de Parkinson pour deux raisons :
- On la retrouve en grande quantité, sous la forme agrégée, dans des amas protéiques typiques de la pathologie (corps de Loewy)
- Dans les formes familiales de la maladie, le gène muté est celui codant pour cette protéine. Par ailleurs, plusieurs études ont montré que l’a-synucléine agrégée est toxique pour les neurones, aussi bien in vitro qu’in vivo.
De la protéine à la maladie
Dans le cadre de cette nouvelle étude, les chercheurs ont tout d’abord prélevé de l’a-synucléine dans le cerveau de patients décédés qui avaient donné leurs corps à la science. Les protéines obtenues ont été purifiées puis injectées dans le cerveau de souris et de macaque, au niveau du striatum (la région siège de la maladie de Parkinson).
Les résultats sont éloquents : après quatre mois chez les souris et neuf mois chez les singes, les chercheurs ont observé une dégénérescence des neurones dopaminergiques, typique de la maladie de Parkinson. Cette neurodégénérescence n’a fait que progresser au cours du suivi. Quatorze mois après l’injection, l’étude du cerveau des animaux a montré que leurs propres protéines a‑synucléine s’étaient agrégées entre elles et que ces agrégats s’étaient propagés dans les aires cérébrales distantes du striatum. « En injectant dans le cerveau de ces animaux de petites quantités de protéines humaines malades (de l’ordre du pictogramme), nous avons déclenché la Maladie de Parkinson. C’est la preuve que cette protéine est bien le responsable de la pathologie », estime Benjamin Dehay, co-auteur des travaux. « En outre, nous avons montré qu’elle agit selon un mécanisme de type prion, tel que celui impliqué dans la maladie de Creutzfeld Jacob : la protéine malade administrée induit un changement de conformation des protéines a‑synucléine de l’hôte et le phénomène se propage de neurones en neurones, entraînant des dysfonctionnements puis la dégénérescence des cellules », écrit-il.
Des cibles thérapeutiques
Reste à vérifier que ces résultats sont bien transposables à l’homme. Néanmoins, de nombreux espoirs thérapeutiques découlent de ces travaux. « Nous pouvons supposer qu’en bloquant l’agrégation de cette protéine, ou en augmentant sa dégradation, nous pourrons prévenir la maladie », estime le chercheur. « Néanmoins, il faudra intervenir très en amont, avant que les agrégats ne gagnent différentes aires cérébrales et ne soient trop diffus », explique B. Dehay.
Les chercheurs disposent déjà de quelques pistes pour identifier des cibles thérapeutiques permettant d’y parvenir : « Un anticorps anti-a-synucléine est actuellement à l’étude. Par ailleurs les données dont nous disposons nous permettent de supposer que l’agrégation de la protéine se déroule comme celle d’un prion. Cela devrait faciliter l’identification des caractéristiques moléculaires de ce phénomène, » illustre-t-il. « Nous rentrons dans une phase extrêmement active pour découvrir des traitement qui s’attaquent enfin aux mécanismes de la maladie, et non plus seulement à ses symptômes », conclut le chercheur.
Note :
Unité 5293 Inserm/Cnrs, Institut des maladies neurodégénératives (IMN), Université Victor Segalen, Bordeaux.
Article relevé dans Actualités INSERM de Décembre2013
Transmis par Soize Vignon
Les dysphagies parkinsoniennes
Publié le 31 mars 2014 à 10:23Article paru dans LE PARKINSONIEN INDÉPENDANT n°56
En 2009, lors d’une réunion d’information organisée à Paimpol par l’APCA, Monsieur Hubert Colombel, orthophoniste et psychomotricien a fait un exposé sur le fonctionnement, les troubles et la rééducation de la déglutition. Un résumé de cet exposé a fait l’objet d’un article dans le numéro 36 du Parkinsonien indépendant, sous le titre « Le mouvement du cormoran”. Compte tenu du nombre de patients concernés par ces troubles et aussi de certains accidents, il nous a paru important de reprendre cet article de 2009 et de le compléter en insistant sur le rôle essentiel des aidants et des personnels de santé.
Rappelons quelques définitions :
- La déglutition se définit comme l’action par laquelle le bol alimentaire est transféré de la bouche à l’estomac.
- La dysphagie est une impression de gêne ou de blocage ressentie au moment de l’alimentation lors du passage des aliments dans la bouche, le pharynx ou l’oesophage. Les dysphagies peuvent être dues à différentes pathologies (accidents vasculaires cérébraux, cancer de la sphère ORL).
Dans ce qui suit, nous ne traiterons que des dysphagies d’origine Parkinsonienne.
1. Fonctionnement de la déglutition :
Après une première démarche (parfois laborieuse pour le Parkinsonien) qui consiste à porter l’aliment vers la bouche, la déglutition va se dérouler en 3 temps :
- le temps buccal (mouvements volontaires)
- le temps pharyngé (mouvements réflexes)
- le temps oesophagien (mouvements réflexes)
Le temps buccal
Il est géré par le système pyramidal (les mouvements sont volontaires). Ce temps buccal va se dérouler en plusieurs phases successives :
- tout d’abord, une phase bilabiale pour saisir l’aliment par les lèvres et le porter au niveau des dents, ce qui suppose de bonnes mobilité et tonicité des muscles des lèvres.
- puis, une phase apicale (pointe de la langue ou apex). La langue fonctionne comme une « louche »,pour venir récupérer l’aliment derrière les dents et amorcer le début de la formation du bolus, en cherchant à condenser l’aliment au niveau du palais. Cette action de louchage demande une bonne mobilité de la langue.
- ensuite, une phase de mastication. En fonction de l’aliment, les mandibules sont mises en action pour écraser l’aliment, lui associer de la salive et préparer le bolus.
- enfin, une phase de constitution du bolus. Grâce à l’élévation de la langue au palais, et à la compression en amont du bolus, une dépression s’exerce à l’arrière ce qui prépare le temps pharyngé qui va suivre. Cette phase demande du tonus pour exercer cette pression et déclencher le temps pharyngé.
Le temps pharyngé (réflexe)
Le déplacement du bolus vers l’arrière de la bouche provoque une élévation du voile du palais, ce qui évite le reflux nasopharyngé en fermant l’accès aux voies nasales. Le temps pharyngé réflexe se déclenche lorsque le bolus arrive à la base de la langue. Le bolus est propulsé vers l’arrière par un coup de piston de la langue. Au même moment, se produit un mouvement d’ascension du larynx et un abaissement de l’épiglotte pour empêcher la fausse route de l’aliment vers la trachée. Simultanément, les sphincters de l’oesophage se relachent pour permettre au bolus de glisser jusqu’à l’estomac.
Le temps oesophagien (réflexe)
Les muscles de l’oesophage se contractent, ce qui permet la descente du bolus vers l’estomac.
2. Les premiers indices d’une dysphagie :
L’aidant a un rôle très important dans la détection d’une dysphagie débutante, par la surveillance et l’observation du patient.
Souvent, les premiers indices ne sont pas évidents à interpréter. Le patient mange plus lentement, limite ses rations alimentaires, est vite rassasié, ce qui peut entrainer dénutrition, déshydratation, perte de poids.
Et puis apparaissent des signes plus spécifiques à la dysphagie et localisés dans la sphère ORL : toux, présence de bave (oreillers tachés au réveil), présence de débris alimentaires dans la bouche en dehors des repas, rejet d’un comprimé un certain temps après la prise, mauvaise haleine etc… Il est alors grand temps de consulter un orthophoniste qui a compétence pour traiter les troubles de la déglutition.
3. Les troubles de la déglutition (Dysphagie)
La déglutition fait appel à un ensemble de mouvements fins et complexes de la bouche, du pharynx et de l’oesophage. Une bonne déglutition implique une parfaite synchronisation entre le mouvement volontaire et les mouvements réflexe. Chez le Parkinsonien, les troubles apparaissent dès l’atteinte de la sphère bucco-faciale (lèvres, bouche, pharynx.), dont les muscles perdent souplesse et tonicité. Le Parkinsonien dysphagique peut être sujet : aux fausses routes, à des reflux, à l’hypersiallorrhée.
Les fausses routes
Dans ce cas, généralement en raison d’un mauvais réflexe pharyngé, l’aliment au lieu d’emprunter la voie digestive vers l’oesophage., se dirige vers la voie respiratoire de la trachée. Il est alors le plus souvent refoulé avec ou sans toux. Mais,dans le cas de patients gravement atteints, les fausses routes peuvent provoquer des problèmes pulmonaires de plus en plus graves, voire le décès par asphyxie.
Les reflux
Il s’agit soit de remontée du bol alimentaire de l’estomac ou de l’oesophage, soit de reflux de débris alimentaires à partir de cavités latérales du pharynx. Ces reflux désagréables peuvent provoquer une perte de poids , voire une déshydratation.
L’hypersiallorrhée
Elle est rarement due à un excès de salive par les glandes salivaires, mais le plus souvent à un trouble de déglutition. Normalement, la salive produite régulièrement est absorbée automatiquement, à raison de 2000 fois par jour. En cas de non absorption, la salive s’accumule dans la bouche et comme le patient a les lèvres entrouvertes et la tête baissée, elle finit par déborder et couler à la commissure des lèvres. C’est le « bavage ».
Les troubles de la déglutition concernent environ 50% de Parkinsoniens. Environ 90% de ces dysphagiques ont une phase buccale perturbée. Plus de 90% n’arrivent pas à bien former le bolus et 30% ont tendance à avoir des fuites de liquide au niveau des lèvres. 80% ont tendance au bavage.
4. Rééducation de la déglutition
Compte tenu des risques dus aux troubles de la déglutition, la rééducation chez un orthophoniste est nécessaire et cela le plus tôt possible. Or actuellement, 5% des dysphagiques seulement bénéficieraient d’une rééducation. Le rôle de l’orthophoniste consiste à : établir pour le patient un bilan de la deglutition, proposer une démarche thérapeutique, proposer des exercices de rééducation.
Bilan de la déglutition
Pour établir le bilan, l’orthophoniste utilisera tout d’abord les informations fournies par le patient sur ses difficultés (problèmes gestuels, fausses routes, la manière d’organiser ses repas, etc…). Ensuite, il procédera à un examen clinique pour savoir comment le patient déglutit les liquides, les semi liquides et les solides, en notant la posture, la coordination des différentes phases de la deglutition. Enfin il pourra prendre en compte des informations médicales, comme celles fournies par un examen par fibroscopie. Cet examen est indispensable pour détecter certaines fausses routes souvent silencieuses et peut fournir des informations précieuses sur le déroulement des différentes phases de la déglutition. La cinéradiographie et la manométrie permettront aussi, si nécessaire, de préciser le bilan.
Démarche thérapeutique :
L’orthophoniste pourra alors engager une démarche thérapeutique. Il pourra, avec le patient, mettre le doigt sur le dysfonctionnement, expliquer le processus de déglutition verbalement et à l’aide de représentations visuelles (dessins, photos, vidéos), lui donner des conseils pour l’organisation des repas, le comportement à table, ainsi que pour le choix des aliments, travailler la perception et la réalisation des schèmes moteurs de la déglutition à partir d’exercices personnalisés. Par exemple, on pourra solliciter une réaction réflexe des phases pharyngée et oesophagienne, préparer des exercices à réaliser fréquemment à domicile.
Exemple d’exercice : le mouvement du cormoran
Voici un exercice proposé en consultation par Mr Colombel à ses patients dysphagiques et qu’il leur conseille de faire à domicile Mr Colombel a présenté une vidéo pour expliquer les mouvements qu’il a ensuite mimés devant l’assistance. L’exercice a pour but, une fois le bolus correctement constitué, de favoriser le déclenchement du réflexe pharyngé. Les différents gestes sont les suivants :
Inspiration : blocage respiratoire (pour stimuler la fermeture des voies respiratoires) pression spontanée et forte du milieu de la langue sur le milieu du palais, menton légèrement fléchi, nuque étirée, épaules basses, tronc vertical, pieds à plat.
secousse éventuelle de la tête au moment où la phase pharengée s’installe en relevant le menton, et en le rabaissant ensuite pour dynamiser l’action réflexe. C’est le « mouvement du cormoran », qui s’apparente à celui de l’oiseau marin, lorsqu’il ingurgite un gros poisson.
toux accompagnant l’expiration pour dynamiser le mouvement. Le patient pourra orienter la tête en fonction de sensation de présence de résidus alimentaires et tousser deux à trois fois avant le bolus suivant.
Cet exercice répété au domicile, aussi bien pendant que hors des repas doit améliorer le déclenchement du réflexe pharyngé et doit être pratiqué en cas de risque de fausse route. Enfin, à partir de son expérience de psychomotricien, Mr ColombeI recommande le mouvement du cormoran aux dysphagiques sujets au « bavage », la répétition de l’exercice pouvant permettre de retrouver le réflexe (mémoire procédurale).
5. Les repas et l’alimentation du dysphagique
Si malgré les séances de rééducaction, les troubles persistent ou ne sont pas assez atténués (c’est malheureusement le cas des patients à des stades évolués de la maladie), il faudra prendre des dispositions particulières pour aider ou faire manger et boire ces patients. Au moment des repas, le patient devra être assis bien droit sur son siège.au calme. Il ne faut pas le faire parler. Par contre, on lui demandera de baisser la tête vers l’avant avant d’avaler. L’alimentation sera adaptée à la gravité des troubles de déglutition. L’idée est d’épaissir les aliments pour faciliter le passage dans l’oesophage. Les aliments solides seront hachés et on utilisera de l’eau gélifiée.
6. Au secours !
Malgré le suivi strict des mesures préventives, le patient peut être victime d’une crise d’etouffement. Comment agir en cas d’urgence ? A cette question, nous reprendrons telles quelles les réponses faites dans le numéro 5 de la revue Actisoins par Déborah Fradin. Deux cas peuvent se présenter :
- Dans le 1er cas, la victime ne peut plus parler, ne peut pas crier, ne peut pas respirer ou très bruyamment. Très fréquemment, elle porte les mains à la gorge et a la bouche ouverte. Dans ce cas, l’obstruction est grave car les voies aériennes sont obstruées totalement ou presque totalement. Si aucun geste de secours n’est effectué, le décès surviendra au bout de quelques minutes.
Conduite à tenir : Laisser la victime dans la position dans laquelle elle se trouve : assise ou debout. Donner à la victime cinq claques vigoureuses dans le dos (au maximum). Ces claques doivent être effectuées avec le plat de la main, entre les omoplates de la victime, son buste penché légèrement en avant. Le but de ces claques est de débloquer et d’expulser le corps étranger en provoquant un mouvement de toux qui obstrue les voies aériennes. La désobstruction des voies aériennes est signée par une reprise de la ventilation, l’apparition de toux et l’expulsion du corps étranger
En cas d’inefficacité, réaliser cinq compressions abdominales (au maximum), d’après la méthode de Heimlich, dans le but de comprimer l’air contenu dans les poumons et, comme pour le piston d’une seringue, d’expulser le corps étranger qui obstrue les voies aériennes. Pour cela, se placer derrière la victime, à une hauteur confortable pour pouvoir passer ses bras horizontalement sous les bras de la victime puis mettre le poing au creux de son estomac, sous l’appendice xiphoïde, placer sa seconde main sur son poing, puis, sans s’appuyer sur les côtes, effectuer un mouvement vers soi et vers le haut. Pendant cette manœuvre, la victime sera légèrement penchée en avant, afin de visualiser l’expulsion du corps étranger et de stopper la manœuvre dès que ce sera le cas.
Il conviendra, en cas d’échec, de renouveler les claques dans le dos. Si l’expulsion est impossible, l’état de la victime se dégradera et les gestes de secourisme seront à adapter (réanimation cardio-pulmonaire).
- Dans le second cas, la victime peut encore ventiler, l’air passe, l’obstruction est partielle. Aucun geste spécifique ne sera à effectuer : installer la victime en position assise et encourager la toux. Les grands principes de secourisme restent toujours de mise : appel à l’aide, faire venir le chariot d’urgence, oxygéner si besoin et, quelque soit le cas, un avis médical est obligatoire par un médecin sur les lieux ou via le 15.
Dans une salle de réfectoire, dans une chambre, l’urgence respiratoire majeure de cette obstruction totale par corps étranger justifie deux gestes de sauvetage que l’ensemble des professionnels de santé devrait connaître : les claques dans le dos et la manœuvre de Heimlich.
En conclusion, on retiendra le souhait de Madame Déborah Fradin que les deux gestes de sauvetage (les claques dans le dos et la manœuvre de Heimlich soient connus de l’ensemble des professionnels de santé). Cela devrait aussi s’appliquer à tout aidant ayant en charge un Parkinsonien dysphagique.
Bibliographie :
Déborah Fradin Les troubles de déglutition du sujet âgé
(Actusoins de Juin 2012)
Rédigé par Jean Pierre Lagadec
La thérapie génique : méthodologie dans le service du Dr. Palfi
Publié le 29 mars 2014 à 09:27Article paru dans LE PARKINSONIEN INDÉPENDANT n°56
Que signifie cette expression ?
La thérapie génique est une stratégie de traitement de maladie consistant à faire pénétrer des gènes (ou pièces neuves) dans les cellules ou les tissus d’un individu porteur de gènes défectueux(ou pièces altérées) au moyen de « virus domestiqués », pour traiter une maladie. Presque comme un mécanicien qui ouvrirait un capot pour remplacer une pièce cassée.
Plus simplement : Prenons l’exemple d’un postier qui doit déposer un petit colis de pièces de rechange chez un mécanicien et qui trouve les grilles du domaine fermées. Il est trop gros pour pouvoir se faufiler, mais s’avise d’un enfant qui passe. Celui-ci est suffisamment mince : il lui donne le paquet et lui indique où aller le déposer. La pièce de rechange est bien arrivée et le moteur sera réparé.
On se sert de la capacité d’un virus à pénétrer à l’intérieur d’une cellule pour lui « coller » et faire transporter une pièce de remplacement d’une pièce défectueuse à l’intérieur de la cellule, ce qui fait de nouveau fonctionner la cellule ou le groupe cellulaire de manière normale.
Quelle sont les signes de la maladie de Parkinson ?
Les trois principaux symptômes de la maladie de Parkinson sont :
- le tremblement de repos, le plus facile à voir sur les mains
- la bradykinésie/ akinésie : troubles du mouvement, ralenti ou absent
- Troubles du tonus, la rigidité, ou maintien du muscle et du squelette dans une position presque figée.
Les autres signes :
- syndrome dépressif : il est présent chez 40 à 50 % des patients et peut être un signe d’entrée dans la maladie. Il peut être interprété à tort, par l’entourage, comme un manque de volontarisme et de combativité face à la maladie.
- instabilité posturale : L’équilibre et la marche sont régulés par des réflexes dits de posture. Ces mouvements involontaires perturbés se manifestent par des troubles de l’équilibre pouvant entraîner des chutes. Il s’agit généralement d’une manifestation tardive.
- hypersudation
- trouble de la mastication et de la déglutition
- hypotension orthostatique : étourdissement au passage en position debout
- constipation
- besoin impérieux d’uriner
- troubles du sommeil (difficulté d’endormissement, réveils nocturnes, temps de sommeil abrégé)
- bradyphrénie : ralentissement d’idéation. La personne semble difficilement comprendre ou s’exprimer. Puis vient la confusion mentale et même la démence.
Traitement :
- Le plus ancien : la L‑dopa, inconvénient majeur, l’effet du médicament diminue avec le temps
- Un nouveau traitement par le biais d’une thérapie génique, est actuellement en cours d’expérimentation chez l’homme. Cet essai découle des résultats encourageants d’études préliminaires menées chez le primate (singes). Ceux-ci sont présentés, mercredi 14 octobre 2010, sur le site de la revue Science Translational Medicine par l’équipe du professeur Stéphane Palfi (CNRS/CEA, hôpital Henri-Mondor, Créteil) associée à des chercheurs de la société de biotechnologie britannique Oxford Medica.
Deuxième affection neurodégénérative la plus fréquente après la maladie d’Alzheimer, la maladie de Parkinson (qui touche 100 000 personnes en France) se traduit par des troubles moteurs de sévérité croissante, avec des tremblements, une rigidité des membres et une diminution des déplacements.
Elle résulte d’une dégénérescence des neurones cérébraux qui produisent la dopamine, neurotransmetteur indispensable au contrôle des mouvements. L’administration d’un traitement par la L‑dopa, un précurseur de la dopamine, pour combler ce déficit, tout comme la greffe de neurones d’embryons, ne donnent pas des résultats suffisamment bons sur le long terme.
Une équipe américaine, associée à la société Genzyme, a déjà testé sur l’homme une thérapie génique utilisant un virus comme vecteur d’un seul gène, avec une efficacité qui reste à confirmer. Pas d’effets indésirables.
D’où l’idée de Stéphane Palfi et de ses collaborateurs d’utiliser un vecteur viral pour faire s’exprimer dans le cerveau non pas un, mais trois gènes permettant d’assurer la production de dopamine de manière continue. « Au cours d’un essai chez le primate avec un groupe contrôle, nous avons démontré que ce concept pouvait marcher. Nous utilisons comme vecteur un virus d’origine équine, capable de transporter les trois gènes et nous l’injectons dans le striatum », explique Stéphane Palfi. Le striatum est la région du cerveau où la dopamine manque le plus au cours de la maladie de Parkinson. Les chercheurs ont utilisé comme modèles des macaques qui développent la maladie de Parkinson, après administration d’une toxine, et qui souffrent des mêmes effets indésirables observés lors du traitement par la L‑dopa (anomalies du mouvement) chez l’homme.
« Les primates récupéraient dès la deuxième semaine après la thérapie génique, et nous avons vérifié que ce bon résultat était conservé avec un recul de 44 mois, avec en particulier l’absence des effets indésirables de la L‑dopa », indique Stéphane Palfi. Les trois gènes permettent à la fois la production de dopamine et la conversion de la L‑dopa en dopamine, précise le chercheur. « Leur production de dopamine représente 50 % de la production normale. Dans la maladie de Parkinson, les symptômes apparaissent lorsque 70 % des neurones produisant de la dopamine sont détruits », remarque Stéphane Palfi.
Toujours associée à Oxford Medica, l’équipe a obtenu des autorités le feu vert pour procéder à un essai clinique. Un premier patient a été opéré en mars 2008. Cinq autres ont suivi, toujours avec les mêmes résultats en termes de tolérance de la thérapie. Les premières observations, non publiées à ce jour, montrent une amélioration des symptômes, mais un nouvel essai, dit de phase 2, permettra d’évaluer l’efficacité de ce traitement chez l’homme.
(Source thérapie génique : Paul Benkimoun lemonde.fr
Transmis par Dominique Bonne
Le succès thérapeutique est aussi un état d’esprit
Publié le 27 mars 2014 à 08:20Article paru dans LE PARKINSONIEN INDÉPENDANT n°56
Les médecins expérimentés le savent : la disposition personnelle, la confiance dans l’efficacité des médicaments et des mesures prescrites, ainsi que l’interaction harmonieuse entre le médecin et le patient sont décisives pour le succès de tout traitement.
Les chercheurs sur le cerveau prouvent scientifiquement ce phénomène.
La nouvelle a fait l’effet d’une bombe dans les cercles de neurologues (mais pas seulement) : « Les placebos sont aussi efficaces que les médicaments dopaminergiques chez les patients parkinsoniens ! » Tel était le titre du célèbre magazine spécialisé Science en 2001. Dans cette publication, les chercheurs de l’équipe de Raül de la Fuente-Fernandez, Université de Colombie britannique à Vancouver, ont présentés une découverte étonnante : ils ont administrés des placebos (du latin : « je plairai ») à des patients parkinsoniens et les symptômes des patients se sont rapidement améliorés, aussi fortement qu’après la prise d’une dose de médicament dopaminergique. Un fait qui en soit n’a rien de sensationnel : dans l’antiquité, les chamanes connaissaient déjà les effets positifs des placebos ! La médecine occidentale moderne en tient compte également. Toutefois, les chercheurs canadiens ont réussis pour la première fois à décrypter l’effet placebo.
En effet, dans le cadre d’essais, ils ont scanné le cerveau des sujets à l’aide de la technique de tomographie par émissions de positons (TEP Scan). Ils ont observé que peu après l’administration des placebos, une activation de la substance noire se produit et intensifie la libération de dopamine. De toute évidence, les placebos ont non seulement un effet sur la psyché, à savoir le ressenti subjectif, mais également sur le plan physiologique, car ils influencent les processus biochimiques dans l’organisme. Pour résumer : les placebos agissent bien qu’étant dépourvus de substances actives, de la même manière que les « vrais » médicaments.
Depuis, les groupes de chercheurs du monde entier se penchent sur l’effet placebo – avec des résultats parfois surprenants. Ainsi, au mois de mai 2004, le chercheur sur le cerveau et médecin turinois Fabrizio Benedetti a fait fureur avec une publication dans le magazine spécialisé Nature Neuroscience (en ligne). Il a injecté de la solution saline dans le cerveau de patients parkinsoniens – en leur assurant qu’il s’agissait d’un antiparkinsonien. Après l’injection, la mobilité et les tremblements des patients se sont nettement améliorés. En effet, la simple attente positive de recevoir un médicament efficace suffit au cerveau pour libérer davantage de dopamine – qui compte parmi les hormones du bonheur.
« Sans substance active » n’est pas synonyme d’« inefficace ».
Il est devenu indiscutable que les placebos sont bien davantage que des médicaments « vides ». Ils représentent une médecine « mentale », composée de communications et d’actes susceptibles d’attiser suffisamment l’expectative positive d’un patient pour déclencher une réaction physiologique souhaitée dans le cerveau.
Les chercheurs de Düsseldorf autour du neurologue Lars Wojtecki ont même démontré récemment que c’était possible sans pilule ni injection (Deutshlandfunk, août 2013). Ils ont examiné chez des patients qui avaient subis depuis un certain temps une stimulation cérébrale profonde (SCP) si leur mobilité pouvait être améliorée ou aggravée simplement par la foi en son efficacité. Pour ce faire, les chercheurs ont déclenché des attentes clairement définies uniquement par des mots : ils ont annoncé (avec des textes normalisés) aux sujets qu’ils allaient modifier les paramètres de stimulation de la SCP pour influencer positivement ou négativement leur motricité. Par exemple : « Nous modifions la stimulation pour vous permettre de mieux bouger les mains. » En réalité, la stimulation n’était pas changée. Résultat de l’essai : quand les chercheurs ont suscité une expectative positive, la mobilité s’est améliorée, notamment lors de la rotation des mains. En cas d’attente négative, la mobilité s’aggravait.
Ils ont ainsi pu démontrer que, comme l’administration de pilules ou d’injections factices, une suggestion purement verbale suffit à créer une attente positive si forte qu’un effet placebo apparaît. Mais ce n’est pas tout : lors des essais des chercheurs allemands, les effets secondaires typiques de la SCP, par exemple l’aisance verbale légèrement moins fluide, se sont renforcés. Plus la mobilité des patients était bonne, plus les mots leur venaient lentement à la bouche. Les médecins n’avaient pas du tout informé les patients de ces possibles effets secondaires de la SCP au préalable.
Les chercheurs ont imputé ces effets épatants à un processus inconscient, vraisemblablement de conditionnement. En effet, les patients avaient déjà été stimulés pendant quelques mois avant les essais et s’étaient donc (inconsciemment) habitués à perdre légèrement leur faculté du langage pendant les phases de très bonne mobilité. Dans l’expectative positive suscitée par les chercheurs, ils ont, de manière inconsciente également, pu produire cet effet indésirable.
Ami ou ennemi, l’esprit est puissant.
James Sulzer et Roger Gasser, tous deux ingénieurs dans le laboratoire des sciences de la réadaptation de l’ETH de Zurich, ont fait des observations similaires (Horizonte, juin 2013). Ils ont réussi à faire augmenter ou diminuer volontairement l’activité nerveuse de la substance noire par des sujets sains. L’astuce : le « neurofeedback ». Ce terme désigne des essais durant lesquels les sujets reçoivent un retour direct sur leur activité cérébrale, qui est mesurée toutes les deux secondes au moyen de l’imagerie par résonance magnétique fonctionnelle. MM. Sulzer et Gasser ont demandé aux sujets de penser pendant 20 secondes à quelque chose de neutre, puis pendant 20 secondes à quelque chose de positif comme un bon repas, une expérience romantique ou à des plaisirs sexuels. Ce faisant, ils voyaient monter une balle jaune sur un écran à mesure que du sang oxygéné était mesuré dans la région de la substance noire – en d’autre terme, plus elle était active. L’objectif était de faire grimper la balle le plus haut possible. Et, en effet, avec un peu d’entraînement, les sujets ont bel et bien réussi, bien que brièvement, à faire progresser la balle vers le haut par la seule force de représentations « heureuses ».
Toutes les études de recherche sur le cerveau prouvent à quel point notre esprit est puissant ! Il est ainsi évident que notre disposition interne peut également influencer le succès d’un traitement médicamenteux à proprement parler – et ce en bien comme en mal.
Si un patient est favorable à la thérapie prescrite par le médecin, s’il croit en sa pertinence et en son efficacité, le succès thérapeutique sera relativement grand. En revanche, s’il doute des bienfaits du traitement, ce dernier aura très probablement des effets négatifs. Et si le patient a très peur des éventuels effets secondaires, la probabilité qu’ils se manifestent augmente considérablement. On qualifie cet effet de nocebo (en latin « je nuirai »), car il agit négativement.
Grands espoirs, efficacité maximale
L’intensité de l’effet placebo ou nocebo est directement proportionnel à l’intensité de l’expectative suscitée auparavant. C’est ce qu’ont pu démontrer des chercheurs autour de Jon Stoessl, université de la Colombie Britannique à Vancouver, à l’aide d’une stratégie d’essais extrêmement astucieuse (Archives of General Psychiatry, vol. 67, page 857, 2010) : ils ont réparti des patients souffrant d’un Parkinson modéré dans quatre groupes. Ensuite, ils leur ont dit que chaque groupe allait recevoir avec une probabilité de 25, 50, 75 ou 100% la L‑Dopa interrompue quelque temps auparavant – et non un placebo. Cependant tous les patients ont reçu une substance inactive.
Résultat : chez les patients qui s’attendaient à recevoir de nouveau leur traitement habituel avec une probabilité de 25 ou de 50%, la motricité s’est améliorée faiblement à modérément. Dans le groupe des 75% en revanche, les capacités motrices se sont fortement améliorées. Chez ces patients, la libération de dopamine la plus forte a été mesurée dans le mésencéphale.
Quant aux patients du groupe des 100%, ils n’ont pas du tout réagi. Contradiction ? Pas du tout ! En effet, on sait grâce à la recherche sur l’apprentissage que les attentes suscitées sont les plus importantes quand un succès est très probable, mais pas tout à fait certain. Si le succès est assuré, le résultat est déjà connu au préalable – et ne laisse place à aucune expectative.
Quelles sont les répercussions pratiques ?
Transposés dans le domaine des « vrais » médicaments, ces résultats de recherche impressionnants signifient que plus les espoirs placés par un patient dans la thérapie prescrite sont grands, plus la probabilité qu’elle agisse efficacement est élevée. Si tel est le cas, le patient jouit d’une meilleure qualité de vie. Et la confiance dans le traitement augmente.
En clair, un médecin doit d’abord bien « vendre » le traitement à son patient – quand bien même son efficacité serait prouvée sans aucun doute. Il est nécessaire qu’il prenne en tout premier lieu le temps d’aborder personnellement chaque patient, de bien le connaître et de créer une atmosphère de confiance. Il peut, ensuite, par des questions approfondies, découvrir ce qui lui pose le plus de problème actuellement (sa souffrance). Ce n’est qu’ainsi que les priorités pourront être définies correctement et que le médecin pourra – après consultation et bien sûr toujours avec l’accord du patient – aborder de manière ciblée et efficace les troubles les plus graves. Par ailleurs, le médecin doit toujours porter un regard positif sur l’avenir – honnêtement sans enjoliver la réalité, mais sans oublier non plus les nombreuses petites choses qui rendent la vie belle malgré le Parkinson. Les conseils sur les moyens auxiliaires et les mesures qui peuvent aider au quotidien en font partie.
Médecins, thérapeutes et soignants doivent penser différemment.
Pour autant, le médecin n’est pas le seul à avoir une influence décisive sur l’efficacité des mesures prescrites de par sa personnalité, son approche personnelle et sa communication avec le patient. Les thérapeutes et les soignants doivent également se tenir au courant des découvertes neuroscientifiques – afin de connaître les répercussions du Parkinson sur la vie et le comportement des personnes concernées, et de mieux comprendre les patients. Ce n’est que lorsque les spécialistes peuvent considérer la situation avec un bon angle d’observation (neuroscientifique) qu’ils peuvent percevoir et interpréter correctement les phénomènes visibles, mais également les signes cachés. En effet, une maladie chronique comme le Parkinson concerne toujours l’individu dans son intégralité, elle a des conséquences physiques, mais aussi sociales et mentales. Les médecins, les soignants et les thérapeutes doivent donc penser et agir de manière holistique.
Important : le patient doit être impliqué le plus activement possible dans tous les actes et toutes les mesures. De cette manière, il peut se confronter à son environnement – ce qui donne un sens à son quotidien et matière à son existence. En effet, la forme physique est étroitement liée à la forme mentale – et toutes deux doivent être entraînées conjointement. C’est ce que prouvent des études actuelles, dont les résultats viennent d’être présentés lors du congrès allemand des neurologues. Ainsi un entraînement purement cérébral ou purement physique permet uniquement, avec l’âge, de conserver la cognition. Si l’on combine les deux types d’entraînement, la performance intellectuelle peut être considérablement accrue. Autrement dit, une promenade dans la nature, avec de nombreuses impressions sensorielles et sur un sol inégal, est plus efficace qu’un jogging dépourvu de sens sur un tapis de course.
De plus, toutes les mesures doivent être orientées vers le quotidien. En effet, quel est l’intérêt pour le patient qu’il soit sûr de lui sur le sol plat d’un gymnase, mais trébuche, voire chute régulièrement quand il marche sur l’asphalte ? Heureusement, la réadaptation moderne en cas de Parkinson a désormais à sa disposition des outils prometteurs. Parallèlement au concept thérapeutique LSVT-BIG, qui mise sur des mouvements grands et amples, ou à l’entraînement à la motricité d’après la kinesthésie, des idées astucieuses issues de l’ergothérapie sont intégrées de plus en plus souvent aux mesures employées – avec pour objectif la plus grande autonomie possible au quotidien. De plus, les traitements, qui visent une large autonomie, aident les personnes concernées à jouir d’une grande qualité de vie. Et c’est précisément ce but qui doit être central.
Lu dans « Parkinson Suisse » n°112 décembre 2013
Par Jean Graveleau
Éditorial
Publié le 26 mars 2014 à 16:29Article paru dans LE PARKINSONIEN INDÉPENDANT n°56
Etre optimiste, le début d’une amélioration de nos traitements thérapeutiques, c’est ce que développe notre premier article : il évoque les résultats d’expériences scientifiques sur les effets placebo et nocebo. Ces recherches viennent confirmer ce que l’on ressent intuitivement comme malade : l’attitude positive de notre interlocuteur (médecin, neurologue, kinésithérapeute) nous amène à mieux réagir aux traitements…
Et puis, un coupable est découvert : il s’agit de l’A‑synucléine. Cette protéine déclenche, à elle seule, la neurodégénérescence associée à la maladie de Parkinson. « Nous rentrons dans une phase extrêmement active pour découvrir des traitements qui s’attaquent enfin aux mécanismes de la maladie, et non plus seulement à ses symptômes », conclut le chercheur B. Dehay.
Mais les chercheurs en neurosciences ont « soif de capitaux » et votre participation est vivement souhaitée en proposant vos dons à notre fonds « CECAP Recherche ». Même modestes, vos dons sont indispensables : rappelez-vous la fable du colibri. Face à un incendie de forêt, un tout petit colibri prend dans son bec une gorgée d’eau et va la jeter sur le feu. Des spectateurs lui font remarquer l’inutilité de son action, que ça n’apporte pas de résultats probants. Il leur répond que l’essentiel est de participer ! Si tous, nous nous mettons en marche, les gouttes d’eau feront les grandes rivières…
Deux articles viennent nous rappeler les précautions à prendre en sus de nos traitements : savoir prendre contact très tôt avec l’orthophoniste en cas de dysphagie ou le podologue pour soigner notre instrument principal de déplacement, nos pieds. Il ne s’agit pas de simples mesures de confort mais de nécessité vitale à l’autonomie des malades et à leur mieux-être.
Je suis traité depuis 20 ans aujourd’hui et les symptômes se font ressentir de manière plus prégnante. Sur les conseils de ma kiné, j’ai rencontré un médecin microchrononutritionniste qui m’a conseillé de commencer un traitement sur mon hygiène alimentaire. Cette thérapeutique nouvellement promue reprend des éléments déjà bien connus des personnes qui se préoccupent du bien-être physique (les sportifs de haut niveau, les spécialistes du vieillissement, …). Il s’agit de se nourrir correctement, de manière équilibrée, en fonction des heures de la journée et en fonction de son propre organisme. Elle a fait l’objet d’une recherche sur le Parkinson. Toute une batterie d’analyses sanguines et urinaires, un régime alimentaire conséquent et une prise de compléments alimentaires importante m’ont été imposés : c’est très exigeant mais je commence à en ressentir les effets bénéfiques. Nous sommes là dans ce que nous avons précédemment évoqué sur le « deuxième cerveau » (P. I. N°53 page 5, cf. l’émission sur Arte de février) : la maladie semble prendre sa source dans les intestins et donc elle serait particulièrement liée à notre manière de manger !… La suite dans un prochain numéro.
La recherche progresse. N’attendons pas pour devenir des « Parkinsoniens Indépendants » !
Infos régionales : association de parkinsoniens de Finistère
Publié le 21 janvier 2014 à 14:04Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Nous avons nos quatre points rencontre qui fonctionnent très bien à Brest, Quimper, Quimperlé et Morlaix ainsi que nos quatre points-gymnastique adaptés pour les Parkinsoniens et encadrés par des kinésithérapeutes motivés sur Brest, Ploudaniel, Plouguerneau, Quimper. Nous envisageons la création d’un cinquième point-gym à Morlaix en 2014.
Une porte ouverte est programmée à Plouguerneau le 30 novembre pour promouvoir la nouvelle salle de sport. Notre association participera avec la tenue d’un stand. (Diaporama, distributions de documents, échanges avec le public).
Nous préparons Noël, pensons à nos adhérents qui ne peuvent plus se déplacer. Comme chaque année nous leur apporterons une boite de chocolat, des douceurs pour oublier un temps la maladie et partager un moment de convivialité.
2014 sera l’Anniversaire de notre Association, trente ans au service des malades de Parkinson, du public, des aidants, des professionnels de santé.
Après la Manche, que nous remercions pour leur accueil chaleureux et la réussite de l’A.G. CECAP, c’est à notre tour de nous y atteler. Nous nous préparons activement à recevoir nos amis du CECAP. Les dates ont été définies pour la semaine de vacances CECAP : ce sera du dimanche 5 octobre au samedi 11 octobre 2014. Les assemblées générales du CECAP et AGP se feront à Kerbeuz dans un centre de vacances « CAP France ». Vous ne serez aucunement déçu de notre choix, il y aura à la fois la mer, la campagne, la forêt, la rivière, la montagne, une grande piscine couverte (28°c), jacuzzi, sauna, Fitness (à volonté !), Repas gastronomiques (écrivez-nous au sujet de l’inscription et le programme des festivités); nous espérons vous voir nombreux en vacances dans le Finistère.
Nous continuons les informations auprès de la formation professionnelle des futurs travailleurs sociaux, AFPA de Brest, Maison Familiale rurale de Plouvenez-Lochrist et l’Association junior senior sur Quimperlé grâce à des équipes enthousiastes. Merci à tous ceux qui œuvrent pour la bonne marche de notre Association.
J’ai participé à la demande de la directrice de l’INSERM à la relecture de protocoles de recherche sur Parkinson. Pour le moment j’ai corrigé deux protocoles : Purpan Toulouse et La Salpêtrière Paris. La relecture consiste à traduire le langage scientifique en langage commun, Le but étant de simplifier la lecture de protocole, qu’il soit lisible pour tout public. Nous sommes actuellement en France 70 relecteurs toutes associations confondues inscrits à INSERM-ASSOCIATIONS.
Nous avons organisé le 12 octobre 2013 une conférence animée par le Professeur Pascal Derkinderen et le chercheur Thomas Clairambault. Environ 160 personnes se sont déplacées pour écouter les explications de la recherche sur les intestins. Le public a pu échanger avec les chercheurs et poser leurs questions. L’après midi s’est terminé autour d’un café. Merci à eux pour leur disponibilité et leur gentillesse.
Au nom de tous les Finistériens, nous vous souhaitons de joyeuses fêtes de fin d’année,
Vivons d’espoir ! Prenez soin de vous !
Dominique Bonne Président de l’Association Parkinsoniens du Finistère
La douleur d’un deuil profond mais apaisé par G. S.
Publié le 16 janvier 2014 à 12:39Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Jamais, elle ne se serait mise en avant. Mais, aujourd’hui, je me permets de retracer ses douze années avec la maladie et son combat au quotidien pour conserver au mieux sa dignité.
Nous étions ensemble depuis 10 ans lorsque peu à peu tu t‘es sentie moins bien, tu es devenue plus fatigable et sujet à la dépression. Tu as fini par consulter. Le diagnostic est tombé : « Parkinson ». Quelques mois plus tard, en raison de fortes hallucinations, une scintigraphie venait confirmer les soupçons de Maladie du Corps de Lewy. Nous étions en 2002 mais la maladie était déjà présente depuis plusieurs années.
Avec méthode, tu t’es renseignée sur cette maladie neurodégénérative ; mais c’était difficile d’obtenir des informations précises, cette pathologie atteignant en général des sujets plus âgés. Très rapidement, tu as pris contact avec l’association de Parkinsoniens. Dans un souci d’honnêteté et de clarté, tu as tenu à informer toi-même ton entourage car tu savais que tes fonctions cognitives allaient s’altérer progressivement. Plus tard, tu exprimeras le désir d’adhérer à l’ADMD (association pour le droit à mourir dans la dignité).
Nous avons été amenés à revoir nos projets à la baisse : moins de randonnées, remplacer le petit camion par un camping-car plus confortable. Les journées étaient rythmées par la prise de médicaments : « tes petites graines » comme on disait.
Malgré tout, en 2005, nous avons fait un super voyage en Guyane avec ton fils Ronan.
En 2006, nous devions aller dans les Alpes, nous n’avons pas été plus loin que la Bourgogne : c’étaient nos dernières grandes vacances…
En 2007, tout s’est précipité, tout est devenu soudain compliqué. Tu étais devenue incohérente, tu te mettais en danger : le matin, je partais au travail en veillant à bien fermer l’arrivée du gaz. Il a fallu élaborer un plan d’aide dans l’urgence.
En 2008, les neuroleptiques (LEPONEX) ont permis de retrouver un peu d’apaisement mais j’ai quand même quitté mon travail pour pouvoir être disponible auprès de toi.
Depuis, on pourrait presque dire que ta vie se déroulait au rythme de tes chutes. Pour reprendre l’expression du neurologue, « tu avais la tension dans les chaussettes », ce qui entraînait des malaises, des petites syncopes. La maison garde des traces de tes nombreuses chutes : lampes rafistolées, rideaux déchirés, poignée du Frigo arrachée… deux cuvettes de WC explosées inondant à chaque fois la maison. Mais aussi, bien avant, deux voitures transformées en épaves : deux accidents auxquels tu as eu la chance de t’en sortir indemne.
Mais tu n’as pas échappé aux séjours à l’hôpital : mai 2010 fracture à la cheville, septembre 2011 col du fémur. La maladie n’a jamais cessé de progresser, avec parfois des paliers qui donnaient l’impression de répit. Le passage par les stades de GIR 3, GIR 2, GIR 1, venait confirmer ta perte d’autonomie.
Jamais tu ne t’es exprimée sur ton ressenti.
A plusieurs reprises, tu as fait des tentatives mais à chaque fois tu buttais, tu disais que tu ne trouvais pas les mots justes pour exprimer ce que tu vivais.
En août 2010, j’ai écrit quelques mots, des « bouts de phrases pour essayer de te rejoindre », pour t’inciter à en dire plus. Bien sûr, cela n’a pas eu l’effet escompté mais je sais que tu as relu à plusieurs reprises le petit cahier d’écolier. Peut-être y as-tu trouvé un peu de réconfort ?
Voici quelques unes de ces réflexions.
Elles donnent un éclairage sur ta maladie, sur ton quotidien…
Impression d’être condamné
A trouver tout seul les réponses
Quitte à me tromper totalement.
Parce que les mots ne sont plus tes alliés
Tu les as remisés
Comme les outils d’un autre temps
Reste ton regard : il faut y plonger
Pour trouver des mondes incertains.
La nuit, dans tes rêves agités,
Tu libères le trop-plein d’inquiétude
Tout le jour contenu.
Ton silence tes silences sont lourds de sens
Ta douceur est déroutante,
Jamais tu ne te rebelles.
Soumission, résignation
Ou profonde sagesse ?
De la patience, tu es la rude école.
Te bousculer ne sert à rien.
Une chose à la fois
Le temps pour chaque chose.
Derrière ton silence, tu es une énigme.
Comment t’en vouloir ?
Personne n’est à l’abri d’une sale maladie.
A travers ton silence,
Tu es encore plus touchante.
Parfois on dirait que tu traînes ton corps
Comme un fardeau tellement lourd
Qu’il emporte ton esprit.
Obsédée du mot juste, tu n’arrives plus
A exprimer ce que tu ressens.
Peut-être qu’il n’y a plus
De mots pour décrire ce que tu vis.
Dans tes yeux, je vois
Toute ta force, toute ta fragilité.
Résignée à la dépendance,
Tu consacres toute ton énergie
Pour conserver ta dignité.
Que d’humilité requiert le handicap :
Accepter l’aide,
Laisser son corps au soin des autres
Toujours plus de simplicité.
Autrefois, nous vivions de voyages.
Désormais, nous nous contentons
De la qualité d’une présence
Que saurai-je de tes angoisses ?
Ces réveils difficiles où tu avoues
Pudiquement avoir de mauvais rêves.
Mais bloquée derrière la barrière des mots,
Tu n’as d’autre recours qu’à un comprimé
Pour baisser la tension
Drapée de ton silence, tu as la noblesse
Des grandes dames.
Et moi, qui suis-je ? Tantôt bouffon,
Agité autour de sa reine.
Tantôt moine domestique
Consacré aux tâches répétitives
Mille façons de célébrer l’amour toujours.
Dans ton monde la tendresse n’a nul besoin
De s’extérioriser. Les mots, les caresses
Seraient un luxe pour bien-portants
Seule une lueur dans ton regard exprime
Ta reconnaissance, ta gentillesse.
Alors, comment te rejoindre
Lorsque baisers et caresses
Sont mon mode d’expression ?
Depuis j’ai été amené à me poser la question suivante : Et si ton silence était ton dernier espace de liberté ? Alors, j’ai décidé de le respecter.
Il ne nous restait plus qu’un geste, un regard pour communiquer. De la tendresse, beaucoup de tendresse, des overdoses de tendresse… à tel point que je me suis demandé si la tendresse n’était pas une drogue. Cela nous a permis de tenir jusqu’au bout.
A la fin, tout était devenu compliqué, surtout les repas. Tu dormais de plus en plus et les moments où tu étais présente se faisaient de plus en plus rares. La maladie nous a appris à vivre au présent, à profiter de l’instant. Aux premiers beaux jours, nous avons fait le tour de l’étang de Gruellau. A Pâques, tu as été un peu mieux pendant quelques jours ce qui t’a permis de participer à l’AG de l’association et de partager le repas avec nos amis parkinsoniens.
A la pentecôte, une infection pulmonaire a failli t’emporter. Depuis, tu étais en soins palliatifs. Tu as pris ton temps pour partir ; tes amis, tes proches ont pu ainsi te dire au revoir.
Depuis, au fond d’un tiroir, j’ai trouvé un papier plié en quatre au dos duquel tu avais écrit ces quelques mots au crayon :
« Soyez attentifs à ce que vous vivez, à ce que vous ressentez. C’est comme cela que vous allez vous construire petit à petit, vous connaître, connaître les sentiments qui sont en vous, les capacités, et c’est à partir de cela que vous allez les enrichir, les développer, écartant les erreurs, les reconnaissant, allant toujours plus loin.
Respectez-vous, écoutez-vous, ne vous laissez pas aller dans quelque chose qui n’est pas vous, qui est contre votre « sens », votre route, votre nature. Chacun est différent, ne vous comparez pas, ne cherchez pas à être comme… Pour plaire vous vous détruiriez. Ne vous sentez ni moins ni plus, sentez-vous vous-mêmes. Chacun a sa propre valeur.
Si vous vous reconnaissez vous-mêmes, vous acceptez vous-mêmes, vous serez reconnus, acceptés, vous serez heureux. Sinon vous serez toujours malheureux. Mais tout ceci n’est pas facile, sachez le. Cela nécessite un travail sur soi. Plus vous le ferez régulièrement, mieux vous vivrez. »
C’était comme un dernier cadeau. Cette ligne de vie, tu te l’aies toujours appliquée, veillant à être juste en toute circonstance. Merci pour cette leçon de vie.
Parmi les nombreux mots de sympathie que j’ai reçus, je voudrais citer cette phrase de l’équipe de Vivre à Domicile, les aides soignant(e)s qui l’ont accompagnée pendant cinq ans et demi : « Nous garderons l’image de son humanité et la bienveillance de son regard ».
Oui, c’est bien ce souvenir que nous voulons garder d’elle.
Rédigé par G. S.
Comment le cerveau se nettoie pendant le sommeil
Publié le 14 janvier 2014 à 12:31Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Dormir permet au cerveau de se débarrasser des toxines accumulées pendant la période de veille
On savait déjà que le sommeil permet de consolider les données apprises dans la journée. Il semblerait qu’il permet aussi au cerveau de se débarrasser de ses toxines
Des chercheurs américains pensent avoir compris pourquoi l’homme est programmé pour dormir plusieurs heures chaque nuit, alors que le sommeil le laisse vulnérable aux prédateurs. Le repos permettrait au cerveau de se débarrasser des toxines produites pendant les phases d’éveil, explique l’équipe de l’Université de Rochester (Etat de New York) dans un article publié dans la revue Science.
« La nature récupératrice du sommeil résulterait de l’élimination des déchets produits par l’activité neuronale qui s ‘accumulent pendant la période d’éveil », explique le Dr Malken Nedergaard, le principal auteur des travaux.
Le rôle essentiel du sommeil dans l’apprentissage et la mémoire était déjà connu, mais les chercheurs ont cette fois expliqué l’intérêt chimique d’alterner les phases d’éveil et de repos. « Cette recherche a permis de voir que le cerveau a deux états de fonctionnement distincts. Il est soit éveillé et alerte, soit dormant et en mode nettoyage. Comme il ne dispose que de ressources énergétiques limitées, il est contraint d’alterner entre l’un et l’autre ».
Dans le reste du corps, c’est le système lymphatique qui élimine les déchets cellulaires. Mais il n’inclut pas le cerveau, qui reste en vase clos, protégé par un système complexe de portes d’accès moléculaires contrôlant entrées et sorties. Le cerveau utilise lui un système unique appelé « glymphatique » dix fois plus actif pendant le sommeil qu’en éveil, ont montré les chercheurs.
Les chercheurs ont pu observer pour la première fois ce système de nettoyage cérébral grâce à une nouvelle technologie d’imagerie, utilisée sur des souris dont le cerveau est similaire à celui des humains.
Le mécanisme est intégré dans le système sanguin du cerveau. Il pompe le fluide cérébro-spinal à travers les tissus et le renvoie purifié, les déchets étant transportés par le sang jusqu’au foie où ils sont éliminés. De plus, les chercheurs ont découvert que les cellules cérébrales réduisaient leur taille de 60% quand on dort, permettant aux déchets d’être enlevés plus efficacement.
Tout cela permet notamment de nettoyer les toxines responsables de la maladie d’Alzheimer et d’autres pathologies neurologiques.
Article relevé dans le Figaro Santé du 18 Octobre 2013 par F. Vignon
La Levodopa Equivalent Dose (LED), ou comment déterminer la L‑dopa reçue par le malade
Publié le 13 janvier 2014 à 11:37Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Par Claire Smith
Les traitements médicamenteux de la maladie de Parkinson Idiopathique ont pour but de compenser le déficit dopaminergique au niveau du striatum, en administrant :
- soit un précurseur de la dopamine
- soit un agoniste dopaminergique
- ou bien en inhibant les métabolismes de la dopamine MAO‑B et COMT.
Dans un article paru dans Le Parkinsonien Indépendant n°53 de Juin 2013, des conseils d’utilisation des différents médicaments antiparkinsoniens sont donnés aux patients. (Dossier réalisé par l’Agence Nationale de Sécurité du Médicament et des Produits de Santé).
Pour établir la prescription, le neurologue va choisir parmi une panoplie d’une quinzaine de médicaments ceux qui correspondent le mieux au traitement des troubles du patient. Puis, il lui faudra doser chaque médicament, et déterminer l’efficacité globale du traitement. Au final, l’ordonnance journalière se présente comme une liste de plusieurs médicaments (de 3 à 5 par exemple), très souvent à libération immédiate, mais parfois à libération prolongée (LP) avec des dosages de plus en plus variés. Il devient alors peu évident de comparer l’efficacité de deux traitements ou de prévoir la substitution d’un médicament par un autre. C’est ici qu’intervient la notion de LED (Levodopa Equivalent Dose). C’est le sujet de l’article qui suit, rédigé à partir de comptes rendus de travaux réalisés à l’Université de Birmingham (UK) et publiés par Claire Smith.
Définition de la LED :
La LED d’un médicament est définie comme la quantité de ce médicament qui a le même effet antiparkinsonien que 100 mg de Lévodopa à libération immédiate. Dans cet article, le Sinemet 100 constitue la référence. L’effet antiparkinsonien est estimé par mesure de la motricité du patient (section III de l’UPDRS grille déterminant le degré de handicap).
Quelques exemples de Led :
- Led du Sinemet 100 mg : 100 mg
- Led du Sinemet LP 100 mg : 133 mg
- Led du Requip : 5 mg
- Led du Sifrol (sel) : 1 mg
Suite à la réaction de certains lecteurs, il parait nécessaire de fournir des explications complémentaires .Reprenons donc la comparaison entre le Sinemet à libération immédiate et la forme à libération prolongée LP, moins efficace (25 % de perte, selon Claire Smith). Si l’on compare l’effet de 2 comprimés de Sinemet, l’effet antiparkinsonien du comprimé classique est de 100, alors que celui du comprimé LP est de 75. Si on compare les Led de ces deux Sinemet, on notera qu’il faut une dose plus grande de Sinemet LP pour obtenir le même effet qu’avec du Sinemet classique (Led = 100 mg).
La Led du Sinemet LP 100 mg est donc plus grande, soit (100/75) X 100 = 133 mg
Les travaux de l’Université de Birmingham :
Il s’agit de travaux de collecte et de traitement de données sur l’ensemble des médicaments antiparkinsoniens sur le marché, jusqu’en 2009. La démarche suivie consiste tout d’abord, à collecter, à partir de mots clés « levodopa » et « equivalency », toute information de 1980 à 2009 sur l’efficacité des antiparkinsoniens, et cela pour tous les types d’études publiées en anglais. Les données ont fait ensuite l’objet de traitements statistiques (mean et mode), pour aboutir à l’obtention de Led pour tous les antiparkinsoniens.
L’étude a fourni les résultats suivants en Led, exprimés en mg, pour une quinzaine de médicaments antiparkinsoniens. Alors que les auteurs désignent chaque médicament, par le nom de sa molécule (Pramipexole, Ropinirole etc..), nous avons volontairement conservé les dénominations commerciales (Sifrol®, Requip® etc..) plus familières aux lecteurs francophones :
Médicaments à base de Levodopa :
- Sinemet 100 à libération immédiate : 100 mg
- Sinemet 100 à libération prolongée LP : 133 mg
- Modopar 125 à libération immédiate : 100 mg
- Stalevo : 77 mg
- Duodopa : 90 mg
Agonistes dopaminergiques :
- Sifrol (sel) 1 mg
- Requip 5 mg
- Neupro 3,3 mg
- Trivastal 100 mg
- Parlodel 10 mg
- Célance 1 mg
- Dopergine 1 mg
Inhibiteurs :
- Deprenyl 10 mg
- Otracel 1,25 mg
- Azilect 1 mg
- Mantadix 100 mg
Les valeurs fournies par Claire Smith sont commentées et parfois contestées dans la revue NeuroTalk, par des blogueurs qui fournissent par ailleurs quelques informations complémentaires. Signalons aussi que ces valeurs retenues sont corroborées par un tableau d’équivalence de dose fourni par Defebvre et Vérin, à la page 163, de leur livre « La maladie de Parkinson ».
Utilisation de la Led :
Désormais, on connait la Led de chacun des médicaments composant une ordonnance journalière. On peut alors calculer l’équivalent Levodopa pour chaque médicament en appliquant la formule : (Posologie journalière / Led) X 100 en mg. Exemple : pour une prescription de 2 comprimés de Requip 4 mg : 8/5 X 100 = 160 mg. On peut ensuite calculer la dose globale journalière, en additionnant les équivalents Lévodopa.
Soit une ordonnance comprenant :
3 comprimés de Sinemet à 100 mg soit : 100/100 X 300 = 300 mg
1 comprimé de Sinemet LP à 100 mg, soit : 100/133 X 100 = 75 mg
1 comprimé de Azilect 1 mg soit : 1/1 X 100 = 100 mg
1 comprimé de Requip à 8 mg soit : 8/5 X 100 = 160 mg
Soit un total d’équivalent Levodopa par jour de : 635 mg
Il s’agit d’une dose journalière plutôt moyenne. Cette dose peut excéder 1 000, voire 1 500.
Bibliographie :
— Levodopa Dose Equivalency par Claire Smith du Clinical Trials Unit de l’Université de Birmingham (UK).
— Levodopa Dose Equivalency dans la revue NeuroTalk
Traduit et transmis par Jean Pierre Lagadec jpmo5@orange.fr
Ça aussi, c’est bon pour les neurones !
Publié le 07 janvier 2014 à 10:46Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
« Quand le corps soigne l’esprit » Relevé dans Ca m’intéresse de Décembre 2013
Relaxer son corps pour relancer son cerveau :
La relaxation est la capacité du corps à relâcher ses muscles, ralentir le rythme cardiaque et la respiration. Les méthodes sont multiples, partant du corps (relaxation musculaire progressive, respiration profonde) ou de l’esprit (méditation, visualisation).
Elle permet de s’opposer aux effets du stress et de l’anxiété, améliore le sommeil ainsi que les performances cognitives lors de tâches simples. Ses effets passeraient par une modification de l’expression de certains gènes. Une étude parue en 2013 montre ainsi que ceux qui pratiquent la relaxation, même novices, expriment moins certains gènes impliqués dans le stress et l’inflammation, et d’avantage d’autres gènes, engagés dans le métabolisme énergétique.
Mobiliser les muscles du sourire pour se sentir joyeux :
Une étude de juin 2012 de l’Université du Kansas l’a confirmé : sourire déstresse et rend heureux. Ce simple mouvement d’environ 17 muscles faciaux a suffi à déclencher dans le cerveau des participants, bien qu’ils soient plongés dans une activité stressante, des modifications biochimiques libérant les tensions. Il favoriserait la production d’endorphines. « Sourire envoie un message positif à notre cerveau, qui nous transmet en retour une sensation de bien être », renchérit le Dr Nathalie Rapoport-Hubschman. Ces vertus n’ont pas échappé aux maître yogis et taoïstes qui recommandent la pratique du « sourire intérieur ». Il suffit de visualiser une situation positive, ce qui se solde par un mouvement vers le haut de la commissure de nos lèvres.
Déstresser en se faisant masser :
Circulation sanguine, oxygénation du cerveau… Les études du Touch Research Institute de Miami prouvent qu’un massage de quinze minutes bihebdomadaire chez les adultes, diminuent le stress ressenti au travail. « Le taux de cortisol, hormone du stress, chute tandis que l’ocytocine (hormone de la confiance et du bien-être, ndlr) augmente » précise Isabelle Bachelet, praticienne en massage tuina. L’interaction entre peau et cerveau s’explique, selon le Pr Didier Anzieu car « tous deux proviennent d’un tissu unique, l’ectoderme, qui se forme au 21ième jour de l’embryon ».
S’hydrater pour irriguer ses méninges :
On sait qu’il est nécessaire d’hydrater régulièrement notre corps, composé à 60% d’eau. Notre cerveau, lui, en compte 80%. Certaines études concluent qu’une perte d’eau sévère (équivalente à 5% ou d’avantage du poids corporel) ou plus modéré (2%) mais rapide (qui s’installe en quelques heures) altérerait les fonctions cognitives, entraînant une confusion, des difficultés à se concentrer, des céphalées, une plus grande irritabilité. Ces effets seraient particulièrement perceptibles chez les enfants et les personnes âgées. Des études ont montré que des enfants de 6 à 9 ans étaient moins performants pour effectuer des exercices faisant appel à la mémoire et l’attention s’ils n’avaient pas assez bu.
par Soizic Vignon soize.vignon@orange.fr
Le Dipraglurant® Une arme contre les dyskinésies
Publié le 03 janvier 2014 à 09:25Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Depuis plusieurs années, la firme pharmaceutique Suisse Addex Pharmaceuticals (SIX:ADXN), spécialisée en « modulation allostérique », travaille sur l’étude et le développement de molécules destinées à traiter les dystonies et les dyskinésies chez les patients Parkinsoniens.
C’est le cas du Dipraglurant® pour des patients souffrant de dyskinésie induite par la L‑dopa dans la maladie de Parkinson. La dyskinésie induite par la L‑dopa est un trouble moteur débilitant engendré par l’administration à long terme de traitements contenant de la L‑dopa, thérapie standard de référence pour la maladie de Parkinson.
L’étude conduite en parallèle aux Etats-Unis et en Europe est financée en partie par une subvention de la Fondation Michael J. Fox pour la Recherche contre la maladie de Parkinson.
Les dyskinésies :
Le Dipraglurant® ayant pour indication le traitement des dyskinésies Parkinsoniennes, rappelons pour les nouveaux lecteurs, de quoi il s’agit. Les dyskinésies font partie des mouvements anormaux (ou involontaires), dont peuvent être victimes les Parkinsoniens. Elles peuvent être décrites comme des mouvements soudains, incontrôlables, souvent désordonnés. Elles affectent les membres, la tête, les lèvres, et la langue. Elles sont en général, dues à un surdosage de la L Dopa. Or, il n’y a pas de produit pouvant remplacer la L Dopa avec les mêmes avantages.
Cela a des conséquences fâcheuses :
- Le patient (souvent en présence de son entourage ou en public) subit des crises dévalorisantes et fatigantes.
- A mesure que la maladie s’aggrave, il est de plus en plus difficile pour le neurologue d’ajuster la prescription afin d’éviter périodes de blocage et périodes de dyskinésie, l’espace thérapeutique étant de plus en plus réduit. Cette difficulté a justifié la réalisation de logiciels d’optimisation des traitements, à partir de données pharmacocinétiques (cf. article sur le Led ci-dessus et feuille de calcul présentée dans le P. I. n°32).
- Pendant de nombreuses années (après le consensus de Mars 2000), on a essayé dans certains cas bien définis de différer le début de prise de la L‑dopa pour retarder les survenues de dyskinésies.
Sait-on traiter les dyskinésies ? On reparle actuellement d’un médicament ancien, le Mantadix. On parle aussi de chirurgie à partir de la stimulation du globus pallidum. Mais les solutions les plus séduisantes seraient obtenues par l’arrivée sur le marché de 3 nouvelles molécules. L’une d’elles est le Dipraglurant®.
Changer la stratégie thérapeutique :
Si les essais cliniques à venir confirment les résultats déjà obtenus et après obtention de l’Autorisation de Mise sur le Marché (en 2014), le Dipraglurant® pourrait constituer une arme efficace contre les dyskinésies, dont il pourrait pallier, en tout ou partie, les inconvénients que nous avons évoqués précédemment. Il serait alors plus facile d’utiliser la L‑Dopa, qui est le médicament de référence pour la maladie de Parkinson.
Par ailleurs, l’arrivée sur le marché de produits contre les dyskinésies, comme le Dipraglurant®, constitue un argument en faveur du changement de la stratégie thérapeutique qui avait été définie dans le consensus 2000. On pourra en effet traiter à la L‑dopa, précocement dans la phase initiale de la maladie, si on a moins ou pas de risques de dyskinésies à long terme.
Rédigé par Jean Pierre Lagadec jpmo5@orange.fr
Bilan des deux boursières soutenues par CECAP (2/2)
Publié le 02 janvier 2014 à 09:56Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Bilan de Julie Meffre : Rôle du Noyau Subthalamique dans la Prise de Décision
A — PROJET DE RECHERCHE
1. Contexte de l’étude
Alors que la maladie de Parkinson a été longtemps abordée sur la base de ses symptômes moteurs, les troubles non moteurs qui lui sont associés font, depuis quelques années seulement, l’objet de recherches plus approfondies. La stimulation à haute fréquence (SHF) du noyau subthalamique (NST), utilisée avec succès pour traiter les troubles moteurs, peut cependant être à l’origine d’effets secondaires cognitifs comme un comportement impulsif ou risqué (tendance au jeu pathologique) chez certains patients. Il a été mis en évidence que la SHF altère la capacité à « freiner » la prise de décision face à une situation conflictuelle, conduisant les patients à prendre une décision hâtive et impulsive (Frank et al. 2007). Parmi les ganglions de la base, le NST semble être impliqué dans le contrôle de l’impulsivité/inhibition comportementale (Frank 2006 ; Eagle and Baunez 2010). La voie hyperdirecte, reliant les aires corticales frontales au NST pourrait être à l’origine de la régulation des processus décisionnels. Le NST semble agir en élevant le seuil de décision dans le cas d’une situation conflictuelle ou ambiguë, conduisant ainsi à différer la prise de décision, jusqu’à ce que suffisamment d’indices aient été accumulés.
2. But de l’étude
Afin de pouvoir améliorer l’anticipation d’éventuels effets secondaires de la stimulation à haute fréquence du NST sur la prise de décision chez les patients parkinsoniens, il est indispensable de bien comprendre le rôle de cette structure dans les processus décisionnels. L’objectif de notre travail de recherche, soutenu par la CECAP, a été de déterminer chez le rat
- comment le NST contribue à la prise de décision grâce à une approche comportementale réalisée chez des rats intacts versus des rats ayant subit une lésion du NST (mimant l’effet de la SHF du NST utilisée chez le patient parkinsonien)
- quelle est l’influence du système dopaminergique dans ce processus, et
- le potentiel thérapeutique d’un traitement visant le système sérotoninergique, système impliqué dans l’inhibition comportementale.
3. Procédures expérimentales utilisées
Animaux : 10 rats mâles Long Evans, maintenus dans un cycle 12h jour/nuit, ont été utilisés pour ces expériences. Ils ont été soumis à une restriction alimentaire, avec un accès à 85% de leur ration quotidienne. L’eau était accessible ad libitum.
Expérience : Mesure de la prise de décision impliquant l’évaluation d’un risque (en terme de probabilité de gain)
Les animaux sont placés dans une boîte opérante comportant trois leviers. Au démarrage de l’essai, seul le levier central est sorti, et les rats ont été entraînés à maintenir leur patte sur le levier central pendant une durée fixe de 1 seconde. 400 ms après le début de l’appui et pendant 600 ms, une combinaison de deux lumières s’allume au-dessus des leviers et indique quelle sera la probabilité d’obtenir 0.1 ml de sucrose 32% en cas de choix du levier correspondant à la récompense en grande quantité mais incertaine. Au bout de 600 ms, un signal sonore retentit, indiquant la possibilité d’aller appuyer sur le levier de gauche ou de droite, au choix, afin d’obtenir une récompense (0.05 ml de sucrose 32 % toujours délivré ou 0.1 ml sucrose 32 % délivré avec une probabilité variable et indicée, respectivement).
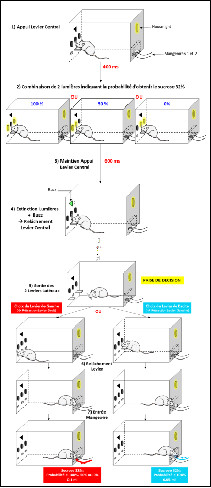
Trois combinaisons de deux lumières sont possibles, aléatoirement. Il existe trois spots lumineux situés au-dessus des leviers :
- Si la lumière de gauche et la lumière de droite s’allument, la probabilité d’obtenir 0.1 ml de sucrose 32 % en choisissant le levier de droite est de 100 %.
- Si la lumière de gauche et la lumière centrale s’allument, la probabilité d’obtenir 0.1 ml de sucrose 32 % en choisissant le levier de droite est de 50 %.
- Si la lumière de droite et la lumière centrale s’allument, la probabilité d’obtenir 0.1 ml de sucrose 32 % en choisissant le levier de droite est de 0 %.
A la fin de la seconde d’appui, le levier central se rétracte et les deux leviers latéraux sortent.
- Si l’animal choisit le levier de droite, il appuie puis peut relâcher immédiatement le levier et une dose de 0.05 ml de sucrose 32 % est délivrée dans la mangeoire dans 100 % des cas.
- Si l’animal choisit le levier de gauche, le résultat de cette action sera incertain, en fonction de la probabilité d’obtenir 0.1 ml de sucrose 32%, indiquée précédemment par la combinaison de lumière.
La condition 100% et la condition 0% permettent de vérifier la bonne compréhension de la tâche par le rat. La condition 50% permet d’évaluer le comportement à tendance risquée ou non de l’animal. Ainsi, si dans la condition où la probabilité d’obtenir la grande récompense est de 50%, le rat choisi préférentiellement le levier associé à cette grande récompense, il sera considéré comme un individu au comportement risqué et joueur.
La moitié des animaux est conditionnée avec cette règle. Pour l’autre moitié, la petite récompense est délivrée lorsque l’animal choisit le levier droit.
Chirurgie : Lésion du NST
Lorsque les animaux ont atteint un niveau de performance stable durant au moins 5 sessions consécutives, ils ont été soumis au protocole chirurgical suivant :
Tous les animaux ont été anesthésiés avec de la kétamine (50 mg/kg, i.m.) et de la médétomidine (0.26 mg/kg, i.m.) et positionnés dans un appareil de stéréotaxie.
Les rats reçoivent une injection bilatérale d’acide iboténique (9.4 µg/µl (53 mM); rats avec lésion du NST) ou de solution contrôle (tampon phosphate, 0.1 M ; rats intacts) aux coordonnées suivantes : antéropostérieur, 3.8 mm (depuis le bregma); latéral, 2.4 mm ; dorsoventral, 8.35 mm (depuis le crâne). Le volume d’injection était de 0.5 microlitres par côté injecté pendant 3 minutes avec une seringue Hamilton fixée sur une micropompe. A la fin de l’injection, les injecteurs ont été laissés en place pendant 3 min pour permettre la diffusion de l’acide iboténique.
Les animaux ont récupéré des suites de l’opération pendant une semaine avant d’être à nouveau soumis au test (dans la même tâche que celle précédent la chirurgie)
B — RÉSULTATS PRÉLIMINAIRES
près apprentissage de la tâche, les animaux ont été soumis au test de prise de décision, et le pourcentage de prise de décision risquée (évaluée par le nombre d’appui sur le levier associé à la grande récompense dans la condition où la probabilité de l’obtenir est de 50%) a été mesuré. Nous avons ainsi mesuré le pourcentage de prise de décision risquée de base chez le rat, avant lésion du NST. Nous avons pu vérifier que les performances moyennes des rats avant l’opération ne présentaient pas de différences significatives, tous les individus choisissant de manière équivalente la petite récompense certaine et la grande récompense risquée.
Les animaux ont ensuite été soumis au protocole chirurgical. Après une période de récupération, ils ont été à nouveau soumis au même test que celui précédent la chirurgie. Après lésion du NST, on observe une modification profonde du comportement des rats, qui choisissent alors préférentiellement la condition risquée (dans 80% des cas environ). Une altération du NST conduit donc à une altération de la prise de décision, favorisant un comportement impulsif et risqué. Ces résultats semblent donc indiquer que les effets secondaires cognitifs de type impulsivité et développement du jeu pathologique chez les patients traités par la SHF du NST pourraient résulter de l’inactivation du NST.
Afin d’évaluer l’influence du système dopaminergique, cible des traitements médicamenteux dans la maladie de Parkinson, dans ce processus, nous avons procédé à une injection intrapéritonéale d’un inhibiteur de recapture de dopamine, 20 minutes avant le début du test. De façon très intéressante, nous avons pu observer que ce traitement conduit, chez les rats intacts, à une très forte augmentation du nombre de prise de décision risquée, celui-ci passant de 40% à 80% environ après traitement pharmacologique aigue avec un inhibiteur de
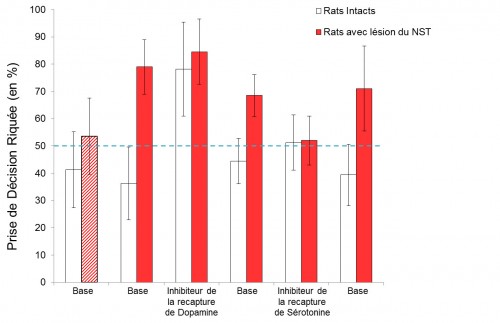
recapture de dopamine. Les rats intacts soumis à ce traitement dopaminergique présentent donc un comportement risqué similaire à celui des rats ayant subit une lésion totale du NST. Il semblerait donc que le système dopaminergique et le noyau subthalamique soient impliqués dans ce processus décisionnel.
Suite à ce traitement, les animaux ont été à nouveau soumis au test avec après avoir subit une injection de solution contrôle (sérum physiologique), afin de vérifier un retour à la normale (niveau de base) de leur performance comportementale.
Il a été mis en évidence que la SHF du NST, de même que les traitements à la L‑DOPA, induisent une diminution du taux de sérotonine, système impliqué dans l’inhibition comportementale et dans la physiopathologie de différents troubles. Afin d’évaluer le potentiel thérapeutique d’un traitement visant ce système, nous avons suivi le même protocole en utilisant cette fois un inhibiteur sélectif de recapture de la sérotonine. Il s’agit de la fluoxétine, antidépresseur couramment utilisé chez l’Homme. La fluoxétine a été administrée par injection aigue intrapéritonéale, réalisée 30 minutes avant le début du test. Nous avons pu observer que ce traitement, conduisant à une augmentation du taux de sérotonine, a pour conséquence de contrecarrer l’effet délétère de la lésion du NST sur la prise de décision : les animaux lésés présentent en effet un comportement semblable au comportement de base des animaux contrôles (c’est à dire un nombre d’appui environ équivalent entre le levier petite et grande récompense). La fluoxétine réduit donc les effets pro-impulsifs induits par l’inactivation du NST. Le système sérotoninergique pourrait donc également être impliqué dans l’altération du processus décisionnel chez les patients parkinsoniens. L’utilisation d’un inhibiteur sélectif de sérotonine, déjà couramment utilisé pour traité la dépression et d’autres troubles chez l’Homme, pourrait donc potentiellement être une perspective thérapeutique envisageable.
C — JUSTIFICATION DE L’ÉTUDE ET PERSPECTIVES
Cette étude nous a déjà permis de clarifier le rôle du NST dans les processus décisionnels chez le rat, puisque nous avons pu montrer que la perturbation de l’activité du NST par lésion de la structure, conduit à un comportement plus risqué.
Afin d’approfondir d’avantage cette étude, nous souhaiterions également étudier l’effet d’un traitement à la L‑Dopa sur cette tâche chez le rat. Ce traitement sera réalisé seul, ou en combinaison avec un antagoniste des récepteurs dopaminergiques, mimant la déplétion dopaminergique présente chez le patient parkinsonien.
Avec pour objectif de confirmer et approfondir nos recherches, nous souhaiterions vérifier la reproductibilité de ces résultats sur un nouveau groupe de rats, qui sont d’ores et déjà en cours d’apprentissage de la tâche permettant de mesurer la prise de décision.
La poursuite de ce projet nous permettrait une meilleure compréhension de l’implication du NST et des différents systèmes de neurotransmission dans les processus de prise de décision altérés chez certains patients parkinsoniens. Pouvoir anticiper et apporter une solution thérapeutique aux troubles cognitifs qui pourraient résulter du traitement chirurgical et dopaminergique chez le patient atteint de la maladie de Parkinson représente un enjeu majeur.
Lu par Jean Graveleau graveleau.jean2@orange.fr
Bilan des deux boursières soutenues par CECAP (1/2)
Publié le 27 décembre 2013 à 09:17Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Bilan de la thèse d’Elodie Mathieux : Le rejet suite à la greffe intracérébrale : étude de la réponse humorale et propriétés immunosuppressives des cellules souches.
La maladie de Parkinson est caractérisée par la dégénérescence progressive et sélective des neurones dopaminergiques de la voie nigrostriatale. La destruction des neurones dopaminergiques de la substance noire a pour conséquence une diminution de la sécrétion de dopamine au niveau du striatum.
Actuellement, il n’existe pas de traitement curatif de la maladie, mais différents traitements symptomatiques sont utilisés. L’administration par voie orale de L‑DOPA (lévodopa), précurseur de la dopamine capable de traverser la barrière hématoencéphalique, est l’un des traitements les plus couramment prescrits. Un inconvénient majeur de la prise de L‑DOPA est l’apparition, au bout de quelques années, de dyskinésies (mouvements anormaux). Une autre stratégie basée sur la stimulation électrique du noyau sous-thalamique montre une efficacité sur les troubles moteurs dans la plupart des cas, mais les risques chirurgicaux et les critères d’inclusion en font une opération accessible à un très faible nombre de patients. De plus, de nombreux symptômes ne sont pas corrigés par ces thérapies.
Aussi, il apparaît important de poursuivre les recherches sur les stratégies restauratrices, notamment la greffe intracérébrale de neuroblastes dopaminergiques fœtaux.
Des neuroblastes mésencéphaliques issus de fœtus humains (7 – 9 semaines) et transplantés dans le cerveau de patients parkinsoniens ont conduit à des améliorations cliniques basées, entre autres, sur la production de dopamine par les neurones greffés. Cependant, le recours à des cellules fœtales humaines est freiné par des considérations éthiques et logistiques qui limitent l’accès à ces greffes. Il est apparu alors nécessaire de se tourner vers d’autres sources cellulaires et notamment les cellules d’origine porcine.
En effet, le porc présente de nombreux avantages pour la xénotransplantation : un grand nombre d’embryons à chaque portée, une facilité d’élevage, la possibilité de contrôler la reproduction des animaux et de pouvoir pratiquer des manipulations génétiques. De plus, les neuroblastes issus de fœtus porcins émettent des neurites de longueurs similaires à celles observées chez l’Homme. Une survie des cellules greffées, une réinnervation du striatum ainsi qu’une récupération des fonctions motrices ont été observées lors d’essais cliniques menés chez certains patients parkinsoniens traités par des immunosuppresseurs (molécules permettant de limiter l’activité du système immunitaire). Mais le problème rencontré reste le rejet de ces greffes.
En effet, en l’absence d’immunosuppresseur comme la cyclosporine A, les greffes de neuroblastes porcins dans le striatum de rat sont systématiquement rejetées au bout de 7 – 8 semaines. Les traitements par des immunosuppresseurs prolongent la survie de la greffe, mais de manière transitoire. De plus, utilisés à fortes doses, ceux-ci entraînent des effets secondaires, notamment une toxicité rénale. Il est donc important de comprendre et d’étudier les mécanismes en cause dans le rejet pour envisager une survie à long terme de la greffe.
Diverses études ont mis en évidence un rôle important de la réponse immunitaire cellulaire dans le rejet. En effet, en l’absence d’immunosuppresseur, on observe vers 7 à 8 semaines une forte infiltration de la greffe par des lymphocytes T, des cellules dendritiques et des cellules microgliales activées.
Outre la réponse cellulaire, il a été observé un dépôt d’anticorps et de complément au niveau du greffon. Cette observation suggère une réponse humorale caractérisée par la production d’anticorps dirigés contre la greffe, qui, à ce jour, a été très peu étudiée.
Une partie de mon travail de thèse au sein de l’INSERM U1064 de Nantes a eu pour but de caractériser le rôle de la réponse humorale dans le rejet des xénogreffes intracérébrales.
Evolution de la production d’anticorps au cours des différents stades du rejet.
Les anticorps produits suite à la greffe vont venir se fixer sur les cellules porcines du greffon et le détruire. Nous avons pu mettre en évidence que la production d’anticorps augmentait en fonction du délai post greffe et du statut de la greffe. En particulier, une forte concentration d’anticorps est observée dans le sérum de rats pour lesquels la greffe est rejetée. Les anticorps accompagnés d’une activation du complément seraient cependant, en premier lieu, attirés au sein de la greffe avant d’être détectés dans le sérum.
Evolution de la production d’anticorps au cours des différents stades du rejet.
Les anticorps vont préférentiellement venir se fixer sur les neurones et en moindre mesure sur les astrocytes. De plus, la survie des greffes de cellules mésencéphaliques porcines est augmentée chez des rats ne possédant plus d’anticorps. Ces résultats suggèrent un rôle important de la réponse humorale dans le rejet des xénogreffes intracérébrales.
Afin de limiter le rejet des greffes intracérébrales, une autre partie de mon travail a été d’étudier les propriétés immunosuppressives des cellules souches et en particulier des cellules souches neurales (CSN). Les CSN sont des cellules multipotentes capables d’auto-renouvellement et de prolifération. Elles peuvent générer les trois types cellulaires principaux du système nerveux central que sont les neurones, les astrocytes et les oligodendrocytes. Les CSN vont pouvoir être cultivées sous forme de neurosphères.
Cellules souches neurales de rat sous forme de neurosphères.
Nous avons pu démontrer que les CSN de rat inhibaient la prolifération des cellules T de rat de manière dose dépendante. Les CSN agissent alors par l’intermédiaire de facteurs solubles dont l’hème oxygénase.
Inhibition de la prolifération des cellules T de rat par les cellules souches neurales de rat de manière dose dépendante.
Les CSN possèdent donc des propriétés immunosuppressives qui permettraient de limiter le rejet lors de greffes intracérébrales tout en diminuant l’utilisation d’immunosuppresseurs systémiques.
L’ensemble des résultats de ma thèse ouvre des nouvelles perspectives pour parvenir à contrôler le rejet de xénogreffes intracérébrales. En l’occurrence, on pourrait espérer qu’une immunosuppression locale, basée sur la transplantation de cellules souches associées à une administration systémique d’immunosuppresseurs ciblant les réponses humorales et cellulaires, soit suffisamment efficace pour assurer la survie à long terme de cellules neurales xénogéniques dans un cerveau.
Je tenais à remercier tous les membres de l’association CECAP pour leur soutien tout au long de ma thèse.
Rédigé par Elodie Mathieux
Cure de nicotine contre la maladie de Parkinson
Publié le 20 décembre 2013 à 07:42Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
Article paru dans Sud-ouest Dimanche du 10 novembre 2013
Isabelle Castillon part en croisade pour défendre la nicotinothérapie.
Isabelle Castillon vit à Bayonne. Atteinte depuis 1987, elle participe au protocole unique de nicotinothérapie en France. Et ça va mieux ! La maladie de Parkinson a eu tort de s’en prendre à Isabelle Castillon. Elle est tombée sur un os. Car cette enseignante, installée à Bayonne, n’est pas du genre à se laisser attraper sans broncher. À 64 ans, elle participe en tant que patiente à un protocole thérapeutique unique en France. Totalement alternatif, révolutionnaire, archicontroversé, puisqu’il fait appel à la nicotine. Un mot est né de cette initiative médicale : nicotinothérapie.
Retour en 1987. Isabelle se souvient : « Je me dédouble, je m’entends parler, avec un écho, parfois je me mets à trembler. Je ne dors plus. En consultation, je vois un neurologue, il me prescrit un anxiolytique. Mais en 1992, je plonge. Trois semaines sans pratiquement dormir. Je suis hospitalisée pour dépression pendant un mois et j’en sors toujours aussi mal. Mes problèmes physiques se multiplient. C’est un neurologue que je croise qui va me diagnostiquer : Parkinson. »
Panique et soulagement. Isabelle sait ce qu’elle a ; elle est désormais prise en charge et traitée à la L‑dopa. « Je découvre ce que signifie l’expression lune de miel. La L‑dopa dope… pendant dix ans en moyenne », poursuit-elle. Puis, Isabelle Castillon la battante, toujours prof, est rattrapée par les symptômes de Parkinson qui se bousculent. « Mon écriture se rétrécit, je marche de plus en plus lentement, des difficultés d’élocution, tremblements, dyskinésie (mouvements involontaires). J’ai peur de sortir, je me renferme. J’ai honte qu’on me juge, car on me juge. Je prends des renseignements partout, pour aller mieux. »
Quatre ans de patience :
Parkinson est une maladie neurodégénérative, Isabelle sait qu’il faudra accepter la dégringolade. Elle se rebelle. « Un jour, en 2000, je découvre un reportage sur CNN. Il est question de nicotine dans le traitement de Parkinson. Je note le nom du médecin : Gabriel Villafane, de l’hôpital Henri-Mondor à Créteil (94). Je vais batailler des mois pour obtenir un rendez-vous. La débrouille et le bouche-à-oreille. Je débarque à Mondor avec mon dossier médical, mais il faudra encore quatre ans de patience avant d’obtenir mes premiers patchs de nicotine pure. » DAT-Scan, un scanner qui date les courts-circuits du cerveau générés par la maladie, examens du cœur, tension, sang. Le corps et le cerveau d’Isabelle sont passés au crible. En 2009, elle obtient enfin la première série de patchs.
« Il faut le positionner en bas de la colonne, dans le dos. La nicotine diffuse alors jusqu’au cerveau », précise la patiente. Les effets positifs du traitement se font sentir au bout de quelques semaines. La maladie ne disparaît pas, mais les symptômes régressent. Isabelle demeure sous L‑dopa, bien entendu. « J’ai recommencé à marcher, je ne tremble plus, la dyskinésie a pratiquement disparu, je suis plus active, le moral revient. Je vois des gens, je sors et, surtout, je me moque éperdument du regard des autres. La joie de vivre à nouveau… Aujourd’hui, je m’occupe de mes petits-enfants, je chante. Sans la nicotine pure, je serais à ce jour en fauteuil roulant. J’ai diminué de moitié la dose de mes médicaments. Ce fut un parcours du combattant, et aujourd’hui encore, je me heurte à l’incrédulité de mes médecins, des neurologues, des pharmaciens. Je suis considérée comme une malade récalcitrante. »
Thérapie ostracisante :
Des médecins l’accusent de s’adonner à une thérapie « ostracisante » parce que les patchs ne sont pas remboursés par la Sécurité sociale. « Que font les autres, ceux qui ne peuvent pas payer ? » entend-elle. Les pharmaciens lui font la morale. Certains lui ont même asséné : « À ce prix, mieux vaut reprendre les cigarettes, c’est moins cher ! » En effet, deux boîtes de patchs par mois reviennent à 80 euros (1). Pas à la portée de toutes les bourses…
D’un autre côté, les réseaux sociaux bouillonnent, les malades de Parkinson cherchent des solutions pour aller mieux, ils veulent tout tenter, s’intéressent de près aux travaux de recherche. Alors, Isabelle Castillon est partie en croisade, elle mesure que tout le monde n’a pas son tempérament têtu. « Si je me fais connaître, c’est pour qu’un réseau défendant la nicotinothérapie se monte. Je sais que tous les patients ne peuvent pas être traités, parce que le traitement répond à des critères exigeants. Il n’est pas sans risque s’il est prescrit n’importe comment. Il faut savamment doser le taux de nicotine. » Les patients suivis à l’hôpital Mondor de Paris sont en train de se fédérer pour monter un collectif pro-nicotinothérapie. Et inciter le réveil des pouvoirs publics qui, enfin, cautionneront le médicament.
(1) À ce jour, les patchs de nicotine sont remboursés à hauteur de 50 euros par an.
Interview de Gabriel Villafane, neurologue à l’hôpital Henri-Mondor de Créteil
C’est lui qui a mis au jour ce traitement alternatif de la maladie de Parkinson. Neurologue au sein de l’hôpital Henri-Mondor à Créteil, Gabriel Villafane a, en 1999, avec son chef de service, le professeur Pierre Cesaro, déposé une demande de brevet sous cette appellation : « Utilisation de la nicotine à l’état pur comme médicament pour les maladies neurodégénératives, notamment la maladie de Parkinson… »
Sud-ouest Dimanche : Comment avez-vous pensé à utiliser la nicotine pure ?
Gabriel Villafane : J’ai observé des malades, notamment psychiatriques, placés sous neuroleptiques qui devenaient accros à la cigarette. Alors qu’ils étaient atones, lorsqu’ils fumaient, ils retrouvaient une énergie, le temps de la cigarette. J’ai fait le lien : la nicotine. Nous avons déposé un brevet en1999, au nom de l’Assistance publique. Il est protégé durant vingt ans. En 2009, la validité scientifique du brevet a été validée.
S‑O : Combien de patients avez-vous suivis avec ce traitement ?
G. V. : À ce jour, plus de 1 000 personnes. Le plus ancien est sous nicotine pure transdermale (NEP) depuis douze ans. Il va bien. Le premier protocole a permis à six patients de tenter cette aventure. En 2004, face à une arrivée massive de demandes de patients, nous avons été débordés. Il a fallu créer un second protocole, intitulé « protocole compassionnel ». Nous assurons le diagnostic, les examens, la prescription, mais les patients doivent payer la NEP, pas remboursée.
S‑O : Pourquoi cette thérapie alternative, alors qu’elle semble porter ses fruits, tarde-t-elle à trouver plus d’écho ?
G. V. : D’abord, elle n’est pas politiquement correcte. Le message autour de la nicotine est complexe. D’un côté, on connaît les dégâts du tabac, de l’autre, on veut faire entendre que la nicotine peut être un médicament… Il ne s’agit pas de fumer, la cigarette est un danger. La nicotine à l’état pur n’est pas dangereuse. Elle est un neuro-modulateur des neurones du système nerveux central. Un neurotransmetteur qui intervient au niveau de la synapse neuronale, des récepteurs de la dopamine dans le cas de Parkinson. Les observations cliniques et d’imagerie (DAT-Scan) montrent un ralentissement de la maladie. Alors, pourquoi ce blocage ?
Aujourd’hui, on soigne Parkinson avec des traitements chimiques et chirurgicaux. En dehors de la NEP, aucun traitement n’agit aussi bien sur l’évolution de la maladie. À ce jour, nous n’arrivons pas à obtenir une autorisation de mise sur le marché (AMM) des patchs nicotiniques, qui sont conçus pour un usage transitoire et seulement à vocation de sevrage tabagique. Du coup, les parkinsoniens que nous traitons sont quasi clandestins… Aux États-Unis, en Allemagne, les publications sur les vertus de la nicotine dans le traitement de Parkinson affluent. Ils vont nous doubler et déposer des brevets de patchs nicotiniques pour Parkinson avant nous.
Trop de lenteurs administratives, de peurs.
Recueilli par Isabelle Castera i.castera@sudouest.fr
Transmis par Dominique Bonne dominique.bonne@gmail.com
Éditorial
Publié le 19 décembre 2013 à 07:49Article paru dans LE PARKINSONIEN INDÉPENDANT n°55
La nicotinothérapie :
Nous nous sommes engagés dans une action pour faire reconnaître et diffuser la Nicotinothérapie. En effet, nous en avions parlé dans le précédent numéro, cette pratique thérapeutique est en œuvre depuis plus de dix ans (cf. le numéro 3 du P. I. de mars 2001) et elle apporte de réels progrès pour les « rares élus » qui en bénéficient. Malheureusement elle demeure très discrète, voire clandestine, et pratiquée dans un seul lieu sous la direction du docteur Villafane au CHU Henri Mondor à Créteil.
Pourquoi cette absence de diffusion ? C’est toute la question que nous nous posons : pourquoi une pratique thérapeutique, dont les résultats semblent permettre de réduire considérablement la consommation médicamenteuse, ne bénéficie-t-elle pas d’une AMM (Autorisation de Mise sur le Marché) pour les patchs de nicotine ?
A cela plusieurs réponses et pistes de réflexions : « Tout d’abord, elle n’est pas politiquement correcte. Le message autour de la nicotine est complexe. D’un côté, on connaît les dégâts du tabac, de l’autre, on veut faire entendre que la nicotine peut être un médicament… Il ne s’agit pas de fumer, la cigarette est un danger. La nicotine à l’état pur n’est pas dangereuse. Elle est un neuro-modulateur des neurones du système nerveux central. Un neurotransmetteur qui intervient au niveau de la synapse neuronale, des récepteurs de la dopamine », explique le docteur Villafane dans une interview au journal Sud-ouest.
Mais peut-être y a‑t-il une réponse plus prosaïque : les intérêts financiers en jeu tant des laboratoires pharmaceutiques que des équipes chirurgicales engagées dans la Neurostimulation Cérébrale Profonde (NCP) ? C’est en toute connaissance des conséquences de nos propos que nous évoquons cette interrogation : il y va d’économie substantielle pour les régimes d’assurance médicale !
Certes, tous les patients ne sont pas concernés par cette pratique mais, pour les malades susceptibles d’en bénéficier, il s’agit là d’une thérapie non agressive qui réduit les risques de dyskinésies bien connues liées à la L‑dopa.
Le bilan du fond de Recherche CECAP :
Nos deux boursières de cette année nous présentent leur bilan certes un peu ardu à la lecture mais ô combien optimiste pour l’avenir des recherches sur la maladie ! Vos dons permettent des avancées modestes certes mais importantes pour la connaissance de notre partenaire imposé&nbnsp;: Parkinson.
Témoignage :
Et puis, un témoignage bouleversant que nous avons voulu vous présenter pour dire à nos accompagnants, quand nous en avons ( !), combien leur rôle est important pour nous les patients et mérite d’être valorisé y compris par les Pouvoirs Publics car ils représentent une économie, là aussi, substantielle pour la collectivité !
Permettez-moi, enfin, de vous souhaiter tous mes vœux de bonheur et de santé pour cette nouvelle année 2014 !
Jean GRAVELEAU graveleau.jean2@orange.fr
56 — association de parkinsoniens du Morbihan
Publié le 26 novembre 2013 à 07:35Article paru dans LE PARKINSONIEN INDÉPENDANT n°54
Pour clôturer le deuxième trimestre :
10 Juin, la Conférence de Territoire n°3, nous invitait à débattre sur la méthodologie de mise en œuvre des actions du Plan Territorial de Santé (PTS) sur la thématique « Handicap ».
17 Juin, réunion avec le groupe de travail de l’ARS de Rennes, sur la « Bientraitance et la lutte contre la maltraitance » dans les services et établissements sociaux et médico-sociaux.
18 juin, réunion au Centre Socioculturel de Ménimur pour faire le point sur les échanges avec la direction et les Associations, et prévoir les activités pour l’année 2013/2014.
Début juillet, nous assistons à la présentation de la plate-forme d’information et de coordination du Territoire Gérontologique Vannetais au niveau départemental pour 2011/2015.
Le temps des vacances s’achève, il faut penser à reprendre nos activités. Déjà deux rencontres prévues fin Août, une avec la municipalité pour la mise en place du Forum des Associations qui aura lieu le 7 Septembre, l’autre avec le Centre Socioculturel de Ménimur pour la journée « porte ouverte » du 11 Septembre.
Plusieurs interventions prévues en septembre et octobre durant la Semaine Bleue.
Début octobre, nous assisterons aux Assemblées Générales AGP & CECAP dans la Manche.
Françoise Vignon,
secrétaire ADPM
35 — association de parkinsoniens d’Ille et Vilaine
Publié le 23 novembre 2013 à 09:46Article paru dans LE PARKINSONIEN INDÉPENDANT n°54
Tout d’abord, quelques nouvelles du périple de notre Président.
Après 62 jours de marche du 26 mars au 28 mai, après avoir parcouru 1 700 km à raison de 27 km en moyenne journalière, effectué 2 400 000 pas, Yves nous est revenu de Compostelle.
Son périple a été salué par plus de 8 000 internautes et son action aura rapporté près de 8 500 euros pour la Recherche, dont une partie pour CECAP Recherche et une partie pour l’INCR (Institut des Neurosciences Cliniques de Rennes) du Professeur Vérin et chercheurs associés.
Par cette action, Yves a surtout voulu démontrer que la marche était une excellente thérapie.
Il remercie celles et ceux qui lui ont apporté du soutien.
Sortie annuelle : Avant de vous donner des nouvelles de notre activité, il est agréable de conter notre sortie annuelle. Celle-ci a eu lieu à Saint Coulomb, commune voisine de Saint-Malo en Ille-et-Vilaine. Les mérites de cette organisation reviennent à François, Bernard, Arlette, Bernadette. Nous avions programmé la visite d’une Malouinière.
Il s’agit d’une maison de maître créée au XVIIIe siècle par un riche armateur de la Compagnie des Indes. Ces riches négociants ont bâti à l’époque de Louis XIV ces hôtels particuliers et résidences nommées Malouinières, une centaine dans la région de Saint-Malo.
L’histoire nous dit que ces armateurs étaient aussi riches que Louis XIV, car l’aventure maritime enrichissait les corsaires, les prises étant partagées entre le Roi Soleil, l’armateur et l’équipage.
Et quant on est aussi riche que le roi, on s’expose à des récriminations, ce qui adviendra pendant la Révolution où, si les biens immobiliers résistèrent, le mobilier fut disséminé.
La Malouinière fut restaurée au siècle dernier et les propriétaires mirent l’essentiel de leur fortune dans la rénovation de la maison de maître, son pigeonnier, sa chapelle, ses jardins, et surtout par l’acquisition de plusieurs centaines de pièces de vaisselle d’époque ainsi qu’un papier peint panoramique du XVIIIe siècle qui demanda trois années de travail de rénovation.
La journée se termina après un excellent repas pris en bord de mer.
Nos activités perdurent, chaque mois nous effectuons nos journées rencontres dans chaque territoire de notre département, nous présentons la MP dans les écoles de santé, et participons à des forums de santé.
Le dernier en date a eu lieu dans le pays de Brocéliande, à l’initiative de Bernard et de François et réuni plus de cinquante participants.
Bernard MARCHAND, vice-président.
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.