Économiser l’énergie, oui mais…
Publié le 20 juillet 2011 à 11:10Article paru dans LE PARKINSONIEN INDÉPENDANT n°45 – juillet 2011
Pas au détriment de la santé. Le rayonnement électromagnétique qu’émettent les ampoules basse consommation (ou fluocompactes) qui remplaceront définitivement d’ici 2012 les ampoules à incandescence, serait très élevé dans certaines conditions d’utilisation (à l’allumage, à proximité de l’ampoule notamment) et susceptible de perturber l’ organisme, selon le CRIIREM (Centre de recherche & d’information indépendantes sur les rayonnements électromagnétiques). Pierre Le Ruz, Président du CRIIREM, appelle à la vigilance et vous conseille :
À ne pas faire :
- Equiper un lampadaire de bureau ou de chevet avec ce type d’ampoule
- Placer les ampoules basse consommation à moins d’un mètre des utilisateurs ; surtout en cas de risque d’interférence avec des dispositifs d’assistance médicale (pacemaker, pompe à médicaments, appareil auditif …)
Mise en garde :
Ces ampoules contiennent (certes en petite quantité) du mercure, connu pour ses effets neurotoxiques. L’étude réalisée par l’association Santé environnement France, démontre qu’entre le mercure libéré dès le bris de l’ampoule et la partie restant contre les parois qui ne dégaze pas intégralement au même moment, il s’écoule 1 heure. Aussi :
- Ouvrez une fenêtre et aérez au moins une heure
- Essayez de ramasser le verre et la poudre de mercure avec un morceau de papier ou de carton. Pas à mains nues !
- Utiliser du papier collant pour récolter les petits éclats de verre et le reste de la poudre. Un petit chiffon humide vous permettra de terminer le nettoyage. A chaque fois mettre les débris de l’ampoule dans un bocal en verre avec un couvercle.
- Il est absolument déconseillé d’utiliser un aspirateur ou une brosse pour éliminer les débris de l’ampoule : la poudre de mercure serait en effet envoyée dans l’air ambiant que vous allez respirer.
- Amenez les déchets récoltés au parc à conteneurs, ainsi que vos ampoules usagées
Vous pouvez joindre le CRIIREM au 19 – 21, rue Thalès-le-Milet ‑72000 LE MANS
Tél. 02 43 21 18 69
mail : contact@criirem.org.
Informations relevées dans Pleine Vie Octobre 2010 & Test-Achats par Soize VIGNON
Troubles affectifs dans la maladie de Parkinson
Publié le 19 juillet 2011 à 22:11Article paru dans LE PARKINSONIEN INDÉPENDANT n°45 – juillet 2011
Actuellement, il est classique de décrire la maladie de Parkinson idiopathique comme l’association de signes moteurs et de signes non moteurs. Si les signes moteurs sont bien connus, lenteur d’initiation et d’exécution des mouvements, rigidité musculaire et tremblement asymétrique ; les signes non-moteurs commencent à être mieux pris en compte, au premier rang desquels se trouvent associés à des signes digestifs, urinaires, des signes neuropsychiques comprenant des phases dépressives majeures, mineures, des moments d’anxiété, des troubles de la personnalité, des hallucinations visuelles, parfois des troubles du sommeil ou l’apathie fréquemment rencontrée.
Le programme conçu par la Clinique de l’Humeur de l’hôpital de Quimperlé pour les patients présentant une maladie de Parkinson idiopathique pose l’hypothèse d’une relation entre les signes non-moteurs et les signes moteurs avec un double objectif :
- Premièrement d’améliorer voir de prévenir des signes non-moteurs de type neuropsychiques en particulier l’anxiété, la dépression parfois l’apathie,
- Deuxièmement de pouvoir proposer à partir de ce travail psychique un traitement physique améliorant l’efficience des séquences motrices en complément de la pharmacologie.
Ce programme se déroule les jeudis en 2 séances sur une période de 8 semaines. La première séance comprend un atelier dit de Pratique Corporelle Constructiviste.
A partir d’une redécouverte de l’espace corporel, l’espace péricorporel est investi par des séquences de mouvements sans exercer sa force, souples et rythmés par l’inspiration et l’expiration. Ces mouvements ne se font pas contre résistance de façon à pouvoir être enchainés, fluides : un premier mouvement est découvert, puis un second, puis un troisième et ensuite l’ensemble de ces trois mouvements sont enchaînés sans pause. Ils sont réalisés dans un rythme proposé par les deux temps de la respiration : l’inspiration et l’expiration.
En effet la deuxième séance proposée de mindfulness, c’est-à-dire de pleine conscience, permet d’apprendre aux sujets la méditation centrée sur la respiration et la possibilité de mobiliser par un acte volontaire toute son attention dans l’instant présent. Cette possibilité de mobiliser toute son attention dans l’instant présent permet l’amélioration de l’acte moteur et pour certains patients, comme l’expérience a pu nous le démontrer, la possibilité même d’un déblocage.
Ces deux séances sont aussi l’occasion de discuter avec les thérapeutes comprenant un infirmier psychiatrique, un psychomotricien, un psychiatre et un psycho-gériatre, de nombreux échanges sur la physiopathologie, sur la gestion des émotions, sur la compréhension des signes cliniques et en particulier sur l’apathie, syndrome gênant qui ne permet pas au sujet de débuter un acte moteur complexe dirigé vers un but.
La possibilité pour le sujet de se positionner en pleine conscience (mindfulness) lui permet de mobiliser toutes ses capacités attentionnelles pour exploiter ses capacités motrices du moment au mieux, en particulier dans des actes moteurs complexes et dirigés par un but.
Ce premier groupe de 5 patients, les aidants naturels étant conviés aux séances de mindfulness, a permis de mettre en évidence l’ensemble des bénéfices de cette approche, bénéfices moteurs puisque certains ont diminué leur traitement pharmacologique et bénéfices psychologiques, non seulement sur la possibilité nouvelle de mieux s’investir dans un certain nombre d’activités, mais aussi de pouvoir s’inscrire dans une démarche de bien-être avec, ou malgré, la maladie de Parkinson idiopathique.
C’est donc un message plein d’espoir qui nous porte à proposer le développement de ce programme avec les aidants, et les associations de familles et de patients.
Quimperlé, le 20 août 2009
Docteur B. PLACINES, Joël ROULLEAUX, Gwénola MELAINE, Brigitte CONAN
Pierre VIGIER, Céline VIGIER, Armelle CORDIER, Docteur T. BONVALOT
Traitement de la maladie de Parkinson
Publié le 11 juillet 2011 à 09:53Article paru dans LE PARKINSONIEN INDÉPENDANT n°45 – juillet 2011
Pour être pleinement informé et comprendre les traitements médicamenteux, la « Revue Prescrire » a constitué un dossier très complet que l’on peut consulter sur Internet : http://www.prescrire.org/fr/Search.aspx en indiquant : « maladie de parkinson ».
Mars 22011 N°329 (pages 200 à 205) :
Première partie : « d’abord une monothérapie par lévodopa ou agoniste dopaminergique ». Cette partie présente l’évaluation du traitement médicamenteux initial et des troubles moteurs de la maladie.
Avril 2011 N°330 (pages 273 à 279) :
Deuxième partie : « réduire les fluctuations motrices sous lévodopa ».
Dans la deuxième partie, sont abordés les traitements médicamenteux et chirurgicaux des troubles moteurs à un stade avancé de la maladie.
Dans un prochain numéro sera abordé le traitement des troubles psychiques dont souffrent parfois les personnes atteintes de la maladie de Parkinson.
Signalé par Jean GRAVELEAU
L’actualité sur les agonistes dopaminergique
Publié le 08 juillet 2011 à 07:33Article paru dans LE PARKINSONIEN INDÉPENDANT n°45 – juillet 2011
par le professeur POLLAK, Chef du service de Neurologie des Hôpitaux Universitaires de Genève
d’une classe de médicaments efficaces.
SACHONS LES MAITRISER.
Si vous avez des comportements anormaux ou inhabituels,
il faut absolument en référer au médecin traitant, immédiatement.
Les médias reparlent de procès futurs à propos des effets comportementaux délétères de certains médicaments, en particulier le jeu pathologique qui a ruiné certains patients. Ces patients accusent le laboratoire d’avoir mentionné trop tardivement cet effet indésirable dans le RCP (le résumé des caractéristiques du produit) qui accompagne toutes les boîtes de conditionnement de médicaments.
Le rôle des médicaments
Il est exact que le Requip® (ropinirole), ainsi que les autres médicaments de la même classe, les agonistes dopaminergiques (pramipexole – Sifrol®; piribédil – Trivastal®; pergolide – Célance®; bromocriptine – Parlodel®, Bromokin®; rotigotine — Neupro® …), et, à un moindre degré, la L‑dopa elle-même et l’amantadine (Mantadix®), modifient le comportement et, bien sûr, la fonction motrice.
C’est bien pour cela qu’ils sont prescrits. Mais, comme toute substance active, ils peuvent entraîner des effets indésirables, en particulier les effets liés à un excès d’activité, dû à une dose trop élevée. Il s’agit de troubles comportementaux hyperdopaminergiques, dont nous avons déjà parlé dans la revue1. On peut les rappeler brièvement : hyperactivité, allant parfois jusqu’à des activités compulsives inutiles, même la nuit, addictions alimentaires de type grignotage, augmentation de la créativité, notamment artistique selon les dons de chacun, achats excessifs, état euphorique allant jusqu’à un état maniaque, hallucinations, psychose, comportements hypersexuels parfois déviants – et surtout nouveaux pour le patient (rupture dans l’appétit sexuel et les pratiques, changement de la personnalité), jeu pathologique.
Si certains de ces effets sont perçus très favorablement, comme la diminution de l’anxiété, de l’apathie, l’augmentation de l’activité et de la créativité, d’autres sont redoutables : jeu pathologique et comportement hypersexuel, à cause de leur impact dans la vie personnelle, familiale et sociale des patients.
Au maximum, il s’agit du syndrome de dysrégulation dopaminergique qui inclut en plus d’un trouble du contrôle des impulsions, une addiction à la L‑dopa – le patient dépassant les doses prescrites, son comportement étant constamment tourné vers la recherche des médicaments (craving en anglais).
Il est vrai que l’on sait depuis quelques années que les agonistes dopaminergiques possèdent ces effets mais ils n’étaient rapportés qu’exceptionnellement dans la littérature médicale et de ce fait non signalés aux patients. Il est, en effet, d’usage que les médecins n’exposent aux patients que les effets indésirables fréquents, de façon à anticiper une conduite à tenir c’est-à-dire la prise des mesures adéquates pour les éviter ou les contrôler. Lors d’une consultation, il est non seulement impossible au plan pratique de mentionner l’ensemble des effets survenant exceptionnellement, mais cela serait contre-productif, en affolant inutilement l’immense majorité des patients prenant ce médicament.
Néanmoins, depuis environ 5 ans, dans la littérature médicale et lors des congrès scientifiques il y a eu une multiplication des rapports de cas de patients ayant développé ces troubles du comportement de façon sévère. Les études les plus récentes avancent la proportion d’environ 15% des patients sous médicaments dopaminergiques avec troubles du contrôle des impulsions, dont 5% avec jeu pathologique. Ainsi, l’ensemble du corps médical n’en a pris conscience que récemment.
Le rôle du terrain : quel est le rôle de la maladie dans l’apparition de ces effets ?
On ne sait précisément pas pourquoi certains sujets et non d’autres développent un ou plusieurs troubles comportementaux dopaminergiques. Si l’on fait un parallèle avec les troubles moteurs, on sait que les médicaments dopaminergiques notamment la L‑dopa, peuvent provoquer des dyskinésies d’autant plus facilement que l’akinésie parkinsonienne est sévère. Est-ce que les troubles comportementaux surviennent plus facilement chez les patients dont la maladie de Parkinson s’accompagne d’une apathie, d’une dépression, d’une anxiété sévères ? Des recherches sont en cours pour répondre à cette question, certains arguments vont dans ce sens.
Les hallucinations et la psychose, les sensations de perception anormales, peuvent subvenir sans médicament dopaminergique. C’est le cas en particulier des formes avancées de maladie de Parkinson chez le sujet âgé lorsqu’il existe un déclin cognitif. De même, un petit pourcentage de la population est joueur pathologique ou présente des déviances sexuelles sans qu’ils n’aient pris des médicaments dopaminergiques. Quels sont les facteurs associés à ces comportements, notamment d’ordre génétique ? Ces sujets sont-ils plus à risque d’aggraver de tels symptômes s’ils prennent des agonistes dopaminergiques même à faible dose ? Cela aussi est un sujet de recherche.
Les facteurs déjà reconnus faisant qu’un patient est plus à risque de développer un trouble du contrôle des impulsions sous agonistes dopaminergiques sont les suivants : sexe masculin, âge jeune et début de la maladie de Parkinson à un jeune âge, antécédents de troubles du contrôle des impulsions avant la maladie de parkinson, antécédents personnels ou familiaux d’addiction (toxicomanie), de dépression ou troubles bipolaires et traits de personnalité caractérisés par une haute impulsivité et la recherche de nouveautés.
Quels conseils donner à tous les patients parkinsoniens qui prennent des médicaments ?
Il s’agit de prescrire ces médicaments de façon à maximiser le bénéfice – amélioration de la motricité, diminution de l’apathie et de l’anxiété, diminution des impatiences motrices des membres inférieurs… – et à minimiser les effets indésirables, notamment psycho-comportementaux.
Le rôle des soignants est donc d’évaluer très précisément ces effets. Le rôle du patient et de l’entourage devient alors capital car ce sont eux qui renseignent le mieux sur le début d’une modification d’un comportement en référence à la personnalité antérieure du patient.
Les doses et les types de médicaments seront ajustés pour réaliser l’objectif de la poursuite au long cours d’une vie la plus proche possible de ce qu’elle était avant l’apparition de la maladie y compris au plan affectif et comportemental.
4 conseils fondamentaux
- L‑Dopa et agonistes dopaminergiques ont une efficacité prouvée sur l’état moteur du parkinsonien.
- Néanmoins, à doses excessives, chez certains patients, les agonistes dopaminergiques et, dans une moindre mesure, la L‑Dopa, peuvent entraîner des troubles comportementaux redoutables : compulsions d’achat, addiction au jeu, hypersexualité…mettant en danger la vie personnelle et familiale du patient.
- Si vous ou votre entourage remarquez un changement de votre comportement, voire de votre personnalité, signalez-le immédiatement à votre médecin traitant. Ne laissez pas s’installer un déséquilibre dans votre vie. Un ajustement de dose est nécessaire.
- Attention, toute modification de traitement ne peut se faire que sur avis médical.
La maladie de Parkinson n’a jamais été aussi bien traitée, et cela essentiellement grâce aux médicaments. Avant les traitements dopaminergiques, le handicap du patient parkinsonien était considérable, le recours au fauteuil roulant fréquent après peu d’années et l’espérance de vie était fortement abrégée. Aujourd’hui, la majorité des patients parkinsoniens vivent avec peu de gêne pendant de nombreuses années, une incapacité sévère ne survient que chez certains patients surtout à un âge avancé, et l’espérance de vie n’est que légèrement inférieure à celle de la population générale.
Un patient ne doit pas arrêter son traitement sans avis médical.
Il est en effet rapporté des risques importants lors de cas de sevrage brutal de traitement antiparkinsonien, par exemple en cas d’hospitalisation pour d’autres motifs que la maladie de Parkinson. Ce sevrage peut entraîner une crise d’hyperparkinsonisme avec akinésie et rigidité sévères (les enzymes musculaires augmentent dans le sang et des molécules d’origine musculaire peuvent bloquer les reins), élévation de la température, trouble de conscience et troubles végétatifs avec hypersudation, altérations respiratoires et cardio-vasculaires pouvant mettre la vie en danger. Tout parkinsonien traité depuis longtemps doit absolument continuer à prendre une dose minimale journalière de 300 mg de L‑dopa. Le sevrage dopaminergique peut, au bout de quelques semaines, provoquer un handicap sévère et irréversible, voire entraîner la mort.
Lu et repris par Pierre LEMAY
DOPAMINE ou pourquoi la musique fait du bien…
Publié le 07 juillet 2011 à 11:09Article paru dans LE PARKINSONIEN INDÉPENDANT n°45 – juillet 2011
Actualité publiée le 25-01-2011 dans Nature Neuroscience
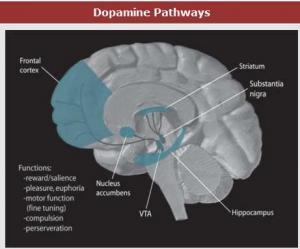 La musique joue un rôle essentiel dans nos sociétés, mais pourquoi ? La musique n’est pas nécessaire à notre survie et n’a pas d’effet direct sur notre système nerveux central, comme des substances psycho-actives par exemple. Cette recherche, menée par des chercheurs de l’Université McGill et publiée dans l’édition en ligne du 9 janvier de la revue Nature Neuroscience a étudié les effets de l’écoute de la musique sur le cerveau et le système nerveux. Notre musique préférée provoquerait ainsi des effets mesurables et comparables à ceux d’un met apprécié voire de certaines drogues, comme la cocaïne.
La musique joue un rôle essentiel dans nos sociétés, mais pourquoi ? La musique n’est pas nécessaire à notre survie et n’a pas d’effet direct sur notre système nerveux central, comme des substances psycho-actives par exemple. Cette recherche, menée par des chercheurs de l’Université McGill et publiée dans l’édition en ligne du 9 janvier de la revue Nature Neuroscience a étudié les effets de l’écoute de la musique sur le cerveau et le système nerveux. Notre musique préférée provoquerait ainsi des effets mesurables et comparables à ceux d’un met apprécié voire de certaines drogues, comme la cocaïne.
Cette étude a analysé les scanners du cerveau de 8 jeunes volontaires qui ont écouté leurs morceaux de musique préférés au point de leur donner le « frisson musical », ainsi que d’autres morceaux qu’ils ne trouvaient pas aussi agréables. Les chercheurs ont constaté que leurs cerveaux libèrent plus de dopamine quand ils écoutent la musique qui leur procure un plaisir intense. Les chercheurs suggèrent que l’expérience humaine de plaisir en réponse à des stimuli tels que la nourriture, les substances psycho-actives ou même l’argent est liée à la libération de dopamine dans la partie du cerveau associée à la motivation. Les chercheurs ont voulu vérifier si il ya une réponse similaire à des stimuli plus abstraits tels que la musique, qui n’est pas nécessaire à la survie (comme la nourriture l’est) et qui n’agissent pas directement sur le Système Neveux Central (SNC) (comme les substances psycho-actives).
L’étude : Les 217 bénévoles qui ont répondu puis été invités à nommer 10 morceaux de musique préférés ont ensuite été soumis à 5 cycles de dépistage, afin d’éliminer les participants trop largement sensibles à leur environnement. La sélection finale a choisi les participants qui manifestaient une réponse physiologique à leurs morceaux de musique (comme un changement de fréquence cardiaque ou de rythme respiratoire). Pendant l’expérience, les volontaires ont reçu une injection d’un produit chimique qui marque la présence de dopamine dans le cerveau pendant un scanner. Leurs rythmes cardiaque, respiratoire, la transpiration, la circulation sanguine et la température cutanée ont été mesurées afin de pouvoir estimer le niveau d’excitation émotionnelle. Les volontaires étaient également invités à appuyer sur un bouton lorsqu’ils ressentaient des frissons.
L’expérience de plaisir intense en réponse à la musique peut provoquer une libération de dopamine dans le cerveau. L’étude a montré que la dopamine peut aussi être libérée dans l’attente de l’écoute de cette musique agréable.
Une étude qui permet d’aider à expliquer pourquoi la musique est si importante dans toutes les sociétés humaines ?
Source : Nature Neuroscience publié online le 9 janvier 2011 10.1038/nn.2726 Anatomically distinct dopamine release during anticipation and experience of peak emotion to music.
Mise en ligne par Claire Tancrède, le 24 janvier 2011 (Visuel NIH)
Lu par Anne Marie Nicolas
Le Neupro® enfin disponible en pharmacie
Publié le 06 juillet 2011 à 08:15Article paru dans LE PARKINSONIEN INDÉPENDANT n°45 – juillet 2011
Sale temps, en ce début d’année 2011, pour les agonistes dopaminergiques ! Suite à l’affaire Médiator, plusieurs agonistes font l’objet d’une enquête de pharmacovigilance et ont été placés fin Janvier 2011, par l’AFSSAPS sur une liste de 77 médicaments mis sous surveillance. Il s’agit du Célance, du Parlodel et du Trivastal. En Avril 2011, le Célance a été retiré du marché par son fabricant. Par ailleurs, le fabricant du Requip vient d’être condamné en justice, en raison d’effets indésirables sur un patient [Affaire Jambart/GSK : le laboratoire a fait appel de la décision. Nous suivrons attentivement les suites de cette affaire.].
C’est pourtant le moment (janvier 2011) où enfin le Neupro devient disponible dans les pharmacies françaises. Ce nouvel agoniste dopaminergique était annoncé depuis plusieurs années, mais sa disponibilité en France avait été différée jusqu’à présent. Désormais, il pourra être prescrit par les neurologues, par exemple pour remplacer un agoniste précédent, qui serait mal supporté par un patient.
1. Caractéristiques générales du Neupro :
Le Neupro (molécule Rotigotine) est produit par les laboratoires UCB Pharma SA. Il s’agit d’un nouvel agoniste dopaminergique, administré par un dispositif transdermique (patch), dans la maladie de Parkinson idiopathique[Idiopathique : qui a son existence propre sans autre cause connue.] (MPI). Il est utilisable en monothérapie ou en association avec la L‑Dopa.
Nouvel agoniste dopaminergique non ergoté, Neupro permet une libération en continu du principe actif (rotigotine), grâce à une administration par dispositif transdermique. Neupro est disponible en 4 dosages : 2, 4, 6, et 8 mg par 24 h, de 4 tailles différentes. Chaque patch est conditionné individuellement en sachet scellé.
La posologie moyenne est :
- au stade précoce de la maladie, d’environ 4mg/24h, sans dépasser un maximum de 8mg/24h
- au stade avancé, d’environ 8mg/24h, sans dépasser la dose maximale de 16 mg/24h
Le patch doit être appliqué une fois par jour, les sites d’application étant l’abdomen, la cuisse, la hanche, le flanc, l’épaule ou le bras. Le patch reste sur la peau pendant 24h et doit ensuite être remplacé par un patch neuf collé sur un autre site d’application. Il faut éviter de répéter l’application au même endroit pendant les 14 jours qui suivent.
Neupro doit être conservé au réfrigérateur entre 2°C et 8°C.
Le Neupro est un médicament de Liste 1, soumis à prescription médicale et remboursé par la SS à 65%. Son prix varie en fonction du dosage : ex. la boite de 30 patchs à 4mg coûte 81.62€.
Enfin, à titre d’information, signalons que le Neupro est aussi utilisé dans le traitement du syndrome des jambes sans repos (SJSR).
2. Mise sur le marché :
La rotigotine avait obtenu une Autorisation de Mise sur le Marché (AMM) européenne en mars 2006, sous le nom de Neupro pour le traitement de la MPI.
Mais en juin 2008, une directive de l’agence européenne des médicaments (EMEA) limitait la fourniture de Neupro aux patients déjà sous traitement avec ce médicament, dont la promotion en Europe était restreinte.
En effet, le suivi continu du produit commercialisé avait révélé la présence de cristaux dans certains patchs. Pour pallier ce défaut, UCB Pharma a mis en place une nouvelle chaîne de conservation et de distribution réfrigérée. Les lots de Neupro ont été remplacés par des produits réfrigérés du fabricant jusqu’au patient.
En 2009, UCB demandait à l’agence européenne la levée des restrictions. Les restrictions ont finalement été levées et, en conséquence, le Neupro a obtenu une AMM européenne le 29 11 2010.
Le médicament est disponible en France dans les pharmacies depuis Janvier 2011.
3. Effets indésirables :
Selon Eureka Santé, des effets indésirables du médicament NEUPRO ont pu être observés :
- Réactions locales : rougeur et démangeaisons au point d’application
- Nausées, vomissements, constipation, bouche sèche, digestion difficile, douleur abdominale
- Hypotension orthostatique
- Hallucinations
- Somnolence excessive au cours de la journée, et plus rarement, envie impérieuse de dormir
Des cas d’addiction aux jeux d’argent, d’achats compulsifs et d’hypersexualité ont également été rapportés sous traitement dopaminergique, notamment chez les personnes atteintes de la maladie de Parkinson lors d’utilisation à forte dose.
Ont également été observés : crises de hoquet, vertiges, maux de tête, troubles de la vision, perte de poids.
4. Résultats des essais cliniques :
L’efficacité de la rotigotine dans le traitement des signes et des symptômes de la MPI, a été étudiée dans le cadre de 4 études internationales, sur des groupes de quelques centaines de patients, randomisés, en double aveugle, contrôlés versus placebo ou comparés à des patients recevant du ropinirole (Requip) ou du pramipexole (Sifrol).
Dans toutes ces études, on commence au départ par déterminer pour les patients la dose optimale de produit que l’on maintient jusqu’à la fin de l’essai. Le critère principal d’évaluation de l’efficacité est constitué par la mesure du score sur l’échelle de l’activité de la vie quotidienne et de l’examen moteur (parties II et III de l’UPDRS).
On trouvera les résultats complets de ces essais cliniques dans l’avis de la Haute Autorité de la Santé en date du 30 Avril 2006.
En résumé, on a pu vérifier que :
- la rotigotine a démontré son efficacité par rapport au placebo
- par contre, elle est moins efficace que le ropinirole et le pramipexole
5. Avis du corps médical :
Dès 2006, de nombreux commentaires négatifs ont été émis dans la littérature médicale sur le Neupro. Certains parlent de régression par rapport aux agonistes précédents, un autre estime que le Neupro est le pire des agonistes !
Relisons par exemple cet article de la revue « Prescrire » en 2007 :
« Dans la maladie de Parkinson débutante, selon un essai, la rotigotine, sous forme de dispositif transdermique, est moins efficace que le ropinirole par voie orale. Dans un autre essai, à un stade avancé, la rotigotine n’a pas été plus efficace que le pramipexole. Elle n’a pas moins d’effets indésirables systémiques auxquels il convient d’ajouter des réactions locales au dispositif transdermique. La mise en route du traitement est plus délicate. Chez les patients ayant une maladie de Parkinson, quel que soit le stade, autant en rester à un agoniste dopaminergique par voie orale, tel que la bromocriptine (Parlodel) ».
Les reproches faits au Neupro par les spécialistes (manque relatif d’efficacité, effets indésirables) paraissent justifiés, quoique sans doute trop négatifs. Mais les malades peuvent avoir aussi un autre point de vue.
Souvent, les scientifiques veulent ignorer l’intérêt du patch, qu’ils considèrent comme un gadget. Les malades qui ont souvent des difficultés à respecter les horaires de prise de médicaments par voie orale peuvent bénéficier de ce confort nouveau. Il en est de même de tous les patients ayant des difficultés de déglutition ou, pire, des problèmes gastriques.
6. Conclusion :
En tout état de cause, l’arrivée du Neupro sur le marché, apportera une arme supplémentaire aux neurologues. Le Neupro mérite au moins d’être essayé par les malades bien informés, les autres agonistes dopaminergiques ayant aussi bien des défauts !
La plupart des informations sont issues du blog yann 73.
Rédigé par Jean Pierre LAGADEC
L’ibuprofène pourrait réduire le risque de développer la maladie de Parkinson
Publié le 05 juillet 2011 à 09:56Article paru dans LE PARKINSONIEN INDÉPENDANT n°45 – juillet 2011
Communiqué paru dans la revue « Maxisciences » du 3 mars 2011
La revue Neurology a publié hier les résultats d’une étude menée par des chercheurs américains, concernant le lien entre anti-inflammatoires et maladie de Parkinson. Ils ont ainsi pu prouver que la consommation de ce type de médicament et notamment de l’ibuprofène pouvait réduire le risque de développer la maladie de Parkinson, cette affection neurodégénérative chronique qui se concrétise souvent par une lenteur à effectuer certains gestes, une raideur des muscles et des tremblements.
Ainsi, ces conclusions se basent sur l’étude des données médicales de 136.197 individus qui ont accepté de communiquer leur consommation d’aspirine, ibuprofène ou autres anti-inflammatoires non-stéroïdiens. La recherche a duré six années et durant ce laps de temps, 291 personnes ont développé la maladie de Parkinson. Les chercheurs sont parvenus à la conclusion que les individus consommant de l’ibuprofène à raison de deux fois par semaine minimum avaient 40% de risques en moins de contracter la maladie. Les auteurs de l’étude recommandent aujourd’hui que l’ibuprofène soit pris en compte comme potentiel agent neuroprotecteur contre Parkinson.
Lu et copié par Henri MINARET
Information Médicale
Publié le 04 juillet 2011 à 08:00Article paru dans LE PARKINSONIEN INDÉPENDANT n°45 – juillet 2011
Un médicament en cours d’essai clinique
Le SAFINAMIDE® améliore significativement la fonction motrice de patients atteints d’une maladie de Parkinson à un stade avancé dans une étude Pivot de Phase III.
Dans un communiqué de Presse publié le 3 février 2009, par Newswire : Merck Serono et son partenaire Newron Pharmaceuticals S.P.A ont annoncé que les résultats de la première étude clinique de Phase III, évaluant le safinamide® en complément d’un traitement par la lévodopa (étude 016), ont satisfait le critère d’évaluation principal en augmentant de 1,3 heure la durée quotidienne de la période « ON » chez des patients souffrant d’une maladie de Parkinson à un stade d’évolution intermédiaire à avancé avec fluctuations motrices. Les périodes « ON » pendant lesquelles les malades atteignent leur meilleur niveau de fonctionnement moteur.
Dans ce même communiqué, Bernhard Kirshbaum, Vice-président Exécutif Recherche et Développement de Merck Serono, déclare : « Ces résultats représentent un nouveau pas en avant dans la poursuite de notre objectif de mettre à disposition des patients et médecins de nouveaux traitements dont ils ont un besoin urgent dans le domaine du traitement des maladies neurodégénératives. »
Ravi Anand, Directeur Médical de Newron a déclaré : « Ces résultats sont extrêmement encourageants. Ils indiquent non seulement une augmentation de la durée de la période « ON » et une réduction de la durée de la période « OFF » totale, mais aussi de la période « OFF » après la prise matinale chez des patients atteints d’une maladie de Parkinson à un stade d’évolution intermédiaire à avancé traités de façon optimale par la lévodopa, des agonistes dopaminergiques, des inhibiteurs de la COMT, des anti-cholinergiques ou encore l’amantadine »
Les critères d’évaluation secondaires de l’efficacité évalués à ce jour ont été atteints avec les deux doses de Safinamide (50 mg par voie orale 1 fois par jour ou 100 mg par voie orale 1 fois par jour). Une augmentation statistiquement significative de la durée quotidienne totale de la période « ON » a été observée dans les deux groupes traités par le safinamide®, en complément d’un traitement par la lévodopa, par comparaison avec l’effet obtenu dans le groupe placebo.
Présentation du Safinamide® :
C’est un dérivé alpha-aminoamide administré par voie orale et actuellement développé par Merck Serono et Newron (selon l’accord conclu avec Newron en 2006, Merck Serono détient l’exclusivité mondiale des droits de développement, de production et de commercialisation du safinamide® dans le traitement de la maladie de Parkinson et de la maladie d’Alzheimer ainsi que pour d’autres applications thérapeutiques) comme traitement complémentaire aux modalités thérapeutiques actuelles de la maladie de Parkinson. Le safinamide® possèderait un mode d’action original reposant à la fois sur l’amplification des fonctions dopaminergiques (par inhibition puissante et réversible de la monoamine-oxydase B, MAO‑B) et de la recapture de la dopamine) et sur la diminution de l’activité glutamatergique par inhibition de la libération de glutamate.
Dans un communiqué du 8 novembre 2010, Merck Serono et son partenaire Newron ont annoncé les résultats d’une étude de 18 mois réalisée en double-aveugle et contrôlée par placebo (étude 018), extension d’une étude de la Phase III de 6 mois réalisée avec le safinamide® (étude 016), dont les résultats ont été rapportés.
L’objectif de cette extension était d’évaluer l’efficacité et le profil de tolérance à long terme (24 mois) du safinamide, administré à deux doses différentes (50mg et 100mg en une seule prise quotidienne) en complément du traitement par la lévodopa chez des patients atteints d’une maladie de Parkinson à un stade d’évolution avancé. Bien que le critère principal d’efficacité de l’étude (018) portant sur l’évaluation des dyskinésies après 24 mois de traitement n’ait pas été satisfait, les résultats de l’analyse exploratoire du principal critère secondaire prédéfini sont conformes aux effets sur la fonction motrice observés dans l’étude 016. Les résultats de l’étude 018 confortent également le profil de tolérance du safinamide®.
L’effet du safinamide sur les dyskinésies sera évalué de manière plus précise dans une étude pilote spécifique actuellement en cours. « Ces résultats issus d’une étude rigoureuse à long terme, réalisée en double-aveugle et contrôlée sont particulièrement pertinents car ils apportent des informations essentielles sur le profil de tolérance à long terme du safinamide® et sur le maintien de ses effets sur la fonction motrice » a déclaré Luca Benatti, Directeur Général de Newron : « Ces résultats sont porteurs d’espoir chez les patients ayant une maladie de Parkinson qui ont besoin de prendre des médicaments sur de très longues périodes »
Les résultats complets de l’étude seront soumis pour présentation lors de prochains congrès scientifiques, dès que l’ensemble des analyses en cours seront terminées. Cette phase d’extension (étude 018) qui a permis de recueillir des données de tolérance à long terme constitue, avec les études 015, O16 et 017 déjà terminées et les études MOTION et SETTLE en cours, le programme de développement clinique du safinamide®. Ce programme a été conçu pour soutenir une demande d’Autorisation de Mise sur le Marché (AMM) du safinamide® comme complément d’un traitement par agoniste dopaminergique chez les patients ayant une maladie de Parkinson à un stade d’évolution précoce et comme complément du traitement par la lévodopa chez les patients ayant une maladie de Parkinson à un stade d’évolution avancé.
Extraits de divers communiqués de presse lus et copiés par :
Henri MINARET, membre de l’Association du Limousin
Un jour
Publié le 01 juillet 2011 à 17:39Article paru dans LE PARKINSONIEN INDÉPENDANT n°45 – juillet 2011
On existe ! On est là !
Que sommes-nous en train de faire de notre vie !!
Nous devons nous bouger, réagir.
Alors on se met à réfléchir.
Et on se rend vite compte
que l’on est capable de faire plus de choses
que l’on ne s’imaginait.
Même si on le fait plus lentement
même si c’est dur parfois, on le fait autrement.
Nous trouvons toujours une solution à nos problèmes quotidiens.
Puis on fait le ménage de tout ce qui est négatif.
Et ce n’est pas évident pour nous !
D’abord, le regard des autres : tu te dis c’est leur problème, pas le mien.
Puis tu t’entoures de personnes qui essaient de te comprendre
Et qui ne cherchent pas à te juger uniquement sur ton apparence
mais pour ce que tu es toi.
Et bien sûr quand on a la chance d’avoir de bons enfants et un bon conjoint.
Si non ! Il suffit parfois d’aller dans une association
pour trouver des personnes formidables
qui sont à ton écoute et te comprennent.
Quand tu as fait tout ça, tu es capable de tout !!!!
MERCE
Par Mercédès Perez
Combattre la dysarthrie parkinsonienne
Publié le 01 avril 2011 à 06:26Article paru dans LE PARKINSONIEN INDÉPENDANT n°44 – mars 2011
Dans le dernier numéro de notre Parkinsonien de décembre 2010, j’ai lu avec attention l’article publié par Jean-Pierre LAGADEC sur le traitement de la dysarthrie.
Nous sommes en effet, nous les parkinsoniens, tous plus ou moins confrontés à ce handicap au cours de l’évolution de notre maladie. Le premier réflexe consiste bien évidemment à recourir à un orthophoniste. Mais J.P. Lagadec le souligne lui-même, la répartition de ces professionnels est très inégale dans nos provinces françaises. Certains départements, comme nous le constatons également pour les neurologues, ne comptent que quelques unités. Comment dans ce cas obtenir des séances régulières afin d’assurer leur efficacité ?
Mais sans faire appel à ces professionnels, sans moyens sophistiqués, nous avons entre amis parkinsoniens mis en place, sans protocole, d’une manière la plus naturelle qui soit, une méthode à la portée de tous : le téléphone. Avec ce moyen les distances ne comptent plus. Même les horaires ont moins d’importance, en tout cas beaucoup plus facile à concilier, premier point.
Deuxième point : aujourd’hui les tarifs téléphoniques présentent des formules tarifaires intéressantes, pouvant concurrencer les honoraires d’orthophonistes.
Troisième point : vous pouvez organiser confortablement votre séance, en tout cas le plus agréablement possible, sans avoir à subir le regard de votre interlocuteur.
Quatrième point, allier l’utile à l’agréable : assurer nos séances tout en entretenant l’amitié.
Je peux vous dire que ça marche ! Nous testons en effet la méthode avec quelques amis depuis plusieurs années, comme vous avez pu le faire vous-même, et nous la recommandons à celles et ceux qui hésiteraient encore.
Henri MINARET, membre de L’association des parkinsoniens du Limousin
Témoignages : les cauchemars parkinsoniens…
Publié le 22 mars 2011 à 21:12Article paru dans LE PARKINSONIEN INDÉPENDANT n°44 – mars 2011
Les troubles du sommeil sont fréquents et variés chez le Parkinsonien. Le sujet a déjà fait l’objet d’un article dans le numéro 26 du Parkinsonien Indépendant d’août 2006 sous le titre « Des troubles du sommeil aux conséquences multiples ». Parmi tous les troubles évoqués dans cet article, je souffre surtout de cauchemars. Aussi après vous avoir raconté mes mésaventures nocturnes, je vous donnerai l’avis des médecins et des chercheurs en neurosciences sur les cauchemars Parkinsoniens, avant de se demander que peut-on faire ?
Des nuits agitées :
Depuis le début de ma maladie, il m’arrive parfois dans mon sommeil de m’agiter dans le lit conjugal, de lancer des coups de pied ou de bras, tout en criant ou en insultant un ennemi imaginaire. Réveillé en urgence par mon épouse, qui songe surtout à esquiver les coups, je ne conserve aucun souvenir de ce cauchemar. Quand mon épouse me raconte ce que j’ai fait et dit, je suis tout à fait incapable d’en expliquer le contenu par des évènements de ma vie. Je n’ai pas d’ennemi, et je n’utilise pas de mots orduriers.
De plus, il m’est arrivé à la suite de cauchemars, deux incidents qui auraient pu être plus graves : La première fois, je suis tombé du lit et en me relevant, sans doute brutalement dans l’obscurité, j’ai heurté un meuble et me suis blessé au bras. Le lendemain matin, les draps étaient maculés de sang. La deuxième fois, je suis encore tombé du lit, et me suis blessé à l’arcade sourcilière. De plus, j’ai pu constater que dans ma chute, j’avais heurté du front un coin de meuble situé à plus d’un mètre de haut. J’étais donc plus ou moins debout sur le lit avant de tomber.
Certains lecteurs doivent penser que j’exagère dans la description de ces nuits agitées. A ces lecteurs sceptiques, je conseillerais la lecture d’un article, intitulé : « Quand vivre son rêve, c’est le cauchemar des autres », où le docteur Delphine Oudiette évoque par exemple des tentatives de strangulation ou de défenestration.
Je pense que beaucoup de Parkinsoniens sont sujets aux cauchemars. La plupart d’entre eux préfèrent ne pas en parler. Les conjointes (conjoints) victimes de ces extravagances se confieraient plus volontiers.
Pourquoi des cauchemars ?
Tout d’abord quelques rappels sur le sommeil (Source : Institut National du Sommeil). Notre sommeil se divise en trois phases : le « sommeil léger », le « sommeil lent profond » et le « sommeil paradoxal ». L’alternance entre ces trois phases forme un cycle de sommeil qui s’étale sur près de 90 minutes. Une nuit complète correspond généralement à 4, 5 ou 6 cycles, soit l’équivalent de 6 à 9 heures de sommeil.
Le sommeil paradoxal est de loin la phase la plus fascinante ! Contrairement aux précédentes, elle se caractérise par une relance très importante de l’activité cérébrale. Alors que nous sommes bien installés dans notre sommeil, c’est à ce moment que les rêves se bousculent dans notre tête. Le pouls et la respiration sont alors irréguliers. On note une atonie musculaire et la présence de mouvements oculaires rapides sous les paupières fermées. C’est cette atonie, qui permet au dormeur, en bloquant ses mouvements d’avoir des rêves paisibles. Le sommeil paradoxal représente en moyenne, 20% de notre temps de sommeil.
Cependant, dès 1986, le psychiatre américain Carlos Schenck décrivait un trouble du sommeil paradoxal, caractérisé par une perte totale ou partielle de l’atonie musculaire et l’apparition de comportements indésirables (parler, frapper, sauter, injurier etc…). Ce trouble a reçu la dénomination de « Trouble comportemental en sommeil paradoxal » (TCSP) ou RBD en anglais. Pendant longtemps, on a considéré que ce trouble du sommeil paradoxal n’avait pas de conséquences sur la vie éveillée.
Mais des études plus récentes ont montré que les patients atteints de TCSP avaient un risque supérieur à la moyenne de voir s’installer une maladie neurodégénérative comme la maladie de Parkinson (MP), la démence à corps de Lewy (DCL) ou l’atrophie multisystémique (AMS). Ces maladies débutent rarement de façon subite. Elles ont débuté sournoisement par atteinte des systèmes neuronaux, plusieurs années avant le diagnostic clinique. D’autres études ont montré que chez un grand nombre de malades, le TCSP représente un stade précoce d’une maladie neurodégénérative, comme la maladie de Parkinson. Ce marqueur précoce pourrait permettre de détecter plus tôt de futurs Parkinsoniens et de les soigner dès que des traitements de neuroprotection seront disponibles.
Par ailleurs, il a été constaté que dans les populations de personnes diagnostiquées MP, plus d’un tiers d’entre elles étaient affligées d’un TCSP. Ces malades sont souvent atteints d’une dégradation de leurs fonctions cognitives, ce qui n’est pas le cas des malades non atteints d’un TCSP. Le TCSP est plus qu’une maladie du sommeil et présente des liens communs avec la maladie de Parkinson.
Que peut-on faire ?
En présence de cauchemars, les solutions qui viennent immédiatement à l’esprit consistent pour protéger le conjoint à aménager le logement pour la nuit : lits séparés ou mieux chambre séparée. Pour protéger la victime des cauchemars, il y a lieu d’éloigner du lit tous les meubles qui pourraient être dangereux en cas de chute et même de prévoir des coussins amortisseurs. C’est à chacun d’imaginer les moyens d’éviter et d’amortir les chutes. Bien entendu, il faut consulter un neurologue ou un psychiatre.
Dans l’article cité en bibliographie, Carlos Schenck répond à des questions fréquemment posées sur les troubles du sommeil, et ce sera la conclusion de cet article : en raison des progrès dans le diagnostic et les traitements, la plupart des troubles du sommeil peuvent être traités avec succès, par des médicaments ou un changement de mode de vie, ou les deux. Ne pas s’inquiéter si les troubles sont peu fréquents. Par contre, si les troubles persistent et s’aggravent, on peut craindre un TCSP.
L’ignorance est un handicap. Il est facile de nier les faits qui se sont passés pendant le sommeil. Il faut se faire raconter le contenu de ses cauchemars.
tout le monde, même bien portant, peut avoir, pendant le sommeil, toute sorte de comportement, à partir de « basic instincts » : sexualité, nourriture, agression…etc.
Enfin, signalons le livre de Carlos Schenck : Sleep The mysteries, the problems and the solutions (disponible sur Amazon)
Jean Pierre LAGADEC
Bibliographie (accessible sur Internet)
Quand vivre son rêve est le cauchemar des autres de Delphine Oudiette (Sciences Humaines.Com)
Trouble comportemental en sommeil paradoxal et maladies dégénératives de J. F. Gagnon (edk.fr)
Advice from Carlos H. Schenck, MD, on Sleep Problems, Strange Behaviors, and When to See a Doctor (health.com).
Enquête MACIF Aidants et Aidés (suite)
Publié le 15 mars 2011 à 16:28Article paru dans LE PARKINSONIEN INDÉPENDANT n°44 – mars 2011
ÉTATS GÉNÉRAUX du 23 novembre 2010 à PARIS
La MACIF a terminé son enquête comme prévu le 23 novembre en réunissant plus de 1000 personnes à l’occasion de ses états généraux. Au cours de cette journée des ateliers thématiques ont été réunis, chacun avec un sujet défini.
ATELIER 1 : L’économie de l’aide : entre solidarité collective et responsabilité individuelle, quel partage des coûts ? Intervenant Professeur Henry NOGUES.
Le soutien des proches est une variable déterminante souvent favorable à la qualité de vie de tous. Quand les plus proches sont présents et aidants, la tentation pour la collectivité a toujours été de se désengager au nom d’un principe de subsidiarité mal interprété et d’arbitrages protégeant coûte que coûte les prélèvements obligatoires. La construction de ce welter – mixte est toujours délicate pour éviter l’isolement des aidants et des aidés. Elle suppose intelligence et responsabilité individuelle mais aussi collective car elle implique l’Etat et les collectivités territoriales mais également les employeurs et singulièrement les entreprises de l’économie sociale (associations et mutuelles).
ATELIER 2 : Comprendre pour mieux accepter. Faire face aux regards des autres. Intervenant : Professeur Michaëla MARZANO.
L’autre dérange et déstabilise. Surtout dès lors qu’il est différent, lorsqu’il est malade ou qu’il est touché par un handicap, lorsqu’il est plus faible et qu’il vieillit. Par la différence en effet, il dépayse, étonne, surprend, déstabilise. Il oblige à s’interroger sur la place que l’altérité occupe dans notre vie et sur celle que nous sommes disposés à lui accorder. C’est alors cependant que l’inconnu surgit. La proximité révèle nos faiblesses et nous fragilise : plus on regarde, plus on risque d’avoir peur. Comment sortir de cette peur et faire face aux regards des autres ? Y a‑t-il un moyen pour faire comprendre et accepter la différenceV ?
ATELIER 3 : De l’expérience à l’expertise : le savoir-faire des aidants. Intervenant : Mme Florence LEDUC, Présidente de l’Association Française des aidants.
L’expérience des aidants familiers les amène à développer une véritable expertise sur la situation de la personne aidée. Quels sont les enjeux de celle-ci dans l’évaluation des situations et la prise en charge globale des personnes aidées par les professionnelsV ? C’est ce que cet atelier propose de questionner. Dans une relation parfois difficile ou chaque intervenant doit négocier sa place. Quelles pourraient être les modalités d’un transfert de savoir-faire ?
ATELIER 4 : Les nouvelles technologies au service de la personne aidée ou au service de la personne aidant. Intervenant : Mr Bernard ENNUYER, sociologue.
Le développement des nouvelles technologies pour les personnes en situation d’incapacité ou de handicap semble incontournable car il apporte un confort et un bien-être à de nombreux niveaux : transport, loisirs, culture, éducation, communication. Ces technologies sont plurielles en fonction de l’âge ou du handicap et permettent de conserver une mobilité et une indépendance. Elles s’avèrent aussi très utiles pour alléger la pénibilité de certaines tâches et permettent aux aidants de mieux s’investir sur la qualité des relations humaines et affectives auprès des proches qu’ils accompagnent.
ATELIER 5 : Autocensure et sentiment de culpabilité de l’aidant. Intervenant : Professeur Jacques GAUCHER, psychosociologue.
Face à la dépendance d’un conjoint ou d’un membre de sa famille, l’aidant s’emploie à être disponible, présent et généreux avec celui-ci. C’est mon devoir, je ne peux pas imaginer laisser ce rôle à d’autres … L’aidant se consacre à sa tâche au point de s’y épuiser et de se fragiliser. Insensiblement, il se soustrait à la vie sociale, il renonce à son bien-être, son épanouissement personnel et son entourage ne se rend pas toujours compte, s’y habitue et parfois le laisse se mettre en danger. Parfois même l’entourage le culpabilise s’il entreprenait de trouver des solutions autres et ou complémentaires. « Vous mettez votre mère, votre conjoint en accueil de jour. Moi, je ne pourrais pas, je suis trop attaché à ma mère, mon mari et je sais que je lui ferais du mal ». Est ce devenir un monstre que de chercher de l’aide et du soutien lorsqu’on est dans l’épreuve ?
ATELIER 6 : Un aidant éclairé et librement accompagné. Intervenant : Docteur Alain CALVEZ.
Référent de suivi, gestionnaire de cas, case manager, plusieurs expressions actuellement utilisées pour désigner un éventuel professionnel qui serait en charge, non pas d’une personne ayant un problème complexe d’incapacité, que celle-ci soit consécutive à une maladie chronique ou un état global de pluri-pathologies et de fragilité, mais de l’ensemble de la situation d’un ménage confronté aux conséquences de cet état, en charge d’accompagner un couple aidant-aidé en difficulté. Il y a sûrement pertinence à aborder certaines situations de santé chronique avec une telle approche et en particulier quand une maladie affecte les fonctions intellectuelles supérieures. Toutefois une démarche doit être considérée à la lumière des besoins effectifs d’un couple aidant-aidé. Il ne saurait y avoir aide aux aidants ou aux familles sans consentement des intéressés, sans professionnalisme des réponses.
A la lumière de différentes expériences française et étrangère, il est nécessaire d’envisager le contour de ce type d’action d’aide aux aidants au moment ou le programme MAIA visant une meilleure intégration des services vient d’être généralisé.
Raoul GRIFFAULT
Pesticides : quels effets sur la santé ?
Publié le 14 mars 2011 à 22:06Article paru dans LE PARKINSONIEN INDÉPENDANT n°44 – mars 2011
C’est le thème de la conférence qui s’est tenue à LEZAY le 26 novembre. Le conférencier est docteur en pharmacie au laboratoire de recherche du CHU de POITIERS.
L’appellation pesticide recouvre les herbicides, les insecticides et les fongicides. Ces produits que nous absorbons par contact, par inhalation ou ingestion se fixent sur les corps graisseux et à la longue agissent sur nos cellules et les détraquent ainsi que notre système hormonal. La contamination par ingestion se fait par les fruits et les légumes que nous consommons, ce sont les fraises venant d’Espagne qui contiennent le plus de pesticides.
Dans beaucoup de ces pesticides, la molécule est connue et donc peut être analysée ; par contre l’excipient reste inconnu et peut provoquer des troubles comme les maux de tête, nausées, vomissements, allergies, cancers, maladie de Parkinson.
C’est chez les agriculteurs que l’on trouve le plus de Parkinsoniens et de cancers de la prostate. Il est aussi constaté une baisse importante de la fécondité chez les jeunes agriculteurs et une augmentation de la stérilité chez les jeunes agricultrices. Il y a de plus en plus d’enfants d’agriculteurs naissant avec des malformations génitales. Il a également été constaté qu’un bébé était plus handicapé à la naissance si la maman était touchée par des pesticides que si le papa seul était touché.
Il faut souvent des années avant de constater les méfaits des pesticides et donc les chercheurs n’ont pas suffisamment de recul pour dire quel produit est responsable de tel ou tel problème.
Les statistiques montrent aussi que c’est en GUADELOUPE et en MARTINIQUE qu’il y a le plus de cancers de la prostate et ce n’est pas un hasard.
Comme derrière tout cela, il y a d’énormes enjeux financiers, tout ce que nous pouvons faire c’est de ne pas acheter ces produits et également de conseiller à nos adhérents agriculteurs parkinsoniens de ne pas hésiter à porter l’affaire devant les tribunaux bien que monter un dossier soit un vrai parcours du combattant.
Raoul GRIFFAULT
Parkinson : découverte d’un chercheur albigeois
Publié le 09 mars 2011 à 17:46Article paru dans LE PARKINSONIEN INDÉPENDANT n°44 – mars 2011
Quand il parle de son métier, Patrice Péran a l’accent qui chante. Normal, cet Albigeois pure souche travaille à l’Unité 825 à Toulouse. Le jeune chercheur de 35 ans, vient d’identifier la signature cérébrale de la maladie de Parkinson (*).
Un simple examen suffira donc demain pour détecter Parkinson ?
 Au départ, j’avais une formation de biologiste, puis j’ai préparé un doctorat de neuropsychologie déjà tourné vers les parkinsoniens avant de m’orienter vers la neuro-imagerie. Le parcours est atypique mais c’est lui qui m’a permis de me trouver à l’interface entre le radiologue, le physicien et le patient. Jusqu’à présent, on ne faisait pas d’IRM pour détecter mais pour vérifier la maladie. Notre travail dé-montre aujourd’hui que l’IRM est capable de faire la distinction entre les cerveaux de patients parkinsoniens et ceux de sujets sains.
Au départ, j’avais une formation de biologiste, puis j’ai préparé un doctorat de neuropsychologie déjà tourné vers les parkinsoniens avant de m’orienter vers la neuro-imagerie. Le parcours est atypique mais c’est lui qui m’a permis de me trouver à l’interface entre le radiologue, le physicien et le patient. Jusqu’à présent, on ne faisait pas d’IRM pour détecter mais pour vérifier la maladie. Notre travail dé-montre aujourd’hui que l’IRM est capable de faire la distinction entre les cerveaux de patients parkinsoniens et ceux de sujets sains.
La revue Brain a donné un écho important à votre découverte. Quelle sera la suite ?
Nous n’en sommes pas encore à la routine clinique. Mais c’est une première pierre. Par contre, après la détection d’Alzheimer révélé aussi par l’U825, l’utilisation d’un ensemble de bio-marqueurs issus de l’IRM, dessine des perspectives prometteuses. En matière de Parkinson, le diagnostic est parfois difficile. En focalisant sur cette signature cérébrale, nous pouvons penser que nous saurons bientôt faire la différence entre les vrais et les faux syndromes parkinsoniens, définir non seulement les profils pathologiques et sains mais aussi ceux des patients à risque. Enfin, il serait intéressant de suivre la maladie et sa détérioration.
(*) Les équipes de l’U825 (Inserm/UPS) dirigées par Pierre Celsis à Toulouse ont travaillé en coopération avec la Fondation Santa Lucia à Rome.
Publié le 25/11/2010 08:33 | Propos recueillis par Ch.R.-P.
Lu par Sylvain BIELLE s.bielle@laposte.net
La RPP (Relaxation Pneumo Phonique) et la maladie de Parkinson
Publié le 08 mars 2011 à 09:38Article paru dans LE PARKINSONIEN INDÉPENDANT n°44 – mars 2011
Je suis orthophoniste depuis plus de trente ans et la pratique de la rééducation de la voix m’a conduit à élaborer des outils qui, au fil des années, sont devenus une technique à part entière : la RPP (Relaxation Pneumo Phonique).
J’enseigne aujourd’hui La RPP, et je l’utilise tous les jours dans ma pratique auprès de nombreux patients et, au bénéfice, entre autre, des malades atteints de maladies dégénératives comme la maladie de Parkinson.
Les choses essentielles sont toujours les plus simples. Et les choses simples sont celles auxquelles on ne fait plus attention parce qu’elles sont devenues banales, familières. En effet, quoi de plus banal que respirer ? 15.000 fois par jour nous inspirons et nous expirons. Et nous ne pensons même pas que notre vie en dépend. Si nous nous arrêtons quelques minutes de respirer, nous mourons purement et simplement. Et sans aller jusque là, si nous respirons mal, alors, nous vivons mal.
Dire à quelqu’un comment il doit respirer ne donne en général pas de résultats satisfaisants. C’est comme demander à quelqu’un de regarder ses pieds quand il court dans un escalier. Il risque fort de trébucher. Mais on peut guider quelqu’un vers un bon geste respiratoire sans consignes verbales, en « parlant » à son corps avec les mains.
Pour en revenir à la respiration. Tout le monde sait que notre respiration est sans cesse influencée par nos émotions. Si nous éprouvons une peur, une joie… notre respiration se modifie le temps de cette émotion, puis, l’émotion passée, notre respiration reprend son fonctionnement originel. Mais parfois, lorsque les émotions sont trop fortes ou bien qu’elles durent trop longtemps, ou encore qu’elles sont répétées, nous perdons notre respiration originelle et, sans nous en rendre compte, nous nous installons dans une respiration modifiée et même, parfois, nous pouvons vivre le reste de nos jours de cette façon.
Nous ne respirons plus aussi bien qu’avant. Or, si nous ne respirons plus comme avant, il est évident que nous ne vivons plus comme avant.
Ainsi, cette personne à qui on vient d’annoncer qu’elle a une maladie dégénérative, est dans un état de choc émotionnel qui va modifier son mode respiratoire. Bientôt elle va souffrir autant de mal respirer, que de la maladie elle même, et cette respiration modifiée va l’empêcher de se battre pour guérir car elle aura intégré un mode respiratoire d’échec et non de victoire. Ne croyez-vous pas qu’elle a tout à gagner à retrouver une respiration confiante et que cela va sans doute l’aider à vivre ?
Et bien voilà, la RPP est un chemin privilégié pour retrouver une respiration confiante. C’est une thérapie manuelle, un « langage manuel » qui montre au corps comment retrouver sa respiration d’origine, et donc, comment retrouver le chemin de la vie, pleinement vécue. On vit comme on respire, il faut donc se remettre à respirer comme on veut vivre. C’est ce que propose la RPP.
Comment se pratique La RPP ?
En quelques mots, voici les outils que j’utilise :
Le premier c’est le bercement :
Nous avons pour la plupart tous été bercés quand nous étions enfant, et nous savons tous à quel point cet acte tout simple peut consoler, apaiser, rassurer et effacer nos souffrances et nos craintes… Je berce mes patients tout au long de la séance et de nombreuses tensions s’effacent. C’est un acte régressif qui comme tous les actes régressifs servent d’assise à la progression et à la maturation.
Le deuxième outil c’est la vibration :
La vibration est la manifestation même de la vie. Ce qui vit vibre, et ce qui vibre vit. Dès que nous mettons en vibration une partie de notre corps nous activons les processus de vie à ce niveau, nous remettons en circuit les énergies vitales. Nous démantelons les processus de densification tissulaire qui sont à terme des processus mortifères.
Je fais vibrer le thorax de mes patients afin d’en effriter les édifices d’auto protection qu’ils ont construits à un moment de leur vie et qu’ils ont gardés. Ces murailles sont souvent devenues des prisons à l’intérieur desquelles ils sont enfermés. Le geste respiratoire d’auto protection qui a été protecteur au moment du stress devient toxique s’il perdure dans le temps.
En effet l’état de méfiance qui permet d’éviter de souffrir trop, dans une situation donnée, ne peut devenir un état permanent de vie. Nous sommes faits pour vivre détendus, donc confiants. La respiration aussi doit être confiante et non méfiante.
Le troisième outil c’est le son de la voix :
Il s’agit de la voix même du patient. En effet, la voix met en vibration notre squelette et notre masse corporelle. On sait l’importance que revêt la voix dans les techniques spirituelles des moines en occident ou en orient… L’action apaisante et libératrice du fameux Om tibétain. Dans certaines pathologies dégénératives, les mécanismes d’hypophonie sont très récurrents. De fait, l’intensité vocale est intimement liée à la synergie pneumo phonique. La voix est un fruit du souffle. Je fais émettre des sons vocaux à mes patients et ces sons sont émis sous le contrôle pneumo phonique de mes mains qui dispensent vibrations et bercement pendant leur émission afin de libérer le patient des tensions issues du stress.
Ainsi mes mains travaillent sur le corps du patient et négocient avec lui un accès à la respiration confiante. Avec une main j’invite le patient à aller plus loin dans son geste respiratoire et avec l’autre main je le rassure et l’encourage à le faire. Avec une main je libère les tensions thoraciques issues du stress et avec l’autre main j’efface les densités que ce stress a générées dans l’abdomen. Le patient fait alors, en général, l’expérience d’une libération qui est le signe d’un retour à une vie plus forte et plus sereine.
Faire confiance à la Vie.
Pourquoi est-il si difficile d’obéir à des consignes respiratoires sans s’embrouiller ? Cest une question intéressante à laquelle on peut répondre de multiples façons.
Je pense que c’est un mécanisme de sauvegarde naturel qui nous protège en nous interdisant de faire de la respiration une fonction contrôlée.
Bien sûr en travaillant sur soi on peut finir par contrôler sa respiration de façon très pointue mais je reste persuadé que la meilleure respiration est celle qui échappe à notre contrôle.
Mais si j’ai un mode respiratoire modifié par le stress comment vais-je pouvoir le rectifier si je ne passe pas par une correction consciente et volontaire de mon geste respiratoire ?
La RPP permet ce retour à une respiration spontanée et libre sans passer par la conscience et la maîtrise corporelle.
L’accès ou le retour à la confiance ne se fait pas en dehors de la confiance, c’est-à-dire que pour apprendre la confiance il faut exercer le lâcher prise qui est exactement le contraire de la maîtrise.
C’est comme pour apprendre à nager, il faut être dans l’eau. On n’apprend pas la nage sur le bord de la piscine, parce que, justement, nager, c’est être dans l’eau et trouver l’inspiration du geste adapté à cet élément.
Pour la respiration c’est pareil : on ne respire bien que confiant, c’est-à-dire hors de la maîtrise et du contrôle.
Ce n’est pas notre intellect qui doit savoir respirer, c’est notre corps. C’est-à-dire notre être intuitif dégagé de l’emprise du mental. C’est une fonction animale, primitive, archétypale, disent les scientifiques. C’est une fonction qui ne peut bien s’exercer qu’en dehors du concept et de la pensée.
La respiration originelle est celle du petit enfant qui est encore dans la confiance. Le retour à cet état de confiance est le but de la RPP.
Je vous propose un petit exercice :
Voilà, vous venez de vous réveiller, il fait beau, et vous êtes en vacances. Vous allez ouvrir la fenêtre et remplir vos poumons d’un bon bol d’air frais.
Imaginez la scène. Comment ça se passe ?
Eh bien je pense qu’une fois la fenêtre ouverte, vous écartez les bras fléchis, les poings serrés, vous bombez le torse et vous inspirez fortement en rentrant le ventre.
N’est-ce pas ce que vous avez imaginé ?
Eh bien, je suis désolé de vous dire que vous n’avez pas fait le meilleur geste pour remplir vos poumons, car vous venez de monter votre diaphragme et de comprimer toute la partie basse de vos poumons qui, du coup, n’a pas pu se remplir. Seule la partie thoracique s’est remplie, soit environ 1/3 de votre capacité réelle. En plus dans votre geste aspiratoire forcé vous avez pincé en partie vos narines et freiné ainsi le passage de l’air inspiré.
Voilà. Ce petit exemple vient confirmer que notre image du bon geste inspiratoire est spontanément erronée.
Nos expressions verbales confirment notre façon de concevoir la respiration : nous disons par exemple : « prendre l’air » ce qui suppose que cela dépend d’un acte volontaire de notre part, alors que la réalité c’est que « l’air nous prend » comme il s’engouffre spontanément dans une éponge.
Ceci nous montre à quel point nous avons besoin d’apprendre à lâcher prise. A laisser notre corps retrouver ses fonctions naturelles hors du contrôle de notre pensée.
On apprend à marcher et à lire, mais on n’apprend pas à respirer. On retrouve sa respiration originelle.
C’est ce que j’appelle faire confiance à la Vie.
En résumé :
La RPP, Relaxation Pneumo Phonique, thérapie manuelle issue de la rééducation vocale, est au départ, un outil de restauration du mode respiratoire modifié par le stress. Il s’est révélé adaptable à de nombreuses pathologies (maladie de Parkinson et autres maladies dégénératives, bégaiement, hyperactivité, troubles du sommeil, troubles psychiques et somatiques, troubles de l’attention et de la concentration, …) Les résultats thérapeutiques obtenus au fil des années ont permis d’ouvrir le champ d’application de la technique RPP au-delà du symptôme initial.
Le fondement de la technique repose sur la restauration d’une respiration confiante spontanée en lieu et place d’une respiration méfiante qui est toujours hypo-oxygénante et génératrice de multiples dégradations de l’ensemble des fonctions vitales et du système immunitaire.
Une formation à la technique RPP est maintenant dispensée depuis cette année 2010 aux thérapeutes qui le désirent (médicaux et para médicaux en exercice) et enseigne les techniques manuelles de la RPP : Toucher, Vibration, Bercement, Onde vocale, Manipulation corporelle, Apprentissage des conduites thérapeutiques propres à la RPP. Fondements théoriques.
Pour tous renseignements :
Robert DE GUARDIA
24 Av du Grand Large
66000 Perpignan
04.68.34.38.13
robert.de-guardia@wanadoo.fr
Jean Michel GASTON CONDUTE
1 rue Victor Hugo
66500 Prades
04.68.96.28.2
jeanmigaston@orange.fr
Jean Louis BRUN
1 Av Jean Jaurès
30900 Nîmes
04.66.21.94.94
lean-louis.brun5@wanadoo.fr
Magali MARCHAL
Le Mas
66220 Ansignan
06.14.13.64.96
magmarchal@gmail.com
La vitamine D
Publié le 07 mars 2011 à 09:42Article paru dans LE PARKINSONIEN INDÉPENDANT n°44 – mars 2011
En manquez-vous ? Comment le savoir et y remédier ?
Du fait de l’accumulation des données scientifiques concordantes, la déficience en vitamine D est désormais reconnue comme affectant surtout les pays de l’hémisphère nord. Plus on s’éloigne de l’équateur, plus la fréquence de certaines maladies augmente : l’ostéoporose, la maladie de Parkinson, la sclérose en plaques, le diabète, l’autisme, certains cancers. Elles ont en commun d’être corrélées à une déficience en vitamines D.
Aussi, il convient de demander un dosage sanguin à son médecin si l’on se trouve dans les groupes de population ayant intérêt à faire mesurer leur taux sérique de vitamine D : Femmes enceintes, allaitantes, ou ménopausées, Femmes ayant une densité osseuse basse, Personnes âgées de plus de 60 ans et plus particulièrement celles âgées placées en institution ou ne quittant pas leur domicile, Personnes souffrant de faiblesse et douleurs musculaires, Personnes à risques de chutes, Personnes obèses, Personnes suivant certains traitements médicamenteux.
Interprétation des résultats
Préalablement à la lecture des résultats, il faut connaître trois données de base pour s’y retrouver facilement : Comme l’organisme ne commence vraiment à stocker la vitamine D qu’à partir du moment où le taux sérique atteint et se maintient au moins à 40 ng/ml, l’objectif ne se limitera pas à combler le déficit en vue d’atteindre la valeur plancher, mais consistera à conserver tout au long de l’année une valeur attestant de la reconstitution d’un stock minimal de 40 ng/ml (ng = nanogramme). On peut escompter une augmentation de 1 ng par ml du taux sérique par apport quotidien complémentaire de 100 UI (Unité Internationale). A nos latitudes, il y a très peu ou pas du tout de synthèse cutanée de vitamine D entre octobre et mars inclus, celle-ci se formant au niveau de la peau par action des rayons ultraviolets solaires.
Le taux sérique est exprimé en ng/ml
10  : Carence avérée
20 : Déficience marquée
30 Déficience modérée
30 : Valeur plancher à partir de laquelle le taux sérique est classiquement considéré comme « normal »
40 : Valeur moyenne corrélée à un stockage de la vitamine D dans l’organisme
50 : Valeur optimale corrélée à un stockage de la vitamine D dans l’organisme
50/70 : Plage à atteindre pour optimiser son immunité et sa santé osseuse et extra-osseuse
80 : Valeur optimale à rechercher selon certains des plus grands spécialistes américains de la vitamine D
100 : Valeur plafond marquant habituellement la fin de la « normalité »
> 100 : Hypervitaminose
150 et plus : Toxicité (risque d’hypercalciurie et d’hypercalcémie)
(Extraits d’un article paru dans la revue « Belle Santé ») www.belle-santé.com
Maladie de Parkinson et vitamine D
Les besoins de l’organisme en vitamine D sont difficiles à évaluer puisque l’on ignore la quantité fabriquée naturellement. Les personnes ayant des niveaux élevés de vitamine D dans le sang paraissent avoir un moindre risque à développer la maladie de Parkinson, selon une étude de chercheurs finlandais. La Finlande étant un pays où l’exposition au soleil est réduite, la population souffre généralement d’un bas niveau chronique de vitamine D. La vitamine D est déjà connue pour son rôle clé joué pour la santé osseuse ainsi que pour, peut-être, contribuer à réduire le risque de cancer, de maladies cardiovasculaires et de diabète chez les adultes. La maladie de Parkinson affecte les cellules nerveuses dans plusieurs parties du cerveau, en particulier celles qui utilisent la dopamine. Des études ont montré que la vitamine D a une action importante sur le fonctionnement normal de ces cellules. Ces résultats confortent l’hypothèse qu’une carence chronique en vitamine D est un facteur de risque de développer la maladie de Parkinson ; aussi un complément pourrait être nécessaire.
les suppléments nutritionnels
Antioxydants : vitamine C, vitamine E, sélénium, contribuent à protéger les cellules dans le cerveau et notamment la progression de la maladie de Parkinson.
Les acides gras essentiels : oméga 6, oméga 3, sont des anti-inflammatoires.
Vitamines B, surtout la vitamine B 6 essentielle pour le système nerveux donné avec du zinc.
Les acides aminés aident à maîtriser les tremblements.
La vitamine D, comme expliqué plus haut.
D’autres éléments peuvent être pris également en supplément mais accompagnés d’un apport en magnésium indispensable à leur bonne utilisation par l’organisme.
Hygiène de vie
D’abord et avant tout, il est important d’avoir une bonne hygiène de vie, à savoir : une alimentation équilibrée ; la pratique d’un sport (hors compétition), marche, natation, vélo, gymnastique douce de préférence au grand air ; la pratique de la kinésithérapie d’une façon régulière. En évitant les vêtements trop couvrants et trop serrés.
La vitamine D dans l’alimentation
Les sources sont peu nombreuses : Pour 100 grammes,
— Le lait : 0.4 à 10 UI, le beurre : 40 à 100 UI, la margarine : 10 UI
— Les œufs, le foie : 100 UI et plus
— Les abats : 10 à 80 UI
— Le thon, les sardines : 1500 à 2500 UI
— Les huîtres : suivant la saison 1000 à 75000 UI.
En conclusion :
En raison de l’importance que joue la Vitamine D pour la santé osseuse, il convient d’être vigilant compte tenu des risques de chutes occasionnées par la maladie de Parkinson autant que par l’âge.
Lu par Lucie Salentiny Besnard Luciemichel93@free.fr
La maladie de Parkinson : actualités physiopathologiques et axes de recherche thérapeutique.
Publié le 06 mars 2011 à 08:22Article paru dans LE PARKINSONIEN INDÉPENDANT n°44 – mars 2011
La maladie de Parkinson a été décrite pour la première fois en 1817, par James Parkinson (1755 – 1824), médecin anglais. Depuis cette première description clinique de la maladie de Parkinson, notre compréhension de cette pathologie neurodégénérative a fortement progressé, mais reste encore partielle. Actuellement, beaucoup de questions se posent encore aux chercheurs, médecins et acteurs de santé. Comment définir la maladie de Parkinson ? Alors que cette question parait simple et fondamentale, la réponse n’en est pas évidente. Or cette réponse ne conditionne-t-elle pas la recherche de nouvelles stratégies thérapeutiques, leurs bonnes mises en œuvre et par conséquent l’amélioration de l’état de santé du patient parkinsonien ? Ainsi, une compréhension toujours plus approfondie du fonctionnement cérébral, des réseaux neuronaux, des dysfonctionnements cellulaires et moléculaires, et des causes potentielles à l’origine de ces troubles, est indispensable à l’émergence de stratégies thérapeutiques curatives, ou ralentissant la progression de la maladie. C’est dans cet esprit et avec ces considérations que j’ai souhaité faire le point, sous la forme d’une thèse pour le diplôme d’Etat de Docteur en Pharmacie, sur les actualités physiopathologiques et les axes de recherche thérapeutique actuellement en développement dans la maladie de Parkinson.
La maladie de Parkinson peut se définir selon des critères cliniques (symptômes des patients) ou des critères physiopathologiques (nature des dysfonctionnements des réseaux neuronaux et des altérations moléculaires au sein des cellules). Actuellement, la maladie de Parkinson est définie comme une affection neurodégénérative, d’étiologie mal connue, touchant l’ensemble des systèmes monoaminergiques (dopaminergique, noradrénergique, et sérotoninergique) au niveau intracérébral et au niveau du système nerveux périphérique autonome. La principale caractéristique est la dégénérescence des neurones dopaminergiques de la substance noire pars compacta (zone cérébrale) entrainant un déficit en dopamine dans le striatum (zone cérébrale), responsable des troubles moteurs tels que le tremblement de repos, l’akinésie (incapacité à initier et à exécuter des mouvements volontaires et automatiques) et l’hypertonie (rigidité). De plus, le patient parkinsonien est affecté par des troubles cliniques non-moteurs davantage pris en considération de nos jours.
Tous les patients parkinsoniens ne présentent pas les mêmes troubles cliniques. Il existe des différences dans la nature et dans l’intensité de ces symptômes. De plus, ces symptômes apparaissent plus ou moins précocement (40 à 75 ans par exemple). Ces différences cliniques sont vraisemblablement liées à des troubles physiopathologiques différents. Peut-on alors parler d’une seule maladie de Parkinson ? Depuis plusieurs années, la compréhension de la nature des troubles cellulaires (et non cliniques) amènent les acteurs de santé à catégoriser les différentes formes de maladies de Parkinson. La maladie de Parkinson se caractérise par l’accumulation dans certains neurones (notamment dopaminergiques), d’une protéine altérée, mal repliée, et non éliminée par la cellule, à savoir l’alphasynucléine. La maladie de Parkinson appartient donc aux alpha-synucléinopathies. Bien que d’autres protéines soient également accumulées, l’alphasynucléine est majoritaire. Ces protéines accumulées forment une structure intracellulaire caractéristique, appelée corps de Lewy. D’autres pathologies dans lesquels on retrouve des signes cliniques parkinsoniens, comme la démence à corps de Lewy ou les atrophies multi systématisées présentent également une accumulation de cette protéine dans des neurones. Il existe aussi des tauopathies, dans lesquelles on retrouve une accumulation cellulaire d’une autre protéine, la protéine tau. Certaines de ces pathologies présentent également des signes cliniques de type parkinsonien.
Dans le cas de la maladie de Parkinson, l’origine de l’accumulation de cette protéine (alphasynucléine) est encore incomprise. Quel est le processus qui amène à la mort des neurones dopaminergiques dans lesquels cette alphasynucléine est anormalement accumulée ? Cette question n’a pas encore de réponse complète et satisfaisante. Toutefois, depuis de nombreuses années, les facteurs environnementaux, à savoir les pesticides et les métaux, sont suspectés de jouer un rôle clé dans ce processus. Des enquêtes épidémiologiques mettent bien en corrélation l’exposition à des pesticides et la plus grande fréquence de maladies de Parkinson dans des populations souvent agricoles ou rurales. Ainsi, la majorité des cas de maladie de Parkinson (environ 90%), dits idiopathiques ou sporadiques, ont probablement pour origine une susceptibilité génétique associée à des facteurs environnementaux. Cependant, depuis une dizaine d’années, des formes génétiques de la maladie de Parkinson ont été mises en évidence. En effet, des mutations sur certains gènes sont responsables de maladies de Parkinson. Pour certaines d’entre-elles, les signes cliniques sont similaires à ceux de la maladie de Parkinson idiopathique, alors que d’autres présentent une symptomatologie plus éloignée. Actuellement, une dizaine de gènes ont été identifiés comme potentiellement liés à la pathogénèse de la maladie de Parkinson (exemples de gènes : SNCA, PRKN, PINK1, LRRK2). Bien que ces formes génétiques ne représentent que 10% des cas de maladie de Parkinson, leur étude n’en demeure pas moins importante. En effet, de par la mutation de ces gènes, les chercheurs peuvent étudier l’implication des protéines issues de ces gènes dans le processus moléculaire amenant les neurones à accumuler l’alphasynucléine et à mourir.
Actuellement, plusieurs phénomènes ont été identifiés comme participant à la mort des neurones, notamment dopaminergiques. Tout d’abord, la métabolisation oxydative de la dopamine qui conduit à la formation d’un composé appelé aminochrome peut, dans certaines conditions, favoriser la production de métabolites réactifs au sein des neurones et donc augmenter le stress oxydatif cellulaire. L’aminochrome pourrait alors constituer une source endogène toxique pour les neurones dopaminergiques. Par ailleurs, des dysfonctions mitochondriales, une altération du système d’élimination des protéines altérées (système ubiquitine- protéasome), et des lysosomes sont également associées à l’accumulation de l’alphasynucléine dans les neurones. Le système immunitaire et inflammatoire cérébral est également impliqué dans le processus pathologique de la maladie de Parkinson. Cependant, malgré ces avancées dans l’identification des acteurs intracellulaires dans le processus dégénératif des neurones, les mécanismes, les séquences, et les liens entre ces acteurs restent encore inconnus. Or, le développement de stratégies thérapeutiques curatives semble étroitement lié à notre compréhension de ces mécanismes moléculaires conduisant à la mort des neurones.
La compréhension de la pathogénie a été améliorée par une meilleure compréhension du fonctionnement des circuits neuronaux (notamment ceux des ganglions de la base fortement impliqués dans la maladie de Parkinson) et des altérations cellulaires et moléculaires, même si l’ensemble des interactions n’est pas encore totalement défini. Ces avancées permettent actuellement l’essai de différentes stratégies thérapeutiques contre la maladie de Parkinson. Lorsque les thérapeutiques classiques comme la lévodopa-thérapie ou les agonistes dopaminergiques deviennent inefficaces contre des formes avancées de la maladie, une stimulation cérébrale profonde peut être, dans certains cas précis, proposée au patient. Cette approche est à différencier de la stimulation magnétique transcrânienne qui est en cours de développement. Cette stratégie permettrait un remodelage des certains circuits neuronaux et ainsi favoriserait une augmentation de libération de dopamine. Des essais cliniques ont montré une amélioration des troubles moteurs de 15 à 50%. Des résultats d’autres essais sont moins favorables, mais il reste beaucoup de travail de mise au point, afin que cette approche soit la plus efficace possible. D’autre part, pour renouveler le stock de neurones dopaminergiques ou contrecarrer les dysfonctions cellulaires, d’autres approches se développent actuellement. Tout d’abord, il est important de parler de la thérapie cellulaire. Au cours des années, plusieurs essais chez l’animal ont été réalisés à partir de types cellulaires différents (neuroblastes fœtaux, cellules souches mésenchymateuses, cellules souches neurales) et dans des conditions de greffes variées que ce soit dans la substance noire ou le striatum. Cette stratégie qui offre un grand espoir de remplacement cellulaire, n’est encore pas applicable chez le patient parkinsonien. Il demeure encore beaucoup de questions sur des plans de sécurité d’emploi de cette stratégie, d’efficacité et de conditions d’utilisation. Depuis quelques années, le transfert de gènes d’intérêt (thérapie génique) dans les structures cérébrales lésées, a suscité un grand engouement. Différentes stratégies de thérapies géniques permettraient d’augmenter la capacité de survie des neurones et de ralentir la progression de la maladie. On peut citer, à titre d’exemples, le facteur GDNF (glial cell line-derived factor) connu pour ses effets neuroprotecteur et de régénération des axones. Des essais cliniques encourageants ont été réalisés. La neurturine, qui est un facteur de croissance agissant sur les neurones dopaminergiques, est également à l’essai. Des stratégies de thérapie génique de gènes codant pour des enzymes (tyrosine-hydroxylase, dopa-décarboxylase, GTP-cyclohydrolase‑1) permettant d’augmenter la synthèse de dopamine dans les neurones, sont aussi étudiées. De plus en plus de travaux combinent ces deux approches en modifiant génétiquement des cellules d’intérêt avec des gènes d’intérêt, qui seront ensuite greffées (thérapie génique ex vivo). Par ailleurs, il existe aussi une autre approche afin de combattre la progression de la maladie de Parkinson : la neuroprotection. Cette stratégie consiste à protéger les neurones du processus de mort cellulaire et ainsi permettre un ralentissement de la progression de la maladie. La neuroprotection est donc destinée aux maladies débutantes, avant même que les troubles moteurs connus ne se manifestent. Cette stratégie nécessiterait donc un diagnostic beaucoup plus précoce. Cette neuroprotection essaie de contrer les dysfonctions intracellulaires en ciblant, notamment, les altérations mitochondriales. Des molécules sont actuellement en cours d’essai comme par exemple la créatine et le coenzyme Q10. Des approches permettant de diminuer la composante neuro-inflammatoire délétère pour le fonctionnement cellulaire sont aussi testées. Un autre axe de recherche thérapeutique consiste à bloquer certains types de canaux calciques à la surface des neurones dopaminergiques à l’aide de molécules comme l’isradipine. Enfin, une dernière approche est de nos jours en développement afin de diminuer les symptômes des patients parkinsoniens. En effet, bien que les neurones dopaminergiques soient les principaux neurones touchés dans cette maladie, d’autres structures cérébrales non dopaminergiques sont impliquées dans le contrôle des mouvements et notamment dans les fluctuations motrices et les dyskinésies apparaissant souvent à la suite d’une lévodopa thérapie au long cours. Des antagonistes des récepteurs à l’adénosine A2A comme l’istradéfylline sont en cours d’essais cliniques. Sont également à l’étude des inhibiteurs du glutamate, des antagonistes des récepteurs adrénergiques alpha2c, des inhibiteurs des récepteurs NMDA (N‑méthyl-D-aspartate), et des modulateurs sérotoninergiques.
Ainsi, l’ensemble des travaux de recherche ont contribué à améliorer la définition de la maladie de Parkinson, et ce, à différents niveaux. Sur le plan clinique car les symptômes de la maladie sont variés qu’ils soient moteurs ou non-moteurs, et différents entre les patients. Sur le plan des réseaux neuronaux, car la vision du fonctionnement de ces réseaux qui contrôlent notamment la motricité est fortement complexifiée. Sur le plan des processus cellulaires et moléculaires, car la compréhension des différents acteurs participant à l’agrégation de cette protéine, l’alphasynucléine, retrouvée dans les neurones en dégénérescence s’est grandement améliorée, même si beaucoup de questions restent encore sans réponse. Or, notre compréhension dans ces trois aspects est indispensable à l’émergence de nouvelles stratégies thérapeutiques, notamment curatives. Actuellement, de nombreuses recherches et essais précliniques ou cliniques dans les domaines de la stimulation magnétique transcrânienne, de la thérapie cellulaire, de la thérapie génique, de la neuroprotection, et concernant des traitements symptomatiques non-dopaminergiques, sont porteurs d’espoir dans l’amélioration de la prise en charge du patient parkinsonien. Bien-sûr, beaucoup de travail reste à faire, et l’intérêt que les patients parkinsoniens et leur entourage portent aux chercheurs et aux acteurs de santé en général, motive encore plus la détermination à combattre la maladie de Parkinson.*
Vincent LE FOL.
* L’ensemble de ces informations et les références s’y rapportant, figurent dans la thèse suivante : Vincent LE FOL, thèse pour le diplôme d’Etat de Docteur en Pharmacie, « La maladie de Parkinson : actualités physiopathologiques et axes de recherche thérapeutique », Faculté de Pharmacie de Nantes, 2010.
La thèse est consultable depuis le site internet Nantilus (http://nantilus.univ-nantes.fr, portail documentaire de l’université de Nantes).
Enquête M A C I F Aidants et Aidés
Publié le 18 décembre 2010 à 08:00Article paru dans LE PARKINSONIEN INDÉPENDANT n°43 – décembre 2010
La M A C I F, particulièrement sensibilisée aux problèmes de santé et du maintien à domicile, a lancé en Janvier 2008 une grande enquête afin de mieux cerner les problèmes rencontrés par les aidants et les aidés. Cette enquête a été réalisée téléphoniquement par l’IFOP auprès de 1574 personnes représentatives de la population française, auxquelles il a été demandé si elles ou quelqu’un de leur foyer étaient ou avaient été aidant. La définition de l’aidant proposée était la suivante : Un aidant est la personne non professionnelle qui vient en aide à une personne dépendante de son entourage pour les activités de la vie quotidienne comme se coucher, se lever, s’habiller, se déshabiller, boire et manger, se laver, aller aux toilettes, se déplacer dans son logement.
C’est ainsi que 317 personnes se trouvent dans ce cas.
Les résultats qui me semblaient les plus significatifs et que j’ai retenus portent sur le profil des aidants, la personne aidée, l’identification des besoins, les démarches effectuées, le manque d’information et les attentes auprès des sources existantes.
- Sur les personnes interrogées, 7% sont ou ont été aidant
- Soins 1 fois par semaine 90%, Soins quotidiens 63% aident une personne de la famille
- N’ont pas d’aide de l’extérieur 58%
- La majorité des aidants sont des femmes soit 70%
- Les personnes aidées sont à 89% des membres de la famille proche, parents, conjoint.
- Les aidants à 92% n’assurent ni tutelle ni curatelle.
- L’âge moyen de la personne aidée est de 76 ans car 83% ont 65 ans et plus.
- Les principales raisons de l’aide : 51% longue maladie, 44% âge avancé, 30% handicap physique
- Les personnes aidées sont chez elles à 61%, au domicile de l’aidant 26%
- Aidants bénéficiant d’une aide professionnelle 49%. Aide non professionnelle 48% Sans aucune aide 22 %
- La majorité des aidants sont des retraités. Sont aidant depuis plus de cinq ans : 26 %
- Le temps moyen d’aide est de 5 heures par jour
- 50% des aidants effectuent au moins quatre actes par jour, les plus cités : les repas 68%, la toilette aller aux toilettes 56%, habillage, déshabillage 30%, faire les courses 30%, puis les promenades, les démarches administratives.
- Les aidants à 80% n’ont pas modifié leur activité
- Les aidants à 52% déplorent le manque de soutien moral, 33% le manque de soutien matériel et 16% le manque de temps pour soi.
- Le manque d’information est cité par 46% des aidants.
- Parmi les démarches effectuées par les aidants on retrouve : 41% les demandes d’aide à domicile, 33% pour l’APA, 25% les recherches d’établissements spécialisés
- 45% des aidés percevant l’APA
- Les principales sources d’information les plus citées : Mutuelle aidant/aidé 38%, Conseil Général 37%, établissement spécialisé 37%, Assurance Maladie 35%, médecins, hôpitaux, cliniques 31%, associations 25%.
Les aidants (7% sont ou ont été aidants) sont majoritairement féminins, âgés de plus de 50 ans, auprès d’un membre de leur famille. L’aide se résume en terme d’action et de présence quotidienne auprès de personnes âgées.
La MACIF poursuit son action en organisant des réunions en région afin de mieux faire connaître les résultats de son enquête constituant le document final présenté le 23 11 10.
A cette date, à la Cité des Sciences et de l’Industrie se tiendront les Premiers Etats Généraux Aidant/Aidé afin de porter le débat au niveau national en impliquant les Pouvoirs Publics. La MACIF ambitionne de réunir 2 500 personnes ce jour-là.
Pour en savoir plus : www.aidants-aides.fr
Proposé par Raoul GRIFFAULT
L’aide psychologique apportée par un groupe de parole.
Publié le 15 décembre 2010 à 10:14Article paru dans LE PARKINSONIEN INDÉPENDANT n°43 – décembre 2010
Un exemple charentais.
Apprendre que l’on est parkinsonien n’est jamais réjouissant ; mais cela peut être plus ou moins mal vécu en fonction des réactions de l’environnement. Certains se sentiront soutenus, d’autres connaîtront des réactions d’incompréhension de la part de personnes parfois très proches qui s’irritent de leur lenteur et qualifient de paresse leur perte de dynamisme.
Pour ceux qui sont seuls ou dont la perte de vitalité est mal interprétée par l’entourage immédiat, un soutien psychologique peut être appréciable.
La participation à un groupe de parole est un moyen non négligeable pour évacuer la souffrance dans un premier temps et reconstruire ensuite un ensemble de pensées positives sur lesquelles le malade pourra s’appuyer pour mieux supporter les inconvénients de sa maladie.
PREMIERE ETAPE : évacuer la souffrance.
Tout le monde n’est pas capable de livrer d’emblée son vécu intérieur ; certains par éducation, par habitude de cacher ses sentiments, par crainte des réactions de ceux qui écoutent :…
Il importe de placer tous les participants sur un pied d’égalité en veillant à ce que le groupe ne comprenne que des malades et de créer une atmosphère favorable au partage en rappelant quelques principes :
La première condition est le RESPECT de soi-même et de l’autre. Celui qui parle doit aller jusqu’au bout de ce qu’il a à dire sans être interrompu. C’est seulement lorsqu’il aura terminé que les autres pourront lui poser des questions avec pour seul objectif d’essayer de mieux comprendre. Celui qui reçoit la question demeure libre de répondre si la réponse lui vient spontanément et sans être gêné ou de ne pas répondre et dire par exemple qu’il n’a pas encore examiné cet aspect des choses et qu’il y réfléchira. Chacun ne partage que ce qu’il a envie de partager.
La seconde condition essentielle à la libération de la parole est le NON JUGEMENT. Personne n’est là pour juger les autres. Chacun doit sentir que les autres ne le jugeront pas. On rappellera au besoin que pour juger parfaitement une personne, il faudrait savoir tout ce qu’elle sait, penser tout ce qu’elle pense et éprouver les sentiments qu’elle éprouve. Nul n’en est capable.
Le tour de table sera établi sans rigueur en laissant parler en premier ceux qui se sentent le plus à l’aise pour s’exprimer. En dernier le plus réticent livrera son vécu intérieur après s’être senti réconforté par l’exemple des autres. Cette première étape aura permis non seulement un soulagement personnel, mais aussi un enrichissement par le partage venant des autres.
Le tour de table fournira l’occasion pour chacun de se présenter et de faire connaître ce qu’il attend de la réunion.
DEUXIEME ETAPE : reconstruire un ensemble de pensées positives.
La même méthode pourra être employée : une question suivie de quelques minutes de réflexion et d’un tour de table. L’objectif étant de penser moins à la maladie et d’utiliser les moyens dont on dispose encore pour vivre le mieux possible, les questions seront orientées à cet effet. On pourra par exemple observer que les symptômes parkinsoniens sont particulièrement ressentis dans l’inactivité et beaucoup moins pendant l’action, et poser successivement des questions telles que :
- depuis que je connais ma maladie, qu’ai-je fait pour agrémenter ma vie en tenant compte des moyens dont je dispose (physiques et intellectuels).
- Qu’ai-je l’intention de faire :
- pour rendre ma vie plus agréable en tenant compte des besoins de mon entourage ?
- pour rendre la vie plus agréable à ceux qui m’entourent en tenant compte de mes propres besoins ?
- Dans mon passé y a‑t’il des motivations qui n’ont pas vu le jour en raison d’un environnement ou de circonstances défavorables mais qui peuvent être réveillées avec l’aide d’un environnement favorable.
- Ai-je des envies que je n’ai pas osé satisfaire : pratiquer une activité artistique, chanter dans une chorale, jouer d’un instrument, écrire mes mémoires, etc… ?
L’important est de prendre conscience des motivations profondes qui sont en nous et qui peuvent constituer des supports psychiques capables d’atténuer les effets de la maladie.
Proposé par Paul AUPETIT
Traitement de la dysarthrie parkinsonienne
Publié le 14 décembre 2010 à 08:29Article paru dans LE PARKINSONIEN INDÉPENDANT n°43 – décembre 2010
1. Introduction
La dysarthrie (trouble de la parole) est très souvent présente chez le patient parkinsonien. Elle apparaît dès le début de la maladie, s’aggrave au cours du temps et induit à terme isolement, repli sur soi et perte d’autonomie.
D’origine akinétique, la dysarthrie se manifeste chez le patient par une baisse du niveau sonore (hypophonie), une perte de la hauteur rendant la voix monotone et une altération du timbre (la voix devenant rauque).
Les conséquences de la dysarthrie sont parfois aggravées par une perte de la mimique et de la gestuelle du patient. Par ailleurs, la dysarthrie peut être accompagnée de troubles de l’écriture (micrographie), pénalisant ainsi la communication.
La prise en charge de la dysarthrie par un orthophoniste, pour une rééducation, est d’autant plus indispensable que les traitements médicamenteux ou chirurgicaux n’ont pas ou peu d’influence. Pourtant, alors que la dysarthrie est largement répandue (de 70 à 89% des patients parkinsoniens), seulement 2 à 4 % d’entre eux bénéficient d’un traitement orthophonique.
2. Prise en charge de la dysarthrie
Alors que la dysarthrie est souvent présente dès le début de la maladie, elle est très généralement négligée ou même ignorée par le patient plus sensible à d’autres troubles parkinsoniens.
Parfois, au début, le patient ne se rend même pas compte de sa dysarthrie et attribue aux autres la responsabilité de ses difficultés à communiquer. Lors d’une première consultation orthophonique, on peut entendre ce genre de phrases : « on ne m’écoute pas ! », « on me coupe la parole ! », « je ne peux pas prendre la parole en réunion », etc… Ces citations font sourire, mais décrivent bien les débuts de l’isolement, et du repli du patient sur lui même.
Pourtant, il est souhaitable que la rééducation soit précoce (dès les premières manifestations de la dysarthrie) et elle doit ensuite être prolongée de façon régulière au fil des années.
L’orthophoniste dispose d’une panoplie de moyens pour la rééducation. Cependant, les résultats obtenus par des méthodes classiques ont souvent été jugés insuffisants et les traitements abandonnés par les patients.
Les années 90, ont vu l’émergence aux Etats Unis d’une méthode nouvelle de rééducation, la LSVT, puis son implantation en France.
3. La LSVT (Lee Silverman Voice Treatment)
La LSVT a été conçue et mise au point par une orthophoniste américaine, Lorraine Ramig, et son équipe. Elle porte le nom de Lee Silverman, première patiente, sur qui elle a été expérimentée.
Après une diffusion d’abord aux Etats-Unis et au Canada, puis en Europe, elle a été introduite en France, en 2000, par la société LSVT Global. Elle est pratiquée par des orthophonistes ayant reçu une formation spécifique et agréés par LSVT Global. Elle est pratiquée en France par plusieurs centaines d’orthophonistes.
Une méthode originale : On a vu précédemment que chez le parkinsonien, la dysarthrie se manifeste par une baisse du niveau sonore (hypophonie), une perte de la mélodie et une altération du timbre. La méthode LSVT, utilisée largement aux Etats Unis, en raison de sa simplicité et de son efficacité, est essentiellement une méthode de rééducation vocale. Alors que les méthodes traditionnelles s’attachent surtout à la rééducation du débit et de l’articulation, la LSVT privilégie la rééducation de la voix et son intensité.
Les principes de la LSVT : Selon les concepteurs de la LSVT, les troubles de la parole chez le parkinsonien sont dus aux raisons suivantes :
- une réduction globale de l’amplitude mise en jeu dans le mécanisme de la parole (akinésie, rigidité, lenteur).
- des troubles de la perception sensorielle (qui perturbent la proprioception et le feedback auditif). Le patient est persuadé de parler normalement alors qu’il est hypophone. Ces modifications de la perception sensorielle empêchent la mise en œuvre d’une intensité suffisante. Le patient est incapable de percevoir et de contrôler son niveau sonore.
Dans la LSVT, l’orthophoniste s’attache à installer chez le patient une intensité forte et à rétablir la perception de l’énergie pour y parvenir.
Une séance LSVT : La rééducation a pour but de lutter contre la diminution du volume vocal en s’efforçant d’augmenter la pression sous-glottique et la stabilité de l’émission vocale. Le patient doit apprendre à parler fort et à se concentrer sur l’effort volontaire et sur l’intensité de sa voix : c’est la consigne unique. La LSVT est donc bien adaptée au parkinsonien qui ne fait bien qu’une seule chose à la fois.
Le planning des sessions : La rééducation est intensive pendant un mois et doit être efficace (condition aux Etats-Unis pour être remboursé). Chaque session de rééducation comprend 16 séances de 1 heure, à raison de 4 séances hebdomadaires sur 4 semaines consécutives. Durant la session, le patient travaille tous les jours, 2 fois par jour. Les jours où il suit une séance chez l’orthophoniste, il travaille en plus seul à domicile 10 à 15 minutes. Les jours où il n’y a pas de séance, il fait, à domicile, des exercices deux fois par jour pendant 15 minutes. La méthode LSVT demande de l’énergie et la participation active du patient. Toute défaillance est très vite constatée par l’orthophoniste.
L’efficacité de la LSVT a été évaluée dès les années 90, aux Etats Unis puis en France à partir de 2002 dans l’étude multicentre Météor. Cette étude a montré une amélioration du score d’intelligibilité à la fin de la rééducation, ainsi qu’une réduction du score de handicap, améliorations qui se sont maintenues 6 mois après la fin du traitement. Plus récemment, en 2009, une étude a été menée auprès de 29 patients parkinsoniens, ayant pour objectif d’évaluer l’efficacité de la LSVT dans le cadre d’une prise en charge libérale en France, conduite dans les conditions courantes de travail des orthophonistes.
Les résultats de cette étude mettent en évidence une amélioration globale significative de la parole des patients, se retrouvant dans chacune des caractéristiques principales : qualité vocale, réalisation phonétique, prosodie, intelligibilité, et caractère naturel. Cette étude montre également que les améliorations concernent tous les patients inclus, quels que soient la durée d’évolution de la maladie, le degré de sévérité de la dysarthrie, leur âge et leurs sexes (voir article de Favennec et Rolland Monnoury)
La LSVT en France :
La liste des orthophonistes agréés pour pratiquer en France la LSVT est publiée sur le site Internet de LSVT Global à la rubrique « search a clinician ».
En Mars 2010, on dénombrait sur cette liste 182 orthophonistes agréés, assez inégalement répartis sur le territoire national. Plus de la moitié d’entre eux exercent surtout dans le Nord, le Pas de Calais et le Rhône, ainsi que dans les Bouches du Rhône, la Gironde, la Haute Garonne, l’Isère et l’agglomération parisienne. Les autres (environ 80) sont répartis très inégalement sur les autres départements, certains d’entre eux n’étant pas desservis.
Par exemple, en ce qui concerne les départements « CECAP », on y trouve un orthophoniste agréé dans les départements 22, 29 et 50, mais aucun dans les départements 16, 19, 23, 35, 44, 56 ‚79 et 87. Exceptionnellement, on trouve 5 praticiens dans le département de l’Hérault.
Il y a lieu d’ajouter que certains documents traitant de la LSVT donnent un chiffre de 500 orthophonistes agréés en France (182 ou 500 ou entre les deux ?)
Examinons la population des orthophonistes français. Selon la Fédération Nationale des Orthophonistes, il y a en France environ 15000 orthophonistes (12000 en libéral et 3000 salariés, en particulier en hôpital). Cela donne une densité moyenne de 25 orthophonistes pour 100000 habitants.
De l’analyse de tous ces chiffres, on peut tirer quelques constats :
depuis 2000, seulement quelque centaines (de 1 à 3 %) d’orthophonistes ont adopté la LSVT et ont obtenu l’agrément.
le manque de spécialistes LSVT risque de limiter l’accès aux sessions LSVT de beaucoup de patients et d’allonger les temps de prise de rendez vous.
mais aussi beaucoup de patients demeurent loin d’un orthophoniste LSVT, et les trajets journaliers en voiture (de l’ordre de 150 km AR) provoqueront un supplément de fatigue à des séances déjà fatigantes par elles mêmes.
Pourquoi cette pénurie ? On ne peut incriminer les performances de la LSVT, dont l’efficacité parait établie dans la prise en charge de la dysarthrie parkinsonienne. Peut être, faut-il penser que certains orthophonistes hésitent devant les investissements en formation, en matériel etc.?
4. Conclusion
Compte tenu des études menées aux Etats-Unis et en France, qui ont fait l’objet de nombreuses publications, il apparait que la méthode LSVT est tout à fait efficace dans le traitement de la dysarthrie parkinsonienne.
Par contre, il y a une véritable pénurie d’orthophonistes LSVT sur le territoire français, à l’exception de certaines grandes villes. Cela a pour conséquence que cette méthode de rééducation ne concerne pour l’instant qu’une petite minorité de patients.
Documentation
Ce texte a été rédigé à partir de la lecture de deux articles très documentés sur la LSVT parus en septembre 2009 dans le numéro 239 de la revue Rééducation Orthophonique, de la FNO (Fédération Nationale des Orthophonistes)
- La prise en charge de la dysarthrie parkinsonienne (LSVT) par Véronique Rolland — Monnoury
- Lee Silverman Voice Treatment — Expérience en libéral par Mélanie Favennec et Véronique Rolland — Monnoury
Rédigé par Jean Pierre LAGADEC
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.