Des cellules souches prélevées sur des patients pourraient améliorer la recherche sur les médicaments pour la maladie de Parkinson
Publié le 13 janvier 2013 à 09:30Article paru dans LE PARKINSONIEN INDÉPENDANT n°51 – décembre 2012
Une étude soutenue par NIH (National Institute of Health Institut National de la Santé américain) montre que des cellules de patients différents ont une réponse unique aux médicaments. Les chercheurs ont fait une démarche vers une médecine personnalisée pour la maladie de Parkinson en explorant les signes de la maladie sur les cellules dérivées de patients et en testant comment ces cellules répondent aux traitements médicamenteux.
Les chercheurs ont collecté des cellules de peau sur des patients avec des formes génétiquement héréditaires de Parkinson et ont reprogrammé ces cellules en neurones. Ils ont trouvé que les neurones issus d’individus ayant des types différents de Parkinson, montraient des signes communs de détresse et de vulnérabilité… en particulier, des anomalies dans des composants cellulaires fournisseurs d’énergie cellulaire connues sous le nom de mitochondries. De même, les réponses des cellules aux différents traitements dépendaient du type de maladie de Parkinson de chaque patient. Les résultats ont été publiés dans Science Translational Medicine.
Selon Margaret Sutherland, Ph.D., directrice de programme au National Institute of Neurological Disorders and Stroke (NINDS) : « Ces découvertes suggèrent de nouvelles opportunités pour les essais cliniques de la maladie de Parkinson. Les technologies de reprogrammation pourraient être utilisées pour identifier les patients et agir le mieux possible pour une intervention spécifique »
Un groupe de chercheurs a conduit l’étude avec le support initial du NINDS. Le groupe est dirigé par Ole Isacson, M.D., Ph.D., professeur de neurologie au Maclean Hospital et à la Harvard Medical School à Boston.
Le premier objectif du groupe NINDS était de transformer les cellules de peau de patients en cellules souches pluripotentes induites (induced pluripotentes stem cells ou iPS); ce sont des cellules adultes qui ont été reprogrammées pour se comporter comme des cellules souches embryonnaires. Les chercheurs du groupe ont ensuite utilisé une combinaison de conditions de croissance et de molécules stimulant la croissance pour stimuler ces cellules iPS à devenir de nouveaux neurones, y compris ceux qui en raison de leur type (dopaminergique) meurent dans la maladie de Parkinson.
La maladie de Parkinson affecte certaines régions du cerveau, incluant une zone de commande motrice appelée substance noire. C’est là que la maladie détruit les neurones qui produisent la dopamine. La perte de ces neurones conduit au tremblement involontaire, à des mouvements ralentis, à la raideur musculaire et à d’autres symptômes. Les médicaments peuvent aider à gérer les symptômes, mais il n’y a pas de traitement pour ralentir ou stopper la maladie.
La plupart des cas de Parkinson sont sporadiques, ce qui signifie que la cause est inconnue. Cependant la génétique joue un rôle important. Il y a 17 régions du génome avec des variations communes qui entrainent le risque de développer la maladie de Parkinson. Les chercheurs ont aussi identifié 9 gènes qui après mutation peuvent provoquer la maladie.
Le Dr Isacson et ses collaborateurs ont prélevé sur 5 personnes ayant des formes génétiques de la maladie de Parkinson des cellules de peau puis les ont transformées en iPS. En se focalisant sur des cas génétiques plutôt que sur des sporadiques, ils espéraient avoir de meilleures chances d’obtenir des modèles cellulaires permettant de suivre le processus de la maladie et les réponses aux traitements. Trois des personnes avaient des mutations d’un gène appelé LRRK2, et deux autres étaient frère et sœur avec des mutations au niveau du gène PINK1. Les chercheurs ont également dérivé des cellules iPS de deux des membres de la famille des frères et des sœurs qui n’ont pas la maladie de Parkinson, ni de mutation connue liée à cette maladie.
Parce que des études antérieures avaient suggéré que la maladie de Parkinson impliquait une rupture de la fonction mitochondriale, les chercheurs ont cherché des signes d’altération mitochondriales dans ces nouveaux neurones provenant de patients. Les mitochondries transforment l’oxygène et le glucose en énergie cellulaire. Les chercheurs ont constaté que les taux de consommation d’oxygène ont été plus faibles dans les cellules de patients porteurs de mutations LRRK2 et plus élevés dans les cellules avec la mutation PINK1. Dans les cellules mutantes issues de patients ayant la mutation PINK1, les chercheurs ont également découvert une vulnérabilité accrue au stress oxydatif, un processus nuisible qui, en théorie, peut être neutralisé avec des antioxydants.
Ensuite, les chercheurs ont vérifié si les nouveaux neurones provenant de patients et de volontaires sains étaient vulnérables à une variété de toxines, y compris certaines qui ciblent les mitochondries. Par rapport aux neurones des individus en bonne santé, les neurones provenant de patients étaient plus susceptibles d’être endommagés ou de mourir après une exposition à des toxines mitochondriales. Les neurones provenant de patients ont également subi plus de dommages venant des toxines que les nouveaux neurones issus de cellules de la peau provenant de volontaires sains.
Ensuite, les chercheurs ont tenté de secourir les cellules exposées aux toxines avec divers traitements médicamenteux qui s’étaient montrés prometteurs dans des modèles animaux de la maladie de Parkinson, dont le coenzyme antioxydant Q10 et l’immunosuppresseur Rapamycine. Tous les neurones dérivés de patients, qu’ils aient porté les mutations LRRK2 ou les mutations PINK1, ont eu des réponses positives au coenzyme Q10. Cependant, les nouveaux neurones provenant de patients diffèrent dans leur réponse à la Rapamycine. Le médicament a aidé à prévenir les dommages neuronaux avec des mutations LRRRK2 mais il n’a pas protégé les neurones avec des mutations PINK1.
Ces résultats indiquent que la technologie des cellules iPS pourrait servir à faciliter la sélection des sous-groupes de patients pour des essais cliniques. À ce jour, les essais pour la maladie de Parkinson n’ont pas porté sur des groupes spécifiques de patients ou de formes de la maladie, parce qu’il y a eu peu d’indices pour orienter les chercheurs vers des traitements individualisés.
Bien que l’étude actuelle soit axée sur les formes génétiques de la maladie de Parkinson, la technologie des cellules iPS (transformer des cellules de peau de patient en nouveaux neurones) pourrait servir à définir les mécanismes de la maladie ainsi que les traitements les plus prometteurs pour la forme sporadique de la maladie de Parkinson.
Rédigé par Laurent LESCAUDRON traduit par Jean Pierre LAGADEC
Le NINDS Parkinson’s Disease iPS Cell Research Consortium est l’un des trois consortium fondés par le NINDS
Un des consortiums est axé sur le développement de cellules iPS pour l’étude de la maladie de Huntington, et un autre se concentre sur la sclérose latérale amyotrophique (SLA) et la démence fronto-temporale.
Éditorial
Publié le 09 janvier 2013 à 06:02Article paru dans LE PARKINSONIEN INDÉPENDANT n°51 – décembre 2012
Tous mes vœux sincères pour cette nouvelle année qui va prochainement débuter (à moins que les mystères de la Poste ne vous adressent cette revue qu’en tout début d’année !)… qu’elle vous soit la plus profitable possible et que votre santé au moins se stabilise dans un statu quo équilibré.
Je sais par expérience combien les évènements, le changement de posologie ou de médicament, mais aussi les changements dans la situation sociale, un déménagement, enfin tout ce qui dérange notre précaire stabilité acquise de haute lutte… vont entraîner de bouleversements provoquant des sentiments d’impuissance et de découragement devant cette lutte sans fin, de tous les jours, pour dépasser la dépression passagère liée aux zigzags, souvent erratiques, de notre dosage chimique intérieur.
Une amie m’a rappelé combien il est important, dans ces moments de noirceur profonde, où les idées les plus folles viennent nous titiller, même les plus définitives…, de se souvenir des moments de bonheur ou tout simplement des répits que nous accorde la maladie : nous avons encore des beaux jours devant nous, de belles heures à passer. Et ce n’est pas par excès d’optimisme que je vous dis : regardez les beautés du monde (il y en a !), la joie que vous pouvez encore trouver malgré tout.
C’est tout simplement que nous n’avons pas le choix si nous voulons vivre encore comme des personnes debout, responsables de notre destin.
« Facile à dire » me rétorqueront certains ! Mais je veux m’en persuader le plus profondément possible ne serait-ce que pour ceux qui nous aiment ; nous n’avons pas le droit de les faire souffrir plus que ce qu’ils subissent déjà de nos humeurs, elles aussi, erratiques et de nos incapacités, parfois seulement temporaires mais qui pèsent de tout leur poids.
Alors, oui, sincèrement, de tout mon cœur, je vous dis :
« Mes meilleurs vœux de bonheur pour cette nouvelle année ! »
Un nouveau défi contre le Parkinson
Publié le 08 novembre 2012 à 08:33Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
Présentée au XIIe congrès national, la Foot Mechanical Stimulation (stimulation mécanique du pied)
« Relever le défi et reprendre le cours de la vie », ceci est le sujet principal du XIIe congrès national de Parkinson Italie qui vient de se terminer à Verbania. Un moment de rencontre et d’échanges d’expériences. Les Italiens qui souffrent de Parkinson sont plus de 200 000 (et 12 000 nouveaux malades chaque année). Dans le monde ils sont 4,1 millions, ils atteindront 8,7 millions d’ici 2030. C’est une étude apparue dans Neurology qui le signale. L’alerte est donnée et inquiète les experts de l’OMS.
Pour faire connaître le drame de cette pathologie, une course sans compétition a été organisée dans 90 villes de différents pays, en Italie 36 associations de volontaires se sont activées.
De ce congrès arrive une bonne nouvelle pour les parkinsoniens : la Foot Mechanical Stimulation (FMS) ou stimulation mécanique plantaire (www.terapiaFMS.com). Un traitement innovant de réhabilitation qui se base sur une stimulation mécanique de la superficie de la plante des pieds. Un cycle de stimulation (durée 2 minutes) permet, pour les patients choisis, d’obtenir tout de suite des bénéfices moteurs : amélioration de la rapidité du mouvement, de l’équilibre et de la posture. L’effet peut durer une semaine. Cette thérapie est en cours d’expérimentation dans de nombreux centres : à l’Association de recherche sur les neurosciences à Milan ; au Laboratoire Sincopi, UOC de médecine générale, à l’hôpital Bolognini, à l’université de Milan, etc. (voir article original).
Les résultats de ces recherches, présentés au congrès, ont permis d’enregistrer des améliorations intéressantes chez les patients qui ont participé au protocole.
En particulier, la FMS permet d’améliorer la vitesse de déambulation et la longueur des pas, au bénéfice de l’équilibre et de la posture. La stimulation permet aussi de réduire, chez la majeure partie des patients, la lenteur des mouvements et aussi les épisodes de tremblements des pieds dans le déplacement, les blocages moteurs temporaires.
On enregistre également des bénéfices 24 heures après la stimulation chez certains patients également après 5 jours. L’expérience a aussi détecté quelques paramètres cardiovasculaires parmi lesquels la pression artérielle et l’activité respiratoire. Même dans ce cas, la FMS, qui a été bien tolérée par tous les patients et où n’a été observé aucun effet collatéral décelable, semble modifier positivement le contrôle neuro-végétatif cardiovasculaire en augmentant la réactivité du cœur aux stimuli externes.
« Les faits présentés par les chercheurs – a souligné Giovanni Albani, neurologue à l’Institut Auxologico italien, membre du secrétariat scientifique du congrès et du Comité scientifique de l’Association Parkinson Italie – ouvrent de nouvelles perspectives aux patients parkinsoniens et à leurs mécanismes de récupération moteur. »
La stimulation mécanique plantaire intègre les thérapies pharmaceutiques que le patient suit sous la surveillance de son neurologue soignant et n’influe pas sur les dispositifs médicaux actifs tels les pacemakers ou les stimulateurs DBS.
De meilleures capacités de mouvement permettent aux patients, qui répondent positivement aux soins, d’être plus autonomes et d’améliorer leur tonus musculaire et leurs conditions générales. Un instrument en plus pour relever le défi contre la maladie de Parkinson.
« Un défi qui va se relever. Il faut aller à l’encontre de la maladie en étant conscient que la science marche à nos côtés et progresse de façon inexorable », affirme Lucilla Bossi, présidente de la Confédération parkinson Italia Onlus, l’organisation qui réunit 24 associations de volontaires locaux, qui sont engagées dans toute l’Italie, dans l’aide aux patients et à leur famille.
Ouest-France du 06/06/2012
Test d’un vaccin contre la maladie de Parkinson
La société de biotechnologie Affiris vient de lancer, en Autriche, le premier test d’un vaccin thérapeutique contre la maladie de Parkinson. Appelé PD01A, il s’attaque à une protéine, l’alpha-synucléine, qui joue un rôle important dans le développement de la maladie. Trente-deux patients vont être traités durant douze mois. Cette étude a reçu le soutien financier de l’acteur américain Michael J. Fox (Retour vers le futur), lui-même atteint de la maladie.
Transmis par Thérèse et Jean-Claude Moraines APIV.
Constipation, symptôme récurent de la maladie de Parkinson
Publié le 05 novembre 2012 à 07:57Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
Peu ou pas du tout évoquée, la constipation est un symptôme quasi systématique de la maladie de Parkinson. Un rapide sondage auprès de chacun, nous met très rapidement en contact avec cette difficulté désagréable et gênante.
Sans doute, sommes nous gênés pour en parler. La défécation n’est pas un thème que l’on aborde en public ni même en privé : c’est trop intime ; et pourtant, il faut bien en parler comme quelque chose d’important pour notre bien-être.
Pour ma part, j’ai cherché à résoudre cette difficulté de manière naturelle par un régime alimentaire à base de légumes, de fibres et même de cures de pruneaux ! Les selles sont plus régulières et molles mais cela n’empêche pas la formation systématique d’une sorte de bouchon très dur qui ne s’évacue qu’avec d’énormes efforts qui provoquent des hémorroïdes et même un début d’hernie inguinale.
J’ai essayé plusieurs traitements de la constipation, tel que « Microlax® ». Malheureusement, l’utilisation prolongée de ce type de laxatif est déconseillé car il irrite les intestins et l’anus. J’ai enfin été conseillé par mon neurologue qui m’a prescrit « Eductyl® ».
Il s’agit d’un suppositoire à base de glycérine que l’on peut utiliser régulièrement, ce que je fais chaque jour. Son introduction est facilitée par une forme particulière : il faut donc respecter le sens de l’introduction comme expliqué dans la notice. Il faut savoir qu’une fois introduit, il ne se passe pas plus de dix minutes avant d’aller à la selle.
Le suppositoire enrobe et dissout en partie le bouchon formé à l’avant des selles et permet de l’évacuer sans grosses difficultés, le reste des selles s’évacuant normalement suivant le régime alimentaire que l’on a ingurgité.
Cette régularité est un confort important pour le mieux-être : nous nous sentons si encombrés dans le cas contraire ! C’est pourquoi je me suis permis de donner ma « recette » pour résoudre cette difficulté très triviale mais ô combien gênante.
Le punding
Publié le 02 novembre 2012 à 08:52Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
Parmi les TCI (troubles du contrôle des impulsions) favorisés par les traitements dopaminergiques, on note habituellement : le jeu pathologique, les achats pathologiques, l’hypersexualité, les troubles du comportement alimentaire (boulimie nocturne ou grignotage fréquent de sucreries) et l’addiction à la lévodopa (syndrome de dérégulation dopaminergique). D’autres troubles ont été décrits, tels que des « errances » parfois loin du domicile, sans but identifié ou le développement d’une kleptomanie mais aussi le punding. Voici ce qu’en dit le Dr Virginie CZERNECKI.
Le punding se définit comme un comportement stéréotypé complexe, répété, non dirigé vers un but et s’inscrivant dans la durée. Il se caractérise par une intense fascination ou une attirance irrésistible vers des objets communs, tout à fait banals, qui sont sans cesse manipulés, examinés, collectionnés, triés, rangés… Le terme punding est dérivé de l’argot suédois et signifie littéralement « tête bloquée », en référence au fait que malgré l’inutilité de leur activité, ces patients persistent à l’accomplir. Ce comportement élaboré est souvent lié à une activité de plaisir idiosyncrasique préexistante.
[Idiosyncrasie : manière d’être particulière à chaque individu, qui l’amène à avoir des réactions, des comportements qui lui sont propres. Par exemple, dans le cas de punding, on parle de plaisir idiosyncrasique.]
Ces comportements répétés, dénués de sens, inutiles voire nuisibles et néanmoins irrépressibles, présentent des similitudes phénoménologiques fortes avec des troubles obsessionnels compulsifs (TOC). Or, la définition classique des TOC consiste en la présence d’évènements cognitifs intrusifs (obsessions), qui engendre un comportement répétitif intentionnel (compulsions), dans le but de neutraliser à la fois la pensée obsédante et l’anxiété associée à cette pensée. Ainsi, l’absence de pensées obsessionnelles et d’anxiété accompagnant le comportement de punding constitue un élément clé du diagnostic avec les TOC. En outre, l’inefficacité des antidépresseurs sur ces comportements constitue également un indice en faveur du diagnostic de punding.
Ces comportements surviennent généralement lors d’une augmentation de la posologie des traitements antiparkinsoniens. Les comorbidités fréquentes sont des insomnies, des dyskinésies, une hypersexualité ou une addiction à la lévodopa, sans doute liées à un dysfonctionnement des systèmes de la récompense. D’autres comportements de compulsion et de répétition peuvent survenir dans le contexte d’une augmentation de la pharmacothérapie dopaminergique, vraisemblablement par une surstimulation des récepteurs dopaminergiques dans les circuits mésolimbiques associés aux noyaux accumbens, conduisant à des comportements de recherche de nouveauté et de récompense. Le mécanisme physiologique serait proche de celui des dyskinésies dopa-induites, mais concernerait davantage les parties cognitives ou limbiques du striatum que le territoire moteur.
Le punding est un trouble comportemental sous-évalué dans la population parkinsonienne et son retentissement sur la vie sociale peut être désastreux. La prévalence s’élèverait jusqu’à 14%. Le neurologue doit être vigilant, lorsqu’un patient parkinsonien, dyskinétique, utilise de fortes doses de traitement dopaminergique ou réclame des doses supplémentaires et se plaint de troubles du sommeil ou d’une hyperactivité nocturne. Il est important de signaler au patient le lien entre une consommation importante d’un traitement dopaminergique et la survenue de ces troubles, de diminuer la prescription dopaminergique sans prescrire d’antidépresseurs et de traiter les troubles du sommeil.
V. Czernecki, INSERM U610, neuro-anatomie fonctionnelle du comportement et de ses troubles, pavillon Claude-Bernard, hôpital de la Pitié-Salpêtrière, Paris.
La Lettre du Neurologue – avril 2005
Lu par Guy Seguin guymaick@wanadoo.fr
Exploration des liens entre maladie de Parkinson et addictions comportementales, par l’exemple de jeu pathologique
Publié le 01 novembre 2012 à 09:50Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
Par Marie Grall-Bronnec, CHU Nantes
La maladie de Parkinson (MP), maladie neurodégénérative la plus fréquente après la maladie d’Alzheimer, entretient des liens étroits et complexes avec le jeu pathologique. La prévalence du jeu pathologique chez les patients parkinsoniens traités par agonistes dopaminergiques varie entre 2.3 et 8% bien supérieur à celle de la population générale. Il est possible d’envisager plusieurs modèles explicatifs de cette sur-représentation du jeu pathologique chez les malades de Parkinson.
1 – le jeu pathologique comme effet indésirable des médicaments de la MP.
L’association du jeu pathologique et de la MP est décrite pour la première fois dans la littérature scientifique il y a une dizaine d’années, sous la forme de rapports de cas. L’hypothèse d’une origine iatrogène découlait du constat que le jeu pathologique était secondaire à la MP, apparaissant ou s’aggravant sous l’effet du traitement dopaminergique. Le comportement pathologique survenait durant les phases « on » de la MP, chez des patients présentant des fluctuations motrices. Plusieurs autres études ont depuis décrits cette association, et la quasi-totalité des dopaminomimétiques est en cause dans le développement du jeu pathologique iatrogène. Le plus souvent, le médicament incriminé est un agoniste dopaminergique, dont le pramipexole©, le ropinirole©, le pergolide©, le piribédil© ou la bromocriptine©. A l’inverse, d’autres études ont aussi mis en cause la monothérapie par carbidopa/lévodopa. L’association de la carbidopa/lévodopa avec un agoniste dopaminergique, entraînant ainsi des problèmes de jeu par rapport à la monothérapie par l’un ou l’autre.
De façon plus générale, des troubles de contrôles des impulsions (incluant aussi hypersexualité, achats compulsifs, hyperphagie boulimique) sont décrits comme des effets indésirables des médicaments antiparkinsoniens.
2 – Le jeu pathologique comme conséquence d’un mésusage des médicaments de la MP
Une autre hypothèse pharmacologique apparaît rapidement après la précédente, celle d’un usage compulsif des médicaments dopaminergiques. Une équipe suisse a ainsi rapporté le cas de deux patients parkinsoniens, qui en raison d’une détérioration de leur maladie neurologique, s’auto-médiquaient avec leur traitement dopaminergique et développaient dans un second temps une pratique des jeux de hasard et d’argent. Les auteurs incriminaient un déficit du système de récompense dopaminergique lié à la MP, compensé par une sur-stimulation des récepteurs dopaminergiques, induisant une recherche de nouveauté accrue.
Cet usage compulsif de médicament fait partie du Syndrome de Dysrégulation Dopaminergique, associé à des effets indésirables moteurs (dyskinésies induites par la levodopa) et des effets indésirables comportementaux (troubles du contrôle des impulsions dont le jeu pathologique, hypomanie, hallucination). Le Syndrome de Dysrégulation Dopaminergique, induit par le traitement et auto-entretenu, serait le syndrome inverse de l’apathie. Il correspond à une hyperdopaminergie, sous-tendant la recherche de plaisirs sous toutes ses formes. Les médicaments dopaminomimétiques, dont la fonction est de corriger la déplétion dopaminergique, stimulent les voies dopaminergiques, dont celle du système de récompense, impliqué dans divers troubles addictifs, à l’origine du Syndrome de Dysrégulation Dopaminergique.
Ce syndrome peut être induit par tous les médicaments dopaminomimétiques. La définition d’un seuil, au-delà duquel il est possible d’évoquer un Syndrome de Dysrégulation Dopaminergique, est impossible compte tenu des grandes variations individuelles de la réponse thérapeutique aux médicaments dopaminergiques.
3 – Facteurs de risque de devenir joueur pathologique en cas de maladie de Parkinson
Comment expliquer que seule une minorité de malades de Parkinson développe cette complication ? Est-ce dû au traitement (molécules choisies, posologie employée) ? Est-ce dû au patient (facteurs de vulnérabilités individuels…) ? Est-ce dû à la MP (formes cliniques particulières…) ? Les données de la littérature ne permettent pas encore de répondre à toutes ces questions…
Pour certains, le pramipexole© constituerait l’agoniste dopaminergique le plus souvent incriminé dans le troubles du contrôle des impulsions, tandis que pour d’autres, il n’y aurait pas de différence entre les différents agonistes dopaminergiques. La levodopa et l’apomorphine seraient les molécules les plus impliquées dans le Syndrome de Dysrégulation Dopaminergique.
Des résultats contradictoires portent aussi sur la relation entre la posologie et l’induction du jeu pathologique. Pour certains, il existe une relation dose/effet des agonistes sur le développement du jeu pathologique. Pour d’autres, la plus faible dose d’agoniste utilisée suffit à déclencher un trouble du contrôle des impulsions. Certains affirment enfin l’absence de relation entre les doses prescrites et la survenue du jeu pathologique, évoquant une vulnérabilité sous-jacente.
Il a été proposé qu’un profil de patient parkinsonien serait plus susceptible de développer ce trouble addictif. On retrouve en particulier les caractéristiques suivantes : homme jeune, dont la MP débute précocement, avec un plus haut niveau de recherche de sensations, plus de difficultés à planifier, plus d’antécédents personnels ou familiaux d’abus d’alcool, plus d’épisodes (hypo-)maniaques iatrogènes. Ces données sont encore débattues.
4 – Aspects neurobiologiques du jeu pathologique associé à la maladie de Parkinson
Après une période de relative accalmie à l’instauration du traitement, pendant laquelle les symptômes sont bien compensés, la MP s’aggrave. On observe alors des troubles moteurs dopa-induits (fluctuations motrices et dyskinésies) et des troubles liés à l’évolution naturelle de la maladie (troubles dysautonomiques, troubles cognitifs et troubles psycho-comportementaux), le plus souvent dopa-résistants. Les troubles cognitifs présents chez les parkinsoniens non déments sont variés avec l e plus souvent une atteinte des fonctions exécutives et visio-spatiale, permettant l’organisation et la planification des actions.
A ce jour, peu d’études ont exploré les liens entre jeu pathologique et dysfonctionnement cognitif chez les parkinsoniens. L’une d’elles indiquait que le fonctionnement du lobe frontal était identique chez les patients souffrant ou indemne du jeu pathologique. Une autre, à l’inverse, concluait que les parkinsoniens souffrant du jeu pathologique, comparés à ceux indemnes du troubles addictifs, étaient moins performants sur certaines tâches cognitives, en particulier celles évaluant la mémoire visio-spatiale à long terme et plusieurs fonctions dépendant du lobe frontal. Les troubles des fonctions exécutives étaient les seuls facteurs prédictifs indépendants de la survenue du jeu pathologique chez les parkinsoniens non déments. Ces données prolongeaient les conclusions de travaux plus anciens, portant sur des joueurs pathologiques indemnes de MP, indiquant un lien entre jeu pathologique et dysfonctionnement frontal.
Enfin, le jeu pathologique survenant au cours de la maladie de Parkinson pourrait aussi être dû à la dégénérescence du striatum ventral bien moins sévère que celle du striatum dorsal, induisant une perte du système de récompense. Autrement dit, la prédisposition à développer le jeu pathologique au cours de la maladie de Parkinson pourrait ainsi être liée à une relative préservation du circuit mésocorticolimbique, malgré des altérations dues à la maladie du circuit nigrostriatal dorsal.
Très récemment, une étude de neuro-imagerie réalisée auprès de parkinsonien présentant en outre les critères diagnostiques du jeu pathologique, et comparés à des parkinsoniens indemnes et à des sujets contrôles, retrouvait une déconnection entre le cortex cingulaire antérieur et le striatum, spécifique du groupe présentant l’association des deux maladies. Les auteurs faisaient l’hypothèse que cette déconnection sous-tendrait une altération spécifique des capacités à changer de comportement en cas d’erreurs, expliquant ainsi pourquoi les parkinsoniens joueurs pathologiques persévèrent dans des comportements risqués en dépit des dommages occasionnés.
Conclusion
Par cette revue de la littérature scientifique, il apparaît donc que plusieurs pistes explicatives peuvent être retenues, qui ne sont pas exclusives les unes des autres. Ces pistes ouvrent des perspectives de recherche, afin de mieux parvenir à préciser quels sont, pour un malade de Parkinson donné, les risques individuels de développer le jeu pathologique. Il s’agira alors de mieux cibler les stratégies thérapeutiques, dans le but de prévenir l’apparition du jeu pathologique, ou du moins de le dépister plus précocement.
transmis par Guy Seguin, président ADPLA
Rédigé par Marie Bronnec
La greffe intracérébrale : comprendre et combattre le rejet.
Publié le 25 octobre 2012 à 07:46Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
La maladie de Parkinson est une maladie progressive caractérisée par la dégénérescence bilatérale des neurones dopaminergiques de la voie nigrostriée. La destruction des neurones dopaminergiques de la substance noire a pour conséquence une diminution de la sécrétion de dopamine au niveau du striatum.
Actuellement, il n’existe pas de traitement curatif de la maladie, mais différents traitements symptomatiques sont utilisés. L’administration par voie orale de L‑DOPA (lévodopa), précurseur de la dopamine capable de traverser la barrière hémato-encéphalique, est l’un des traitements les plus couramment prescrits. Un inconvénient majeur de la prise de L‑DOPA est l’apparition, au bout de quelques années, de dyskinésies (mouvements anormaux). Une autre stratégie basée sur la stimulation électrique du noyau subthalamique, montre une efficacité sur les troubles moteurs, dans la plupart des cas, mais les risques chirurgicaux et les critères d’inclusion en font une opération accessible à un très faible nombre de patients. De plus, de nombreux symptômes ne sont pas corrigés par ces thérapies.
Aussi, il apparaît important de poursuivre les recherches sur les stratégies restauratrices, notamment la greffe intracérébrale de neuroblastes.
Des neuroblastes mésencéphaliques issus d’embryons humains (8 à 9 semaines) et transplantés dans le striatum de patients parkinsoniens ont conduit à des améliorations cliniques basées, entre autres, sur la production de dopamine par les neurones greffés. Cependant, le recours à des embryons humains est freiné par des considérations éthiques et logistiques qui limitent l’accès à ces greffes. D’où l’intérêt d’utiliser des neuroblastes d’origine animale telle que le porc. En effet, le porc présente de nombreux avantages pour la xénotransplantation : un grand nombre d’embryons à chaque portée, une facilité d’élevage, la possibilité de contrôler la reproduction des animaux et de pouvoir pratiquer des manipulations génétiques. De plus, son cerveau étant de grande taille, les neurones porcins ont la capacité d’émettre des neurites sur de longues distances comme chez l’Homme. Une survie des cellules greffées, une réinnervation du striatum ainsi qu’une récupération des fonctions motrices ont été observées lors d’essais cliniques menés chez certains patients parkinsoniens traités par des immunosuppresseurs (molécules permettant de limiter l’activité du système immunitaire). Mais le problème rencontré reste le rejet de ces greffes.
En effet, en l’absence d’immunosuppresseur comme la cyclosporine A, les greffes de neuroblastes porcins dans le striatum de rat sont systématiquement rejetées au bout de 7 – 8 semaines. Les traitements par des immunosuppresseurs prolongent la survie de la greffe, mais de manière transitoire, de plus, utilisés à fortes doses, ceux-ci entraînent des effets secondaires, notamment une toxicité rénale. Il est donc important de comprendre et d’étudier les mécanismes en cause dans le rejet pour envisager une survie à long terme de la greffe.
Diverses études ont mis en évidence un rôle important de la réponse immunitaire cellulaire dans le rejet. En effet, en l’absence d’immunosuppresseur, on observe vers 7 à 8 semaines, une forte infiltration de la greffe par des lymphocytes T et des cellules dendritiques. Cette réaction immune est accompagnée d’une activation des cellules microgliales. Elle a pour conséquence le rejet de la greffe.
Outre la réponse cellulaire, il a été observé un dépôt d’anticorps et de complément au niveau du greffon. Cette observation suggère une réponse humorale, caractérisée par la production d’anticorps, dirigés contre la greffe, qui, à ce jour, a été très peu étudiée.
Une partie de mon travail au sein de l’INSERM U1064 de Nantes a eu pour but de caractériser le rôle de la réponse humorale dans le rejet des xénogreffes intracérébrales.
Les anticorps produits suite à la greffe vont venir se fixer sur les cellules porcines du greffon et le détruire. Nous avons pu mettre en évidence que la production d’anticorps augmentait en fonction du délai post greffe et du statut de la greffe. En particulier, une forte concentration d’anticorps est observée dans le sérum de rats pour qui la greffe est rejetée. Ces anticorps ayant la capacité de cibler différentes populations cellulaires telles que les neurones et les astrocytes.
Evolution de la production d’anticorps au cours des différents stades du rejet.
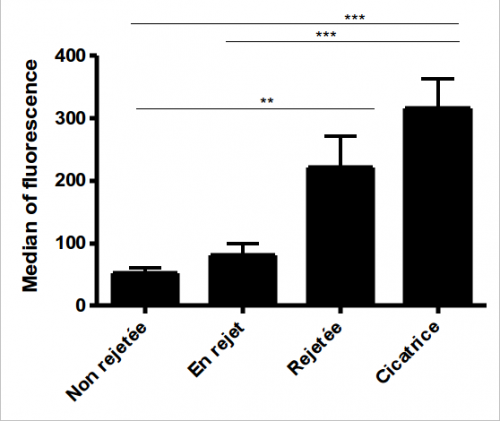
De plus, des résultats préliminaires ont montré une meilleure survie des xénogreffes dans des modèles de rats dépourvus d’anticorps. Ces données vont donc dans le sens d’un rôle de la réponse humorale dans le phénomène de rejet même s’il est important de confirmer ce résultat sur un plus grand nombre d’animaux.
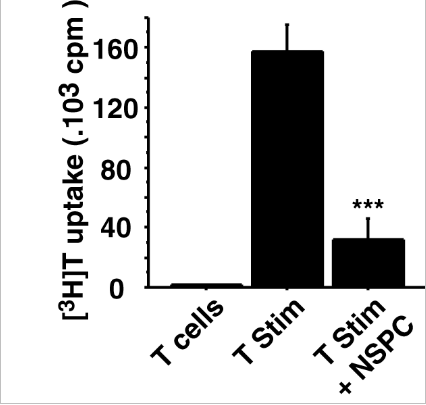
Une autre partie de mon travail a été d’envisager de nouvelles stratégies immunosuppressives afin de limiter le rejet, en particulier, par l’étude des propriétés immunosuppressives des cellules souches neurales. En effet, outre leur capacité de prolifération et de différenciation en neurones, une production de molécules immunomodulatrices par les cellules souches neurales permettrait d’induire au niveau du site de greffe une immunosuppression locale, limitant le recours à des immunosuppresseurs systémiques. Une première étude nous a permis de mettre en évidence que les cellules souches neurales de rat (NSPC) avaient des propriétés immunosuppressives limitant la prolifération des lymphocytes T, et que cet effet s’effectuait via l’hème oxygénase.
Inhibition de la prolifération des lymphocytes T par les cellules souches neurales de rat.
La suite de ce travail va se focaliser sur les propriétés immunosuppressives des populations de cellules souches neurales humaines dérivées d’IPSC (induced pluripotent stem cells). Cette étude est d’autant plus importante que l’utilisation des cellules souches neurales dérivées d’IPSCs humaines est une des voies thérapeutiques envisagées pour effectuer des auto- ou des allotransplantations à grande échelle. En effet, ces cellules sont issues de la reprogrammation de cellules somatiques adultes (ex : cellules de la peau) en cellules pluripotentes capables de s’auto-renouveler et de se différencier en différents types cellulaires. Elles peuvent donc être prélevées chez le patient pour être reprogrammées, différenciées en cellules souches neurales avant d’être greffées dans le cerveau de ce même patient (autogreffe).
La transplantation intracérébrale reste donc une thérapie prometteuse pour la maladie de Parkinson. Une meilleure compréhension des phénomènes du rejet et du potentiel immunosuppressif des cellules souches permettra d’envisager une survie à long terme de la greffe.
Je tenais à remercier tous les membres de l’association CECAP pour leur soutien dans la réalisation de ce travail.
Réalisé par Elodie Mathieux
Présentation de la maladie de Parkinson (seconde partie)
Publié le 21 octobre 2012 à 17:31Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
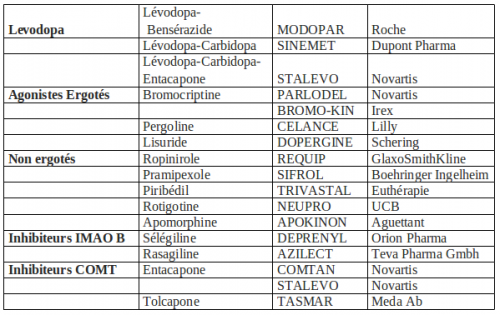
LES TRAITEMENTS DANS LA MALADIE DE PARKINSON
Actuellement on ne guérit pas la maladie de Parkinson, le traitement va chercher à compenser le déficit en dopamine :
- par voie orale : en apportant de la dopamine (Lévodopa) ou en stimulant directement les récepteurs dopaminergiques (agonistes) ou en réduisant la dégradation naturelle de la dopamine (IMAO B et ICOMT),
- par injection sous-cutanée (pompe à Apokinon©)
- par sonde gastrique (sonde à Duodopa),
- par intervention chirurgicale (stimulation cérébrale profonde).
La dopamine : La dopamine ne passe pas la barrière hématoencéphalique, la lévodopa, précurseur de la dopamine, est absorbée dans le duodénum et est ensuite décarboxylée en dopamine. La L‑dopa représente le traitement de référence et elle sera prescrite en première intention chez les patients de plus de 70 ans. Elle est le médicament le mieux toléré et dont l’effet moteur est le meilleur. En début de traitement, pour éviter les problèmes de nausées et chute de pression artérielle au lever, on prescrit du MOTILIUM©.
Les doses de L‑dopa seront progressives :
- une dose minimale de 300 mg/j pour pouvoir mesurer un effet,
- une posologie aux alentours de 500 mg/j est considérée comme moyenne,
- au-delà de 1000 mg/j, il s’agit d’une forte posologie.
Il est important de respecter les horaires de prescription (plus ou moins une ½ heure), jamais d’arrêt brutal (particulièrement en cas de chirurgie), prendre les doses de préférence une ½ heure avant les repas ou 1½ à 2 heures après les repas pour une meilleure efficacité.
Les effets secondaires : la L‑dopa :
- stimule les récepteurs dopaminergiques sur les artères (hypotension orthostatique),
- stimule les récepteurs du centre du vomissement situés à la base du cerveau (nausées, vomissements),
- stimule les voies de la motivation et du plaisir : risque de 15% chez les patients jeunes de troubles du contrôle des impulsions ou d’addictions au traitement ; risque de confusion et d’hallucinations chez le sujet âgé.
Les agonistes dopaminergiques : Les agonistes « miment » l’effet de la dopamine en stimulant directement les récepteurs dopaminergiques. Avantages : leur durée d’action est plus longue que la L‑dopa et permet de diminuer le nombre de prises. Inconvénients : on note une moindre efficacité sur les symptômes moteurs et des risques accrus : troubles de contrôle des impulsions chez le patient jeune, confusions, cauchemars, hallucinations chez le patient âgé. Parmi les agonistes on distingue :
- les dérivés de l’ergot de seigle qui présentent tous des risques sur le plan pulmonaire, rénal et cardiaque. On évite donc de les utiliser,
- les agonistes non ergotés. Il s’agit d’une famille hétérogène mais qui partage l’avantage sur les ergotés de ne pas induire de fibrose.
Les agonistes partagent les mêmes effets indésirables que la lévodopa mais avec une plus grande sévérité probablement du fait de la stimulation directe des récepteurs dopaminergiques. Comme pour la lévodopa, le sevrage doit être progressif. Quelque soit l’agoniste choisi : ne pas prescrire chez le sujet âgé ou en cas de troubles cognitifs, posologie progressive, hormis le cas particulier de l’apomorphine, ne pas associer d’agonistes dopaminergiques entre eux du fait du risque de potentialisation des effets indésirables, en particulier en cas de confusion hallucinatoire. Pour les agonistes non ergotés, on trouve : le ropinirole©, le pramipexole©, le piribédil©, la rotigotine© et l’apomorphine©.
L’apomorphine est un puissant agoniste d’efficacité comparable à la lévodopa. Elle est utilisée en administration sous-cutanée soit sous forme de stylo injecteur, soit sous forme d’ampoule pour utilisation de perfusion sous-cutanée en continu à l’aide d’une pompe. L’absorption sous-cutanée est rapide, l’efficacité motrice apparaissant dès les 10 à 15 minutes. Sa durée d’action est courte, de l’ordre 30 minutes à une heure, mais en terme d’efficacité, 10 mg d’apomorphine serait l’équivalent de 100 mg de lévodopa. Les troubles psychiques sont moindres qu’avec les autres agonistes.
Les inhibiteurs de la MAO B : La Sélégiline® (DEPRENYL©) et la Rasagiline® (AZILECT©) sont des inhibiteurs sélectifs de la MAO B (monoamine oxydase B) et donc réduisent la dégradation de la dopamine au niveau du cerveau et renforcent ainsi l’efficacité de la L‑dopa (10%). Les effets secondaires sont identiques à la lévodopa. On note un effet potentiellement « ralentisseur » pour la Rasagiline. Indications : soit en monothérapie (sans la lévodopa) pour un parkinson peu évolué, soit en association avec la lévodopa chez les patients présentant des fluctuations motrices de fin de dose.
Les inhibiteurs de la COMT : La COMT (cathécol-O-méthyltransférase) est une enzyme présente dans la paroi intestinale, elle diminue la biodisponibilité de la dopamine. En administrant un ICOMT avec la lévodopa, on augmente à la fois la biodisponibilité de la lévodopa et sa demi-vie.
L’entacapone® (COMTAN© ou STALEVO©) en association avec la lévodopa : augmente de plus de 10% l’efficacité motrice, colore les urines en jaune orangé ; effets indésirables : nausées, diarrhées, douleurs intestinales.
La tolcapone® (TASMAR©) : efficacité de 30%, soupçonné d’hépatotoxicité, nécessite un bilan hépatique ; effets indésirables identiques à tout traitement à la lévodopa.
L’amantadine® (MANTADIX©) : L’amantadine était utilisée comme antiviral. Son efficacité antiparkinsonienne a été découverte par hasard, elle est plus faible que celle de la lévodopa. Il a été montré un effet antidyskinétique intéressant. Sa demi-vie est longue ; pas de prise après 17H du fait du risque d’insomnie. Ses effets indésirables : hypotension orthostatique et nausées. Elle peut provoquer des hallucinations et des confusions.
La clozapine® (LEPONEX©) : La clozapine est le seul neuroleptique compatible avec un traitement antiparkinsonien. Elle est indiquée lors des psychoses dopa-induites dans la maladie de Parkinson. On a observé des effets antidyskinétiques. Elle est utilisée en cas de troubles hallucinatoires.
Pour tous les autres symptômes :
- constipation : laxatifs
- chute de tension : en priorité, utiliser des bas de contention puis Motilium, Gutron, Fludrocortisone
- Mouvements brusques ou agitation nocturne : RIVOTRIL en gouttes
- salivation excessive : injection botulique
- difficultés de mémoire, manque de motivation : EXELON
- anxiété, dépression : SEROPLEX, EFFEXOR
- sensation de déprime ou hallucinations : LEPONEX
- Freezing, instabilité ou chute : Kinésithérapie
- Voix chuchotée, difficile à comprendre : orthophonie
La pompe à apomorphine : La pompe délivre en permanence en sous-cutané de l’apomorphine, avec la possibilité d’ajouter une quantité supplémentaire (bolus) en cas de blocage. Elle s’adresse au patient fluctuant (phases ON/OFF) ou en cas de phases de dyskinésie prolongées. Elle permet : de réduire le traitement oral, d’améliorer la qualité de vie du patient et de renforcer son autonomie, de diminuer les fluctuations motrices, de diminuer progressivement les dyskinésies.
Le bénéfice thérapeutique est très net, l’impression clinique globale d’amélioration se situe entre 50 et 70%, tant d’après le patient que d’après son entourage. En dehors d’une détérioration cognitive sévère et de symptômes psychotiques, il n’y a pas de contre-indications, en particulier l’âge n’est pas une limitation. La pompe à apomorphine représente une alternative en cas de contre-indication à la stimulation cérébrale profonde.
La première mise en place nécessite un séjour hospitalier (environ 10 jours). Ensuite, au domicile, une infirmière ou une personne de l’entourage intervient pour la mise en place quotidienne de la pompe. Il faut compter près de 6 mois pour arriver au bon débit (environ 3 mg par heure). Elle est posée le matin au réveil et retirée le soir au coucher. Il faut éviter de la poser 24h/24h, sauf en cas d’akinésie douloureuse nocturne sévère, en raison du risque d’échappement thérapeutique au fur et à mesure du temps (perte de l’effet du traitement au fur et à mesure du temps lorsque la pompe est posée 24h/24). Il faut changer régulièrement de site d’injection pour éviter les nodules. Du fait de son coût, la pompe à apomorphine est mal acceptée dans les EHPAD (Etablissement hospitalier pour personnes âgées dépendantes).
La sonde à Duodopa : La sonde permet une administration intestinale en continu de lévodopa en suspension dans un gel. Elle assure un débit continu 24/24 H avec la possibilité de bolus si besoin. Cette technique est réservée au patient à un stade avancé, répondant bien à la dopathérapie : lorsqu’il n’y a pas de résultats avec les antiparkinsoniens oraux, lorsque la pompe à apomorphine est mal tolérée ou insuffisamment efficace, lorsque le patient est exclu de la stimulation cérébrale profonde.
Après des tests à l’aide d’une sonde nasoduodénale pour mesurer l’efficacité de la Duodopa, une sonde à demeure est mise en place lors d’une gastrotomie endoscopique percutanée. La Duodopa en continu permet de réduire les périodes OFF aussi bien que les dyskinésies. Les contre-indications sont les mêmes que celles de la lévodopa. L’utilisation de cette technique est limitée par son coût.
La stimulation cérébrale profonde : Avant la découverte de la dopathérapie, le traitement neurochirurgical de la maladie de Parkinson se limitait à de la chirurgie lésionnelle, jusqu’aux années 1970/1980. Puis vers les années 1990, face aux limites du traitement dopaminergique et grâce aux progrès de la connaissance et des techniques, la stimulation cérébrale profonde (SCP) a pu être envisagée.
Au niveau des ganglions de la base, le déficit en dopamine de la voie négrostriée entraîne une hyperactivité du pallidum et du noyau subthalamique. Le courant électrique de la stimulation à haute fréquence inhibe la suractivité de ces zones et permet d’améliorer les symptômes moteurs parkinsoniens. La 1ère SCP a été pratiquée en 1993 à Lyon.
La stimulation cérébrale profonde se fait sur 3 cibles précises :
- le thalamus : la stimulation du noyau central intermédiaire du thalamus (VIM) permet de contrôler le tremblement de repos et s’adresse à des patients présentant un tremblement invalidant résistant au traitement à la lévodopa,
- le pallidum : la stimulation du globus pallidum interne (GPI) a une action efficace sur les dyskinésies. Elle est indiquée chez les patients présentant une contre-indication au NST. Elle est réalisable jusqu’à l’âge de 75 ans, sous réserve d’un bon état général. Elle ne permet pas de réduire le traitement.
- le noyau subthalamique (NST) : la stimulation bilatérale du NST est la stimulation de référence, elle est la plus pratiquée. Elle permet d’améliorer l’ensemble des symptômes moteurs de la triade parkinsonienne, elle est efficace dans 8 cas sur 10. Elle n’est pas efficace sur les troubles non dopaminergiques (freezing, dysarthrie…). Le rapport bénéfice/risque doit être bien évalué. Moins de 10% des malades peut prétendre à la SCP du NST. Le patient doit répondre à des critères stricts : présenter un parkinson idiopathique sans aucun autre argument en faveur d’un autre syndrome parkinsonien, sujet jeune de préférence, en tous les cas inférieur à 65/70 ans, avoir au moins 5 ans d’évolution de la maladie, présenter des dyskinésies et des fluctuations motrices, avoir une bonne réponse à la dopathérapie, n’avoir aucun trouble cognitif, pas de signes axiaux en condition ON, pas de troubles psychiatriques, pas de maladie générale grave.
La chirurgie n’est pas une solution miracle et ne fera pas du patient un homme nouveau. L’amélioration apportée se limite au mieux atteint avec le traitement à la lévodopa.
L’opération se déroule en plusieurs étapes : un repérage par IRM 3 ou 4 mois avant, l’implantation des électrodes (1,27 mm de diamètre). L’intervention dure en moyenne 5h sous anesthésie locale. Le malade ne doit pas bouger mais participe activement. La pose du stimulateur en région sous claviculaire sous anesthésie générale (SOLETRA – KINETRA). La durée des piles varie entre 6 et 10 ans.
Les étapes du suivi : opérabilité, bilan d’inclusion, chirurgie, contrôle à 3, 6 et 12 mois
Parmi les effets secondaires, on note : complications motrices, instabilité posturale, difficulté d’initiation au pas, freezing, festination, chute, dysarthrie (trouble de l’articulation), accès de confusion, perte de motivation, syndrome dépressif, aggravation des capacités de concentration.
Par Tiphaine ROUAUD, neurologue à l’hôpital de NANTES
Intervention à la Maison des Aidants à Nantes en janvier 2012.
Présentation de la maladie de Parkinson (première partie)
Publié le 18 octobre 2012 à 08:41Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
PRESENTATION DE LA MALADIE DE PARKINSON
Par Tiphaine ROUAUD, neurologue à l’hôpital de NANTES
Intervention à la Maison des Aidants à Nantes en janvier 2012.
I – COMPRENDRE LA MALADIE
Définition : la maladie de Parkinson est une affection neurodégénérative qui se caractérise par des troubles moteurs (tremblement, akinésie et hypertonie) et des troubles non moteurs (troubles de l’odorat, troubles gastro-intestinaux, dysautonomie). Les troubles moteurs sont la conséquence d’un déficit de dopamine dans le striatum. Ce déficit en dopamine résulte de la dégénérescence progressive des neurones dopaminergiques de la substance noire.
Fréquence : 2ème maladie neurodégénérative après Alzheimer, on compte plus de 150000 parkinsoniens en France. Elle concerne plus de 2% des hommes de plus de 65 ans et un peu moins pour les femmes.
Origine : l’origine est mal connue. Il existe des formes génétiques (5 à 10%), une dizaine de gènes ont été identifiés. On a aussi évoqué l’implication de substances neurotoxiques : les pesticides sont les seuls facteurs de risque reconnus. Dans la plupart des cas, il y aurait une combinaison d’une susceptibilité individuelle (facteurs génétiques) et de facteurs environnementaux.
Rôle de l’alpha-synucléine : Dans la maladie de Parkinson, on constate une accumulation anormale d’une protéine, l’alpha-synucléine. Cette protéine naturellement présente dans le cerveau ne serait plus éliminée et se concentre sous la forme d’agrégats dont la toxicité entraînerait la mort neuronale. Or, ces agrégats se retrouvent précocement au niveau du bulbe olfactif et dans le système nerveux entérique, avant même l’atteinte de la substance noire. Les atteintes du bulbe olfactif et du système nerveux entérique expliqueraient en partie le manque d’odorat et les troubles gastro-intestinaux (dont la constipation), très fréquents et précoces dans la maladie. D’où l’hypothèse d’une implication d’un toxique environnemental, inhalé ou ingéré, qui traverse la muqueuse nasale ou la barrière épithéliale intestinale.
L’effet protecteur du tabac est très discuté : le tabagisme serait protecteur chez les sujets jeunes mais ne le serait plus chez les sujets âgés.
Déclaration : avec un âge moyen de début entre 57 et 62 ans, rare avant 40 ans (moins de 10% ces cas), la maladie débute rarement après 80 ans (moins de 10% des cas). 80% des cas débutent entre 40 et 75 ans.
Comment apparaît la maladie ? Dans la maladie de Parkinson, l’atteinte n’est pas limitée à la substance noire. Elle affecte d’autres structures ce qui explique les aspects non moteurs. La maladie débute par :
- le bulbe olfactif : perte de l’odorat,
- le noyau dorsal du vague : troubles gastro-intestinaux (dyspepsie, ralentissement de la vidange gastrique, constipation), troubles cardio-vasculaires (hypotension orthostatique), troubles vésico-sphinctériens (mictions fréquentes, urgences mictionnelles)
- le complexe coeruleus/subcoeruleus : perturbation du sommeil (rêves nocturnes agités).
Elle atteint la substance noire dans un second temps, puis les structures qui régissent l’équilibre, la qualité de la parole, la déglutition, les capacités attentionnelles, le raisonnement et les émotions. Ces symptômes ne sont pas dopa sensibles, d’où l’importance de la kinésithérapie et de l’orthophonie.
Le début de la maladie est progressif. Lorsque l’on pose un diagnostic, la maladie est installée depuis au moins 6 ans et environ 70% des neurones dopaminergiques de la substance noire sont détruits. Le diagnostic est clinique et ne justifie aucun examen complémentaire. Les 3 signes majeurs sont :
- le tremblement, présent dans 70% des cas, est un tremblement de repos, il apparaît lorsqu’il y a relâchement musculaire et disparaît lors de l’exécution d’un mouvement volontaire. Il peut être unilatéral ou très asymétrique. Il concerne la main, le poignet ou un membre supérieur ou inférieur. Le tremblement à tendance à s’aggraver en cas de stress,
- l’akinésie, difficulté à initier ou à exécuter un mouvement,
- l’hypertonie extrapyramidale ou rigidité.
L’akinésie et la rigidité se traduisent par une gêne à exécuter des mouvements volontaires accompagnées d’un ralentissement et d’une réduction de l’amplitude des mouvements. On relève une perturbation dans l’exécution des mouvements automatiques : perte de la gestuelle, de la mimique (visage inexpressif), perte du balancement d’un bras à la marche. Parfois la micrographie apparaît précocement avec une écriture de plus en plus petite où les lettres tentent de se télescoper. La perte des automatismes oblige le patient à penser chacun de ses gestes et rend difficile l’exécution de deux actes simultanément.
Les signes non moteurs :
- perte de l’odorat,
- troubles du sommeil,
- douleurs : pseudo sciatique, douleurs au niveau des cervicales ou des épaules, crampes dans les mollets la nuit, orteils en griffe le matin,
- troubles végétatifs : digestion (inconfort gastrique, remontées acides, constipation), urinaires (mictions nocturnes, urgences), génitaux (problème de l’érection), vasculaires (chute de tension), sudation (sensation chaud/froid, transpiration excessive).
Comment évolue la maladie ? On distingue 3 phases :
- phase de bon contrôle, dite « lune de miel » qui peut durer 6 – 7 ans ou plus. Période pendant laquelle on constate une bonne efficacité du traitement et permet au patient de mener une vie pratiquement normale,
- phase des fluctuations motrices et dyskinésies. Au cours de la 2ème période, les complications motrices liées aux traitements apparaissent avec durant la journée des moments de bonne mobilité (on) et des moments de mobilité réduite (off) et également des dyskinésies, mouvements involontaires souvent plus gênants pour l’entourage que pour le malade lui-même. On explique ces fluctuations par la réduction de la capacité de stockage de la dopamine (la perte des neurones dopaminergiques) et aussi par une saturation au niveau des synapses des récepteurs dopaminergiques.
- phase d’aggravation des signes axiaux et des capacités d’organisation de la pensée. Progressivement, les signes tardifs accentuent le handicap : troubles de la marche (freezing, festination), troubles de la posture (dos voûté), troubles de la parole et de la déglutition. C’est à ce stade que les troubles cognitifs et psychiques sont susceptibles de se majorer.
- Au dernier stade, la marche est devenue impossible, le patient a perdu toute autonomie et il doit être aidé pour les gestes de la vie quotidienne. Les déformations articulaires et les douleurs augmentent le handicap.
Chaque patient est différent et développe son propre parkinson. Le niveau de handicap varie d’un patient à l’autre ainsi que la vitesse de progression. Il existe des formes d’évolution lente et des formes d’évolution rapide.
Informations régionales : le Finistère (gp29)
Publié le 15 octobre 2012 à 11:08Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
Rentrée studieuse et sportive dans le Finistère
Il a été décidé la création d’une nouvelle activité : « la marche nordique ». Annick Jaouen responsable du point-rencontre de Morlaix a testé cette technique de marche avec un groupe de marcheurs très motivé. Plus dynamique que la randonnée, la marche nordique a pour principe d’accentuer le mouvement de balancier naturel des bras à l’aide de deux bâtons. Le corps est ainsi propulsé vers l’avant. On va plus vite, plus loin avec moins de fatigue. Le plaisir de la pratique arrive dès les premières foulées car la technique est simple. Grâce aux bâtons, tous les muscles du corps sont sollicités. Le premier rendez-vous est fixé le 3 septembre 2012, cette activité est encadrée par un éducateur sportif qui adaptera les séances pour les Parkinsoniens, aidants et autres participants. Elle aura lieu dans un premier temps autour de Morlaix (ancienne voie de chemin de fer Morlaix / Carhaix aménagée en voie piétonne).
Les séances de gymnastique collective encadrées par un kinésithérapeute dans notre département remportent un succès. Nous étudions la possibilité de constituer un autre groupe de gymnastique sur Plouguerneau en partenariat avec le CLIC de Lesneven / les abers.
Notre Conférence automnale aura lieu le 20 octobre 2012 au Juvénat à Châteaulin et sera animée par Mme Véronique Rolland Orthophoniste à Rosporden certifiée dans la méthode LSVT et Mr Fabrice Bruel Kinésithérapeute à Lesneven.
Nous espérons que notre Projet « lundis de la santé » à Brest sur Parkinson sera retenu (avril 2013). Une réunion du « pôle Santé » se tiendra à la mairie de Brest courant novembre 2012.
Repas du 16 Juin 2012 à Châteauneuf du Faou : C’est toujours avec autant de plaisir que nous nous sommes retrouvés, avant la trêve d’été, autour d’une bonne table à Châteauneuf du Faou. Une nouvelle fois, Michel Margerte et son équipe nous ont merveilleusement préparé cette journée avec, cerise sur le gâteau : un orchestre d’orgue de Barbarie « sur un air d’autrefois » qui nous a accompagnés tout l’après-midi. Petit à petit, les uns chantaient, les autres dansaient sur des rythmes bien connus, tous avaient le sourire ! Comme cela fait du bien de fredonner des airs de sa jeunesse ! Bref, c’était la fête… on aurait aimé qu’elle dure longtemps ! Merci à tous pour cette belle journée. La promesse sera tenue… Nous nous retrouverons l’année prochaine…
Dominique BONNE, Président du GP29
Le parkinsonien indépendant n° 50 : éditorial
Publié le 15 octobre 2012 à 10:34Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre2012
Une revue consacrée à un rappel des éléments constitutifs de la maladie :
En effet, il nous est apparu judicieux de « redire la maladie et ses incidences » car un certain nombre des lecteurs sont de nouveaux « intéressés », récemment diagnostiqués et qui n’ont pas eu l’occasion de lire nos précédentes publications. Et puis, ça ne fait pas de mal de refaire de temps en temps le point sur les descriptions de la maladie avec de nouvelles voix qui ont le mérite de faire le point sur les dernières nouveautés.
Ainsi Thiphaine Rouaud, neurologue au CHU de Nantes, nous présente son regard sur la maladie et les dispositifs pour la combattre. Elodie Mathieu, jeune chercheuse de l’INSERM U1064 financée par CECAP Recherche, évoque le problème de la greffe intracérébrale et de son rejet par l’organisme objet de sa recherche.
Jean Pierre Lagadec et Renée Dufant évoquent un symptôme insuffisamment évoqué : le syndrome des jambes sans repos. Puis deux articles s’intéressent à des phénomènes psychologiques : Marie Bronnec, psychologue au CHU de Nantes, nous parle du lien entre le traitement de la maladie et le jeu pathologique et Guy Seguin nous communique un article sur un phénomène quasi inconnu le Punding proche des T.O.C. (Troubles Obsessionnels Compulsifs). Enfin, je vous évoque le phénomène de constipation et un moyen de la combattre.
Ce n’est pas très « emballant » comme programme, je vous le concède. Mais il semblait important de faire le point sans promesse de découvertes sensationnelles – il n’y en a pas à ce jour ! – ou la mise sur le marché de nouvelles molécules. Pourtant nous reproduisons deux articles qui ouvrent des perspectives en matière de soin (la stimulation mécanique plantaire) et de prévention test d’un vaccin thérapeutique), proposés par Jean Claude Moraines.
Recherche adhérent motivé pour renforcer notre équipe !
L’âge fait ressortir les méfaits de la maladie auprès de nos membres atteints par Parkinson et ils demandent à être déchargés d’une responsabilité trop lourde : Jean Maigné, Henri Minaret et Jackie Auger souhaitent prendre une « retraite » bien méritée… Nous leur devons beaucoup – depuis plus de dix ans pour certains – en tant que soutien et accompagnement de notre épopée ! Qu’ils en soient ici remerciés avec chaleur.
Nos statuts nous permettent de continuer notre route. Mais il est indispensable de penser la « relève » : un ou deux jeunes, diagnostiqués récemment, seraient les bienvenus. Cela donnerait du sang neuf à notre revue. Mais il faudra être coopté par les autres adhérents : c’est la spécificité de notre association. Qui seront les prochains équipiers de l’AGP ? Nous en parlerons à la prochaine Assemblée Générale qui se déroule le 2 octobre prochain.
Informations régionales : Association Parkinson du Morbihan (56)
Publié le 20 septembre 2012 à 07:35Article paru dans LE PARKINSONIEN INDÉPENDANT n°49 – juin 2012
3 Février, Mr STAGLIATI kinésithérapeute, nous informait des bienfaits de la Réflexothérapie chez le Parkinsonien.
29 Février, l’Agence Régionale de Santé de Rennes, nous conviait à un débat sur la « place du patient dans la recherche clinique ». Occasion de préciser le rôle du patient et sa nécessaire contribution dans le développement de la recherche clinique, pour aboutir demain, aux possibilités de guérison. Le patient est « chercheur », c’est à partir des besoins qu’il exprime que se fait le travail, la progression, l’échange avec les professionnels de santé.
16 Mars, Journée du Sommeil à Rennes, les intervenants (pneumologue, psychiatre, neurologue) nous ont démontré que le sommeil est indispensable à la vie, qu’il a une fonction restauratrice de l’organisme, du système nerveux central, qu’il joue un rôle important dans la concentration, l’apprentissage, la mémorisation, l’attention. Un bon sommeil est un facteur de performance physique et sportive mais aussi intellectuelle et cognitive.
24 Mars, participons au Neurodon au Carrefour Le Fourchêne/Vannes, manifestation pour sensibiliser le public sur les différentes pathologies neurologiques et le besoin de finances pour la recherche.
31 Mars, invités par l’ARSEP à la 5ème rencontre sur la Sclérose en plaques. Maladie invalidante touchant des patients très jeunes. Certains symptômes sont similaires à ceux du Parkinson. Le Centre de Secours de Lorient proposait une formation gratuite sur la méthode de « Heimlich ». Un représentant de l’association y assistait.
14 Avril, France Parkinson nous invitait à la journée mondiale Parkinson. Le Dr Drapier du CHRU Pontchaillou à Rennes, nous a entretenu sur la pompe à apomorphine, son utilisation, ses bénéfices, ses effets secondaires.
10 Mai, notre Assemblée Générale s’est tenue à NOSTANG. Le quorum étant atteint (8 pouvoirs, 34 présents) lecture a été faite des différents rapports, et ceux-ci adoptés à l’unanimité. Le bilan 2011 est satisfaisant, nos actions auprès des services d’aide à la personne, du milieu hospitalier portent leurs fruits et nous encouragent à mettre en place d’autres interventions pour 2012, bon résultat de nos réunions malades/aidants. Le Bureau est reconduit dans ses fonctions. Un succulent repas, des chansons, la danse clôturaient cette journée, maussade à l’extérieur, mais tellement chaleureuse à l’intérieur.
BONNES VACANCES A TOUS
La Secrétaire ADPM – Françoise Vignon
Informations régionales : Association de parkinsoniens de Loire-Atlantique (44)
Publié le 26 août 2012 à 10:53Article paru dans LE PARKINSONIEN INDÉPENDANT n°49 – juin 2012
Le 31 mars, nous avons eu la participation la plus faible pour notre assemblée générale. Une cinquantaine de personnes présente dont 41 adhérents (plus 12 pouvoirs). Est-ce la nouvelle formule ? La réunion se tenait le matin pour pouvoir ensuite partager le repas du midi. Ceux qui sont restés ont apprécié cette manière de faire. Encore une fois nous devons reconnaître qu’il n’est pas facile de trouver de la relève au conseil d’administration : une seule personne, Fernande Auger, s’est présentée pour quatre membres sortants. Nous repartons donc avec un CA de 11 administrateurs, le bureau reste inchangé.
Laurent Lescaudron est intervenu pour nous parler de la recherche et plus spécialement des modifications au niveau de l’INSERM de Nantes. Pour des raisons budgétaires, l’équipe qu’il anime n’est pas reconduite afin de mieux regrouper les lieux de recherche. Se définissant comme « transplanteur », il va continuer sa recherche sur la médecine réparatrice et régénératrice à partir des cellules souches mais cette fois-ci au niveau du disque intervertébral en intégrant l’unité 791, située à la faculté d’odontologie de Nantes. Quant à ce qui concerne les maladies neurodégénératives (Parkinson-Huntington), il va poursuivre son travail aux USA, au sein de l’université de Central Michigan où il est professeur associé depuis une dizaine d’années. La recherche n’est pas close à Nantes, Philippe Naveilhan et Isabelle Neveu vont rejoindre l’U913 où Michel Neunlist et Pascal Derkinderen travaillent sur les neuropathies du système nerveux entérique (cf. le deuxième cerveau et la découverte d’agrégats anormaux d’alphasynucléine dans les neurones du système digestif). De son coté, le Pr. Philippe Damier continue la recherche clinique au sein du Centre d’Investigation Clinique de Nantes.
Quatre-vingt personnes ont assisté à la conférence sur la maladie de parkinson et les addictions. Le Dr Marie Bronnec qui travaille au centre d’addictologie de l’hôpital St Jacques dans le service du Dr Vénisse était accompagnée du Dr Caroline Vigneau, pharmacien maître de conférences au service de pharmacologie du Pr. Jolliet au CHU de Nantes. Le sujet abordait les troubles du contrôle des impulsions, en particulier le jeu pathologique, pouvant être en lien avec les traitements antiparkinsoniens (voir l’article dans ce numéro). Dans les troubles du comportement pharmaco- induit communs à la L‑Dopa et aux agonistes, avec une sévérité plus grande pour ces derniers, on trouve : le jeu pathologique, l’hypersexualité, l’augmentation de la libido, le « punding » (comportement répétitif sans but), les achats compulsifs. Ces effets de classe des médicaments dopaminergiques sont inscrits comme effets indésirables sur les notices. Toutefois il a été bien précisé dans la discussion, si l’on soupçonne un effet secondaire à la prise d’un médicament, ne pas hésiter à en parler avec son médecin généraliste et à remonter l’information auprès du centre de pharmacovigilance.
L’association organise des rencontres pour ces adhérents : le 16 juin une sortie festive à Sucé Sur Erdre et le 15 septembre la journée « Paroles et Echanges » avec pour thème l’ergothérapie et les aides techniques.
Guy Seguin, président
Informations régionales : Association de parkinsoniens d’Ille et Vilaine (35)
Publié le 16 août 2012 à 07:14Article paru dans LE PARKINSONIEN INDÉPENDANT n°49 – juin 2012
Le 3 mars avait lieu notre Assemblée Générale habituelle suivie d’un bon repas habituel avec animation de chants de marins. 51 adhérents avaient répondu présent. Une minute de silence a été observée pour nos adhérents décédés depuis la dernière AG. Les rapports habituels ont été lus et acceptés à l’unanimité des présents ou représentés. Nous soulignons la présence du CECAP, Raymonde et son mari, et de notre Association au Salon Autonomic de Rennes en septembre 2011. Le Pr. Vérin est venu présenter la création de l’Institut de Recherches Neurosciences pour l’Ouest. Il s’agit d’un projet pour améliorer l’accueil des malades, l’accompagnement pendant les hospitalisations et le regroupement des intervenants médicaux pour une meilleure prise en charge des malades concernés par les affections du cerveau. La recherche de mécénat est surtout prioritaire pour mettre en place et faire fonctionner cette institution. Puis Mme Neumager, sophrologue est venue présenter la sophrologie qui est aussi utilisée dans le cadre de la neurostimulation. Nous notons la présence de Raymonde Jacquemart et de son époux à notre AG et nous les remercions d’avoir fait le déplacement.
Président de l’Association de Parkinsoniens d’Ille-et-Vilaine (APIV), j’ai promis à Thérèse, mon épouse, que je quitterai la Présidence en 2012. Promettre est une chose, tenir sa promesse en est une autre et le lecteur sait qu’il est difficile de mettre la main sur celui ou celle qui donnera de son temps pour une suppléance, un poste d’administrateur, une présidence…
La difficulté est encore plus grande lorsqu’il s’agit d’une association comme la nôtre, car cette association revendique l’aide, la défense et le soutien aux malades, loin de toute considération de flatterie ou de flagornerie. En un mot il me fallait trouver, à défaut d’une perle rare, l’homme ou la femme qui me remplacerait.
En fait je l’ai désigné, ce qui est encore plus simple. Il a bien voulu accepter et a pris ses fonctions lors de notre AG de mars. Le nouveau conseil d’administration se compose ainsi pour les postes principaux :
- Président : Yves Boccou
- Vice-présidents : Jean Maigné, Bernard Marchand
- Trésorier : Raymond Le Seyec
- Trésorière adjointe : Bernadette Guérin
- Secrétaire : Jean-Claude Moraines
- Secrétaire adjointe : Claudine Bodin.
Il est à noter que nous avons un nouveau secteur couvert par Bernard Daco et François de l’Espinay pour le secteur de Brocéliande jusqu’alors non couvert. Les secteurs de Rennes, Vitré, Saint-Malo, Redon, Fougères continueront de voir notre présence.
Ex-Président et nouveau secrétaire de l’APIV, je lui mets le pied à l’étrier en espérant qu’il aura soin de défendre nos valeurs communes en soutenant toute initiative ayant pour but d’apporter le bienfait à nos adhérents. Je continuerai, en compagnie des membres de l’équipe statutaire à lui apporter notre aide en ce sens.
Jean-Claude Moraines
Je suis donc Yves Boccou, jeune retraité, atteint de la maladie depuis six ans et qui profite de « sa lune de miel » pour donner du temps à notre association. Vous saurez tout de moi en apprenant que je me soigne, outre les médicaments, par la pratique quotidienne de la marche (je reviens d’un périple : Puy-en-Velay/Saint-Jacques-de-Compostelle) et par de multiples activités associatives qui m’ont fait hésiter à m’engager dans l’Association. Je compte sur l’appui du Conseil d’Administration pour continuer les actions de notre mouvement associatif et bénévole. Reste à concrétiser !
Yves Boccou
Informations régionales : Association de parkinsoniens de l’Hérault
Publié le 14 août 2012 à 09:14Article paru dans LE PARKINSONIEN INDÉPENDANT n°49 – juin 2012
Notre « petit » comité de BEZIERS s’agrandit de nouveaux adhérents : 6 de plus ! Avec nous, ils font du qi gong et à partir du 17 février de la Musicothérapie ; la plupart viennent avec leur conjoint. Nous envisageons la reprise des randonnées… Sous notre beau soleil ! (nous, la neige, elle nous oublie, tant mieux).
Le 3 février 2012, nous avons tenu notre ASSEMBLEE GENERALE (au Vésuvio, restaurant de SERVIAN); après lecture du rapport moral par Mme GALAN Dany, notre présidente, et quelques mots de bienvenue, la lecture du rapport d’activité a été suivie du rapport financier par la trésorière, Mme VIANES Claude. Le bureau sortant étant démissionnaire, il a été fait appel aux bonnes volontés. Sur proposition, l’ancien bureau est réélu à la majorité, Lundi 20 février 2012, il sera procédé à l’attribution des différents postes.
- Présidente : Mme Galan Danièle
- Vice-président : Mr Vianes Sylvain
- Secrétaire : Mme Argento-Tolo Lyria
- Secrétaire adjointe : Mme Perez Mercédès
- Trésorier : Mme Vianes Claude
- Trésorier adjoint : Mme Quesnel Agnès
- Membres du bureau : Mme Garcia Noëlle et Mme Segura-Font Georgette
- Membre d’honneur de l’association biterroise : Mr Dagany Jean
Nous avons pas mal d’occupations à venir, préparant la JOURNEE MONDIALE de PARKINSON pour nous le 14 avril 2012 avec un spectacle encore plus important que l’an passé ! De quoi faire parler de nous…
Journée maladie de Parkinson
Cela faisait des mois que nous préparions cet après-midi récréatif, et ça y est le jour était arrivée ! Nous nous sommes beaucoup démenés afin d’obtenir des lots pour une belle tombola (surtout Agnès, bravo !) plusieurs groupes artistiques se sont proposés, l’orchestre HARMONIE intercommunale de SERVIAN, les chorales LA MUSICA et IVORIA le groupe IBERIA danses sévillanes ont retenu notre attention, et nous n’avons pas été déçus, le public ravi, enchanté ! Les pâtisseries faites par nous-mêmes couvraient une grande table, les boissons au frais, quel bonheur tout a été vendu. Sur une autre table de la documentation sur la MP et des photos de nous dans nos activités.
14 H 30 quelques personnes ont pris place sur les chaises, nous avons une certaine angoisse, allons-nous réussir à faire se déplacer 30, 50 personnes ? (la salle en contient 200 !) 15 H la salle est pleine, plus une chaise libre. Le spectacle commence avec 3 « sévillanes » très applaudies, puis, nous sommes 15 à monter sur scène et faire une démonstration de 10 mn de QI GONG avec Christian notre professeur et Béa. Puis ce sont les chorales, l’orchestre avec ses cuivres, ses cordes : grandiose ! C’est le mot que j’ai entendu dire par un spectateur. Un grand succès pour les artistes, et pour nous. Nous avons pu verser 765€ au fond Reherche CECAP.
Nous avions réussi notre but : nous faire connaître, montrer aussi que nous malades nous ne baissons pas les bras et que nous pouvons avec des moments comme celui-ci, allumer des lumières dans les yeux comme cela en a allumé dans les nôtres. Merci à tous, au public nombreux, aux collègues Parkinsoniens et accompagnants de notre comité de BEZIERS, et aux artistes qui bénévolement nous ont fait tous rêver…
A P H Béziers MVA rue Général Margueritte 34500 BEZIERS Tel 06 81 96 55 54 // 06 72 61 70 23
La secrétaire Lyria Argento Tolo
Informations régionales : Finistère (29)
Publié le 13 août 2012 à 07:15Article paru dans LE PARKINSONIEN INDÉPENDANT n°49 – juin 2012
Le 3 mars 2012 notre Assemblée Générale s’est déroulée au Juvénat de Châteaulin. Claire Ducros a annoncé sa démission au poste de présidente ainsi que Christian Le Bihan qui laisse son poste de comptabilité. Voici le nouveau bureau bien étoffé : Président Bonne Dominique, Vice-présidente Ducros Claire, Vice-président Le Mignon Yannick. Secrétaire Six Emilienne, Secrétaire adj. Nezou Francine, Trésorière Roch Marceline, Trésorier adj. Boudehen Michel ainsi que 16 membres actifs.
Le 16 mars 2012 une conférence « Vivre son Parkinson au quotidien » a eu lieu à Lannilis en collaboration avec le CLIC de Lesneven/Les Abers, deux étudiants en licence Pro ( travailleurs sociaux ) et le docteur Françoise Duquesne médecin gériatre au CHRU de la Cavale Blanche de Brest. 90 personnes se sont déplacées pour suivre cette conférence. Le médecin a mis l’accent sur l’importance de garder une vie sociale active, sur la prise en charge pluridisciplinaire du malade et sur le rôle de l’aidant, en le mettant en garde sur le risque d’épuisement.
L’association a participé au NEURODON 2012 à Quimper, Quimperlé et Brest qui a eu lieu le samedi 17 mars 2012. Le montant de la collecte du Finistère a augmenté d’au moins 13%. Nous remercions les quelques personnes de l’association pour s’être mobilisées.
Le dimanche 25 mars 2012 par une matinée ensoleillée, s’est tenu la dixième édition de la randonnée contre Parkinson au Folgoët. Pas moins de 272 cyclistes, coureurs à pied et marcheurs ont contribué à la réussite de cet élan de générosité. Cette manifestation a permis de réunir 1300€ pour la Recherche. En dix ans, grâce à l’équipe du vélo club du Folgoët et à tous les bénévoles, 14000€ ont été versés à la Recherche.
Le 28 avril 2012 au Juvénat de Châteaulin, le Docteur COUSTANS Neurologue au Centre Hospitalier de Quimper a animé une conférence sur « la maladie de Parkinson en 2012 et ses traitements ». Il a présenté un diaporama sur la maladie de Parkinson et a répondu aux questions posées par le public. Cette conférence a été suivie avec beaucoup d’attention par 120 personnes.
Nous sommes dans les préparatifs de notre repas champêtre qui aura lieu à Châteauneuf du Faou le 16 juin 2012. Un groupe de chanteurs de rue avec orgue de Barbarie viendra animer cette journée festive.
Une conférence avec Mme ROLLAND Orthophoniste (LSVT) à Rosporden et un kinésithérapeute est programmée pour le 20 octobre 2012.
Nos points-rencontre ont toujours autant de succès tout comme les séances de gymnastique de groupe dispensées chaque semaine par une kinésithérapeute à Quimper, Brest et Ploudaniel. Une autre activité « marche nordique » est en phase-test à Morlaix.
Plusieurs de nos adhérents malades et aidants sont actuellement en cure au centre Héliomarin de Tréboul en partenariat avec le centre antidouleur du CHRU Brest suite à une enquête sur les problèmes de sommeil et les douleurs dans la maladie de Parkinson.
Dominique BONNE, Président du Groupe de Parkinsoniens du Finistère GP29
Informations régionales : Côte d’Armor (22)
Publié le 03 août 2012 à 09:08Article paru dans LE PARKINSONIEN INDÉPENDANT n°49 – juin 2012
L’Association a tenu son assemblée générale annuelle le 30 avril 2012 à LANNION, 50 personnes y assistaient. A cette occasion, nous avons pu remettre aux adhérents, la plaquette de l’association que nous souhaitions réaliser depuis déjà un certain temps, voilà qui est fait !
Depuis le printemps, l’hôpital de Tréguier, après des rencontres avec l’association, a mis en place sous la forme d’hôpital de jour, des ateliers destinés aux parkinsoniens. Les malades sont pris en charge une journée par semaine, pendant 3 mois, durée qui peut être renouvelée. Prise en charge par des médecins, kiné, orthophonistes, psychologues, nutritionnistes, en groupe ou individuellement, Les premiers adhérents qui ont participés à ces journées, sont très satisfaits. Cette prestation s’adresse à tous les malades du département atteints de la MP, après établissement d’un bilan réalisé par l’hôpital sur une journée.
L’an dernier, nous avions mis en place des groupes de paroles pour les malades et des groupes de paroles pour les aidants qui se tenaient au même moment dans 2 salles différentes. Chaque séance était ponctuée d’un goûter pris en commun, et assuré à tour de rôles par les adhérents. Ces groupes étaient animés par une psychologue et un orthophoniste ; une centaine de personnes par groupe de 12 ont pu y participer. Ces échanges ont été très bénéfiques notamment au niveau des couples. Cette année nous voudrions y apporter quelque chose de nouveau telle que la mise en place d’ateliers de bien-être, relaxation (sophrologie, qi gong, massage…). Actuellement nous avons obtenu de la part du Conseil Général, un financement pour le groupe « aidants ». Avec l’aide du CLIC, nous constituons des dossiers afin de trouver un financement pour le groupe « malades ». Ce n’est pas gagné…
Pour participer au financement de ces actions, nous avions organisé un concert et des vide-greniers, ce qui nous permet également de communiquer sur la maladie et sur notre association.
- Le 11 avril, nous avons participé à une conférence sur la maladie qui s’est tenue à Corlay, à l’initiative du Clic et de la MSA, 50 personnes étaient présentes.
- Le 17 juin nous nous retrouverons vers 12 H au plan d’eau de Saint Carreuc qui se trouve à quelques kilomètres de Saint Brieuc pour un pique-nique/auberge espagnole (sous abri). Un courrier explicatif va être envoyé à chaque adhérent.
A la rentrée, nous prévoyons mettre en place une conférence animée par le docteur Della-Negra urologue qui nous parlera des troubles liés à la MP.
Il s’avère, qu’il est de plus en plus difficile pour les malades, d’assurer la gestion de l’association, l’implication des aidants est indispensable.
Joëlle Guenanen
Informations régionales : association de parkinsoniens de Charente
Publié le 02 août 2012 à 10:51Article paru dans LE PARKINSONIEN INDÉPENDANT n°49 – juin 2012
L’association est très occupée à organiser du 30.09 au 6.10.2012 les Vacances et les Assemblées Générales de CECAP 2012 : le fonctionnement de cette préparation se limite à six personnes dont 3 malades et 2 octogénaires. Nous avons accepté cette organisation mais nous constatons malheureusement que la maladie empêche une majorité d’adhérents de se déplacer. Nous mettons cependant toute notre meilleure volonté à donner une entière satisfaction aux personnes qui seront présentes.
Mesdames et Messieurs les Présidents et adhérents des Associations, il n’est pas trop tard de venir nous rejoindre. La date limite d’inscription a été repoussée au 25 mai 2012. Après cette date vous pourrez contacter le responsable de l’hostellerie : Monsieur THYBAUD Rémi au 0545685322. Nous comptons sur vous et vous en remercions.
Nous avons organisé un après midi théâtral le 11 mars 2012 ce qui a rapporté 315€ pour la Recherche. Nous nous sommes retrouvés autour d’une sortie repas à Puyreaux en Charente dans une très bonne ambiance, regroupant 32 convives.
Au plaisir de nous retrouver bientôt.
Carmen Demaille — Marie-Claire Aupy
Témoignage : Patch à base de morphine : comment traiter la douleur
Publié le 01 août 2012 à 07:40Article paru dans LE PARKINSONIEN INDÉPENDANT n°49 – juin 2012
Bonjour Monsieur,
Ne sachant si vous recevez de messages de « notre famille » www.notrefamille.com , je vous transfère celui que je viens de recevoir et qui, pour une fois, parle aussi de la maladie de Parkinson (en plus de la maladie d’Alzheimer, toujours la première source de préoccupation, comme si « Parkinson » était secondaire!. Bien entendu, cela ne fait pas partie des premiers titres mais plus bas, dans la rubrique « Zoom » en 5è position, on en parle et c’est le principal !
Mon ami Jacques a depuis jeudi dernier des patchs à base de morphine (dosés au minimum : 12 micron-grammes) qui l’aident le soir et la nuit en atténuant les douleurs (« coups de couteaux » et brûlures dans les jambes) qui se réveillent quelques minutes après le coucher. Il en était venu à faire de grosses crises d’angoisses avant de se coucher en se demandant si les douleurs nerveuses allaient se déclencher (environ 8 fois sur 10).
Quelqu’un parmi les adhérents a‑t-il eu les mêmes troubles et a‑t-il trouvé un moyen de les empêcher ?
Bien cordialement et avec mes félicitations pour votre revue.
Marie Berrier
Brèves informations sociales
Publié le 27 juillet 2012 à 10:52Article paru dans LE PARKINSONIEN INDÉPENDANT n°49 – juin 2012
ALD
Les assurés en affection de longue durée (ALD) qui déménagent ou changent de régime d’assurance maladie, n’ont plus à renouveler leur demande de 100%.-
décret du 19 mars 2012
Relevée par Soize Vignon dans « Pleine Vie » de Juin 2012
Alzheimer/Parkinson : les visites à domicile bientôt remboursées
Les malades touchés par une affection neurodégénérative bénéficieront de visites à domicile remboursées par la Sécurité sociale.
A partir du 23 mars, les médecins traitants pourront effectuer une visite, en présence des aidants, chez les patients atteints d’Alzheimer ou d’une autre affection de longue durée neurodégénérative comme la maladie de Parkinson.
Tarifée 56 euros, cette visite à domicile longue et complexe sera remboursable par la Sécurité sociale et les mutuelles complémentaires.
Par L’Express, publié le 05/03/2012 à 16:00
Transmis par Sylvain Bielle
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.