[vu sur le net] Souffrir de schizophrénie, un facteur de risque pour la maladie de Parkinson
Publié le 18 janvier 2021 à 16:38article trouvé sur le site Top Santé
En France, environ 100 000 personnes souffrent de la maladie de Parkinson. Cette pathologie neurodégénérative correspond à la destruction de certains neurones (les neurones à dopamine), ce qui entraîne des perturbations cérébrales et (au moins) 3 symptômes spécifiques chez les malades : l’akinésie (comprendre : une lenteur du mouvement, notamment de la marche), l’hypertonie (une rigidité excessive des muscles qui se traduit en particulier par une posture penchée en avant) et les tremblements (présents chez 30 % des patients, ils affectent surtout les mains et les bras).
Pour lire cet article dans son intégralité, suivez ce lien …
[vu sur le net] En bref
Publié le 17 janvier 2018 à 19:28article trouvé sur le site du Télegramme
Les signes cliniques de la maladie. Akinésie (marche difficile et ralentie, transformation de la parole, visage figé), tremblements (de repos, surtout des membres supérieurs, liés à une émotion ou à la fatigue), hypertonie (rigidité des membres), modification de l’écriture (micrographie), sommeil compliqué, salivation difficile et abondante, dépression. L’excès de médicaments peut aussi entraîner des dyskinésies (mouvements involontaires). Les malades n’ont pas tous les symptômes.
pour lire cet article dans son intégralité, suivez ce lien…
Vivre et accompagner le parkinsonien au quotidien, point de vue du neurologue
Publié le 06 mai 2016 à 21:45Texte de la conférence donnée par Dr Amélie Leblanc le 1er avril 2016, devant 200 personnes, à l’invitation par le GP29 à Landivisiau.
Pour mieux vivre sa maladie ou accompagner au mieux un patient parkinsonien en tant qu’aidant, il paraît indispensable de connaître la physiopathologie de la maladie de Parkinson, ses signes cliniques, les traitements et leurs effets secondaires ainsi que les structures d’aides médico-sociales. C’était le but de la conférence du 1er avril dernier à Landivisiau.
La maladie de Parkinson représente la deuxième maladie neuro-dégénérative en France après la maladie d’Alzheimer. Elle touche ainsi 150 000 personnes chaque année en France. Elle débute en moyenne vers 60 ans, plus rarement avant 40 ans et touche autant les hommes que les femmes. Elle est désormais intégrée au plan des maladies neuro-dégénératives (PMND) 2014 – 2019 visant à améliorer sa prise en charge.
La maladie de Parkinson est secondaire à un dysfonctionnement des noyaux gris centraux, siège de la motricité automatique. Du point de vue anatomopathologique, on peut observer une dépigmentation de la substance noire siégeant dans le mésencéphale liée à la dégénérescence des neurones dopaminergiques. A un niveau plus microscopique on observe des corps de Lewy dans les neurones. De nombreuses structures non dopaminergiques sont également touchées par le processus neurodégénératif. Les causes de cette perte neuronale sont la plupart du temps inconnues même si la responsabilité des pesticides est maintenant établie et si des formes familiales sont décrites.
Signes cliniques
Il est désormais acquis qu’il existe une phase pré-motrice précédant sûrement de plusieurs années l’apparition des symptômes moteurs. Cette phase comporte des signes cliniques variés tels que les troubles olfactifs, la constipation ou les troubles du comportement en sommeil paradoxal. Une des hypothèses physiopathologique serait l’existence d’une progression ascendante des lésions depuis le système nerveux digestif jusqu’au bulbe olfactif et au tronc cérébral.
Les signes moteurs apparaissent quant à eux lorsque les neurones dopaminergiques ont diminué de 70%. Ils comportent le tremblement de repos, l’akinésie et l’hypertonie extra-pyramidale (rigidité) qui composent la triade parkinsonienne.
Les patients parkinsoniens peuvent aussi se plaindre de symptômes non moteurs divers qui pourraient être représentés comme la partie immergée d’un iceberg. Ces symptômes souvent moins bien connus que les signes moteurs peuvent parfois être déroutants pour le patient et son entourage.
La mobilité peut être limitée par un freezing et des chutes secondaires à des troubles de l’équilibre, de la posture ou à une hypotension orthostatique.
Les capacités de communication sont parfois diminuées par une dysarthrie avec hypophonie ou par une hypersalivation.
Le sommeil est souvent agité avec un trouble du comportement en sommeil paradoxal ou un syndrome des jambes sans repos.
Outre un syndrome anxio-dépressif fréquent, pouvant précéder le diagnostic, la maladie de Parkinson peut comporter d’autres signes psychiatriques au premier rang desquels les hallucinations visuelles, le trouble du contrôle des émotions ou l’apathie peuvent surprendre l’entourage.
A un stade évolué, des troubles cognitifs peuvent survenir avec notamment des troubles de l’attention, un ralentissement cognitif qui entraînent une altération de l’autonomie cognitive et comportementale à des niveaux variables.
Beaucoup d’autres signes sont en fait liés à l’atteinte du système nerveux autonome : hypersudation, troubles vésico-sphinctériens, troubles sexuels, troubles de l’accommodation visuelle.
Les patients peuvent aussi présenter des signes plus généraux tels que des douleurs ostéo-articulaires ou neuropathiques, une dermite séborrhéique, des troubles de la vision des contrastes, un syndrome respiratoire restrictif…
Traitements
Sur le plan thérapeutique, trois grandes voies sont employées. Le traitement médical est utilisé en première intention alors que le traitement chirurgical est réservé aux formes compliquées. Quant à la rééducation et la réadaptation, elles sont utiles à tous les stades de la maladie.
Le traitement médical repose sur le principe de la compensation du déficit dopaminergique avec une multitude de médicaments disponibles que l’on peut classer dans 3 grandes voies thérapeutiques : apport d’un précurseur exogène de la dopamine (Levodopa), stimulation directe des récepteurs de la dopamine (agonistes dopaminergiques), réduction du catabolisme de la dopamine (IMAO, ICOMT). Dans la mesure du possible, les neurologues tendent à apporter une stimulation dopaminergique la plus continue possible et s’appuient de plus en plus fréquemment sur des techniques de perfusion sous-cutanée (pompe à Apomorphine) ou intra-duodénale (pompe à Duodopa).
La stimulation cérébrale profonde destinée aux patients parkinsoniens peut avoir plusieurs cibles : noyau ventral intermédiaire médian du thalamus pour le tremblement, noyau sub-thalamique en cas de forme akinéto-hypertonique et globus pallidus interne si des dyskinésies invalidantes viennent compliquer le traitement oral. Dans tous les cas son principe est d’inhiber les neurones cibles en appliquant une stimulation électrique à haute fréquence par le biais d’électrodes intra-crâniennes reliées à un stimulateur sous-cutané. Du fait de la lourdeur de la procédure chirurgicale, cette technique nécessite une sélection rigoureuse des patients éligibles pour éviter de possibles complications post-opératoires et des effets secondaires de ce traitement.
La prise en charge rééducative repose essentiellement sur la kinésithérapie et l’orthophonie. Le kinésithérapeute s’attachera à pratiquer des étirements globaux ainsi qu’un travail à haute intensité contre résistance et de dissociation axiale. La technique d’orthophonie la plus efficace dans la maladie de Parkinson est la Lee Silverman Voice Treatment (LSVT) pour la dysarthrie mais les séances sont également utiles pour la micrographie ou les éventuels troubles de la déglutition. L’intervention d’un ergothérapeute peut être nécessaire pour aménager le domicile dans les stades avancés.
Afin d’améliorer de nombreux paramètres moteurs et non moteurs, il est maintenant recommandé aux patients une activité physique quotidienne à type de marche nordique, Taï Chi, Qi Kong, tango… Cette prise en charge non médicamenteuse nécessite un investissement personnel de la part du patient et parfois de l’aidant mais apporte des bénéfices parfois insoupçonnés.
Il est important de savoir que les traitements médicamenteux peuvent provoquer des effets secondaires moteurs et non moteurs afin de pouvoir les dépister et les prendre en charge précocement. Au niveau moteur, on voit apparaître des fluctuations d’efficacité motrice et des dyskinésies liées à une diminution d’efficacité après plusieurs années de traitement. Des effets secondaires non moteurs peuvent aussi survenir : signes digestifs (nausées, vomissements, sécheresse buccale), hypotension orthostatique, troubles psychiatriques (trouble du contrôle des impulsions avec développement d’addictions alimentaires, au jeu, sexuelles … , hallucinations visuelles, troubles du comportement), somnolence.
Pour mieux connaître la maladie.
Selon l’OMS, l’éducation thérapeutique du patient. (ETP) vise à aider les patients à acquérir ou maintenir les compétences dont ils ont besoin pour gérer au mieux leur vie avec une maladie chronique. C’est une avancée dans la conception de la prise en charge des maladies chroniques dont fait partie la maladie de Parkinson, c’est pourquoi l’ETP prend sa place dans les actions à développer dans le PMND. Un projet est d’ailleurs en cours de rédaction par le service de neurologie du CHRU de Brest, en association avec l’association des parkinsoniens du Finistère et sera déposé à l’Agence Régionale de Santé (ARS) de Bretagne courant juin.
Les patients et leur entourage font souvent des démarches personnelles pour obtenir des informations complémentaires sur la maladie. Divers documents édités par des organismes d’Etat (Agence nationale de sécurité du médicament, Haute autorité de santé) ou des sites internet tels que le site du réseau Oniric http://www.neurobretagne-oniric.com sont à même d’apporter des informations fiables sur la maladie et les traitements.
Comment se faire aider ?
Si un problème médical ou social survient au cours de la prise en charge, le réseau de soins, médical, paramédical, et social qui s’est tissé autour du patient et de l’aidant doit être sollicité. Les associations de malades peuvent parfois apporter une aide complémentaire. Pour répondre aux questions plus sociales (aides financières, mise en place d’aides à domicile, aménagement du domicile) les structures sanitaires et sociales (CLIC = Centre Local d’Information et de Coordination, CCAS ou CDAS= Centre Communal ou Départemental d’Action Sociale, service APA = Allocation Personnalisée d’Autonomie, MAIA = Maisons pour l’Autonomie et l’Intégration des malades d’Alzheimer, Services d’aide à domicile, SSIAD = Services de Soins Infirmiers A Domicile) peuvent être sollicitées. Par ailleurs, des structures de répit existent afin d’éviter l’épuisement de l’aidant.
Pour conclure, il est important que le parkinsonien devienne l’acteur principal de sa prise en charge. Pour cela, l’ETP est d’un intérêt fondamental car elle a pour but d’induire une meilleure connaissance de la maladie et des traitements pour une meilleure gestion de la vie quotidienne. Le patient peut aussi s’impliquer dans sa prise en charge en pratiquant une activité physique quotidienne.
La place des aidants est maintenant reconnue et développée dans le PMND. L’accompagnement d’un patient au quotidien nécessite pour lui aussi une meilleure compréhension des symptômes de la maladie afin d’entretenir la plus grande autonomie possible.
Il est indispensable de mettre en place un réseau local centré sur le couple « patient-aidant » mais dans les situations difficiles, le recours aux structures d’aides et de répit peut être nécessaire.
Dr. Amélie Leblanc
Spécialiste des hôpitaux des armées
Service de neurologie et unité neuro-vasculaire
CHRU Cavale-Blanche, Brest
Maladie de Parkinson et la vision :
Publié le 25 octobre 2015 à 05:39Article paru dans LE PARKINSONIEN INDÉPENDANT n°62
Avec le vieillissement de la population, de plus en plus de patients qui nous consultent souffrent de plusieurs problèmes de santé, dont un bon nombre sont de type dégénératif. Certaines pathologies n’affectent que le système visuel, comme la dégénérescence maculaire, alors que d’autres peuvent toucher l’ensemble des systèmes. Parmi ces maladies que nous rencontrons de plus en plus souvent, il y a la maladie de Parkinson qui peut affecter l’œil et la vision. Cette pathologie chronique et dégénérative affecte le système nerveux central et provoque des troubles essentiellement moteurs par le dérèglement des neurones dopaminergiques.
Les signes les plus connus de la maladie sont l’hypertonie musculaire qui entraîne une rigidité des muscles, le tremblement au repos, principalement des extrémités, et l’akinésie qui est une lenteur d’initiation ou d’exécution des mouvements.
Mais outre ces signes, plusieurs problèmes oculaires ou visuels sont sous-diagnostiqués et mal ou peu traités ; il peut s’agir de diplopie (trouble du sens de la vue, consistant dans la perception de deux images pour un seul objet), de changement de la vision des couleurs, de diminution de la sensibilité aux contrastes, de problèmes de motilité (faculté de se mouvoir), ou de sécheresse oculaire.
Chez les deux tiers des patients, on remarque des anomalies de clignement. La diminution du réflexe de clignement causant une baisse de la régulation du film lacrymal. La sensation d’œil sec peut être causée par une déficience de la couche muqueuse, une surface lacrymale de mauvaise qualité entraînant un embrouillement souvent variable qui peut causer des difficultés de lecture.
La blépharite est aussi présente chez un bon nombre de patients atteints de la maladie de Parkinson ; une telle inflammation des paupières provoque de la douleur et un larmoiement excessif. La présence de squames et de croûtes explique la sensation de corps étrangers. Ce problème se contrôle facilement avec une bonne hygiène des paupières et l’utilisation de compresses chaudes et de lubrifiants.
D’autres affections peuvent toucher les paupières, comme le blépharospasme, qui est une dystonie du muscle orbiculaire provoquant une contraction involontaire et souvent douloureuse du muscle. Le blépharospasme peut être facilement contrôlé par des injections de la toxine botulique, mais c’est un traitement à répéter tous les 3 ou 4 mois.
Cliniquement, on peut aussi observer l’apraxie de l’ouverture, qui est une incapacité du muscle élévateur de la paupière, soit une difficulté d’amorcer ou de réaliser le mouvement indépendamment des atteintes motrices et sensitives. Toutes les anomalies des paupières peuvent causer de l’irritation et une sensation d’œil sec.
Par son effet sur l’innervation et les mouvements musculaires, le Parkinson peut aussi être en cause dans plusieurs problèmes de vision binoculaire. Les problèmes de convergence peuvent provoquer une *asthénopie, la *diplopie et même l’embrouillement, créant une fatigue visuelle importante expliquant entre autres la difficulté de lecture. Un traitement orthoptique peut aider à atténuer les symptômes durant les premiers stades de la maladie ou encore, une correction prismatique peut grandement améliorer ce problème.
L’amplitude d’accommodation peut également être diminuée, et aggraver les signes et symptômes de la presbytie, mais à cause des mouvements incontrôlés et des positions parfois vicieuse de la tête, il faut faire attention en corrigeant la vision de près avec des lentilles multifocales. Souvent, une lentille simple vision permettra un alignement plus facile des yeux sur les tâches visuelles de près.
Les conditions d’éclairage peuvent également exacerber un problème de confort visuel. Un bon éclairage permettra d’avoir un contraste optimum, une bonne réception des couleurs et un niveau de brillance confortable ; les conseils de base d’hygiène visuelle ont ici toute leur importance.
Pour ces patients atteints de la maladie de Parkinson, la perte de tonus et de contrôle musculaires peut représenter plusieurs petits deuils à faire par rapport à leurs activités habituelles. En optimisant leur confort visuel, nous pouvons, en tant qu’optométristes, préserver quelques-unes de ces activités et améliorer leur qualité de vie. Si les mains tremblent trop pour tenir le journal, on peut le lire sur l’écran d’ordinateur qui lui ne tremble pas, mais pour ce faire il faut que le patient porte la meilleure correction visuelle possible et c’est là que notre intervention prend toute son importance.
*Asthénopie : ensemble des symptômes liés à la fatigue des muscles oculomoteurs et ciliaires
*Diplopie : se caractérise par le fait de voir double, deux images au lieu d’une.
Article du Dr Diane G. Bergeron, optométriste – Sté Parkinson du Québec
Présentation de la maladie de Parkinson (première partie)
Publié le 18 octobre 2012 à 08:41Article paru dans LE PARKINSONIEN INDÉPENDANT n°50 – septembre 2012
PRESENTATION DE LA MALADIE DE PARKINSON
Par Tiphaine ROUAUD, neurologue à l’hôpital de NANTES
Intervention à la Maison des Aidants à Nantes en janvier 2012.
I – COMPRENDRE LA MALADIE
Définition : la maladie de Parkinson est une affection neurodégénérative qui se caractérise par des troubles moteurs (tremblement, akinésie et hypertonie) et des troubles non moteurs (troubles de l’odorat, troubles gastro-intestinaux, dysautonomie). Les troubles moteurs sont la conséquence d’un déficit de dopamine dans le striatum. Ce déficit en dopamine résulte de la dégénérescence progressive des neurones dopaminergiques de la substance noire.
Fréquence : 2ème maladie neurodégénérative après Alzheimer, on compte plus de 150000 parkinsoniens en France. Elle concerne plus de 2% des hommes de plus de 65 ans et un peu moins pour les femmes.
Origine : l’origine est mal connue. Il existe des formes génétiques (5 à 10%), une dizaine de gènes ont été identifiés. On a aussi évoqué l’implication de substances neurotoxiques : les pesticides sont les seuls facteurs de risque reconnus. Dans la plupart des cas, il y aurait une combinaison d’une susceptibilité individuelle (facteurs génétiques) et de facteurs environnementaux.
Rôle de l’alpha-synucléine : Dans la maladie de Parkinson, on constate une accumulation anormale d’une protéine, l’alpha-synucléine. Cette protéine naturellement présente dans le cerveau ne serait plus éliminée et se concentre sous la forme d’agrégats dont la toxicité entraînerait la mort neuronale. Or, ces agrégats se retrouvent précocement au niveau du bulbe olfactif et dans le système nerveux entérique, avant même l’atteinte de la substance noire. Les atteintes du bulbe olfactif et du système nerveux entérique expliqueraient en partie le manque d’odorat et les troubles gastro-intestinaux (dont la constipation), très fréquents et précoces dans la maladie. D’où l’hypothèse d’une implication d’un toxique environnemental, inhalé ou ingéré, qui traverse la muqueuse nasale ou la barrière épithéliale intestinale.
L’effet protecteur du tabac est très discuté : le tabagisme serait protecteur chez les sujets jeunes mais ne le serait plus chez les sujets âgés.
Déclaration : avec un âge moyen de début entre 57 et 62 ans, rare avant 40 ans (moins de 10% ces cas), la maladie débute rarement après 80 ans (moins de 10% des cas). 80% des cas débutent entre 40 et 75 ans.
Comment apparaît la maladie ? Dans la maladie de Parkinson, l’atteinte n’est pas limitée à la substance noire. Elle affecte d’autres structures ce qui explique les aspects non moteurs. La maladie débute par :
- le bulbe olfactif : perte de l’odorat,
- le noyau dorsal du vague : troubles gastro-intestinaux (dyspepsie, ralentissement de la vidange gastrique, constipation), troubles cardio-vasculaires (hypotension orthostatique), troubles vésico-sphinctériens (mictions fréquentes, urgences mictionnelles)
- le complexe coeruleus/subcoeruleus : perturbation du sommeil (rêves nocturnes agités).
Elle atteint la substance noire dans un second temps, puis les structures qui régissent l’équilibre, la qualité de la parole, la déglutition, les capacités attentionnelles, le raisonnement et les émotions. Ces symptômes ne sont pas dopa sensibles, d’où l’importance de la kinésithérapie et de l’orthophonie.
Le début de la maladie est progressif. Lorsque l’on pose un diagnostic, la maladie est installée depuis au moins 6 ans et environ 70% des neurones dopaminergiques de la substance noire sont détruits. Le diagnostic est clinique et ne justifie aucun examen complémentaire. Les 3 signes majeurs sont :
- le tremblement, présent dans 70% des cas, est un tremblement de repos, il apparaît lorsqu’il y a relâchement musculaire et disparaît lors de l’exécution d’un mouvement volontaire. Il peut être unilatéral ou très asymétrique. Il concerne la main, le poignet ou un membre supérieur ou inférieur. Le tremblement à tendance à s’aggraver en cas de stress,
- l’akinésie, difficulté à initier ou à exécuter un mouvement,
- l’hypertonie extrapyramidale ou rigidité.
L’akinésie et la rigidité se traduisent par une gêne à exécuter des mouvements volontaires accompagnées d’un ralentissement et d’une réduction de l’amplitude des mouvements. On relève une perturbation dans l’exécution des mouvements automatiques : perte de la gestuelle, de la mimique (visage inexpressif), perte du balancement d’un bras à la marche. Parfois la micrographie apparaît précocement avec une écriture de plus en plus petite où les lettres tentent de se télescoper. La perte des automatismes oblige le patient à penser chacun de ses gestes et rend difficile l’exécution de deux actes simultanément.
Les signes non moteurs :
- perte de l’odorat,
- troubles du sommeil,
- douleurs : pseudo sciatique, douleurs au niveau des cervicales ou des épaules, crampes dans les mollets la nuit, orteils en griffe le matin,
- troubles végétatifs : digestion (inconfort gastrique, remontées acides, constipation), urinaires (mictions nocturnes, urgences), génitaux (problème de l’érection), vasculaires (chute de tension), sudation (sensation chaud/froid, transpiration excessive).
Comment évolue la maladie ? On distingue 3 phases :
- phase de bon contrôle, dite « lune de miel » qui peut durer 6 – 7 ans ou plus. Période pendant laquelle on constate une bonne efficacité du traitement et permet au patient de mener une vie pratiquement normale,
- phase des fluctuations motrices et dyskinésies. Au cours de la 2ème période, les complications motrices liées aux traitements apparaissent avec durant la journée des moments de bonne mobilité (on) et des moments de mobilité réduite (off) et également des dyskinésies, mouvements involontaires souvent plus gênants pour l’entourage que pour le malade lui-même. On explique ces fluctuations par la réduction de la capacité de stockage de la dopamine (la perte des neurones dopaminergiques) et aussi par une saturation au niveau des synapses des récepteurs dopaminergiques.
- phase d’aggravation des signes axiaux et des capacités d’organisation de la pensée. Progressivement, les signes tardifs accentuent le handicap : troubles de la marche (freezing, festination), troubles de la posture (dos voûté), troubles de la parole et de la déglutition. C’est à ce stade que les troubles cognitifs et psychiques sont susceptibles de se majorer.
- Au dernier stade, la marche est devenue impossible, le patient a perdu toute autonomie et il doit être aidé pour les gestes de la vie quotidienne. Les déformations articulaires et les douleurs augmentent le handicap.
Chaque patient est différent et développe son propre parkinson. Le niveau de handicap varie d’un patient à l’autre ainsi que la vitesse de progression. Il existe des formes d’évolution lente et des formes d’évolution rapide.
La micrographie parkinsonienne
Publié le 10 avril 2012 à 10:22Article paru dans LE PARKINSONIEN INDÉPENDANT n°48 – avril 2012
Un trouble fréquent et précoce :
La micrographie est un trouble de l’écriture fréquent dans la maladie de Parkinson. Elle se caractérise par une écriture qui devient de plus en plus petite à mesure que la main progresse vers la fin d’un mot ou d’une ligne. On parle parfois d’écriture en « pattes de mouche ». L’écriture peut n’être que ralentie ou micrographique et rester lisible. Mais, elle peut être perturbée au point que la phrase entière devienne illisible.
Ce trouble est largement répandu (on cite 75% des patients Parkinsoniens). Assez souvent, il se manifeste précocement, dès la phase initiale de la maladie et contribue à l’établissement du diagnostic. On considère même qu’il s’agit d’un signe précurseur !
Ses conséquences sont variables, selon les individus et selon les professions qu’ils exercent. Mais, elles ont toujours un impact négatif dans la vie sociale et la vie professionnelle.
L’écriture, une tâche complexe :
Écrire consiste à produire rapidement sur un support des caractères de petite taille et assez semblables. Les mouvements doivent être rapides et précis. En plus du tracé des caractères, l’écriture exige des mouvements pour produire des sauts de gauche à droite, permettre des retours en arrière, assurer l’accentuation, etc… Bien que le support d’écriture soit plan, cela implique que les mouvements engendrant l’activité d’écriture soient dans les 3 dimensions.
Ces mouvements concernent donc les articulations de la main, mais aussi celles du poignet, du coude et de l’épaule. L’écriture dépend aussi de la posture et des points d’appui.
L’apprentissage de l’écriture est long et complexe. Il débute chez l’enfant vers 3 ans par des gribouillages. Vers 6 ans, l’enfant commence réellement à produire des caractères en se contrôlant visuellement. Ensuite, la tâche va progressivement s’automatiser et le contrôle visuel ne sera plus indispensable.
Les troubles de l’écriture :
Pour le Parkinsonien, dès le début de sa maladie, la belle écriture acquise à l’école primaire pendant son enfance, risque fort (75%) d’être perturbée !
Quels sont ces troubles de l’écriture ? Ils sont très bien décrits dans un article de Medipedia (en collaboration avec Véronique Locht); nous le reprenons tel quel ci après :
« Le trouble de l’écriture le plus fréquent est la micrographie (rétrécissement de la taille des caractères). Des difficultés au démarrage de l’écriture (et donc à écrire les premières lettres d’un texte) sont également signalées par les patients. Les groupes de lettres qui composent les mots sont souvent entrecoupés d’espaces, reflets des blocages que connaît le patient lorsqu’il écrit. Enfin, les lettres en forme de boucles posent beaucoup de problèmes aux patients atteints de la maladie de Parkinson (ex.: les ‘e’ et les ‘l’). Idem pour les ‘m’ et les ‘n’, auxquelles le patient a tendance à rajouter un ou plusieurs jambages (‘ponts’). »
La micrographie est une conséquence des symptômes moteurs de la maladie de Parkinson :
- l’akinésie (difficulté ou impossibilité à bouger) rend difficile l’initiation du mouvement, d’où les soucis au démarrage de l’écriture.
- la bradykinésie (ralentissement des mouvements) diminue l’amplitude des lettres, ce qui provoque une réduction de la taille des caractères.
- l’hypertonie musculaire entrave la fluidité de l’écriture et donc sa qualité.
Enfin, la perte des mouvements automatiques participe à la détérioration de l’écriture.
La rééducation :
Tout d’abord, rappelons que la rééducation de l’écriture est, au même titre que la rééducation de la parole, de la compétence de l’orthophoniste (du logopède en Belgique).
Les orthophonistes s’accordent pour proposer aux patients des sessions intensives de rééducation de 15 séances, à raison de 3 séances par semaine. Chaque séance dure 45 minutes et est complétée par des exercices à faire chaque jour au domicile. Au début de chaque session, l’orthophoniste choisit avec le patient un thème personnel motivant : établir et signer un chèque, écrire une carte postale pour ses petits enfants, préparer une liste de courses, etc…
Comment se déroulent les séances ? En rééducation, l’accent est mis tout d’abord sur l’exagération de l’amplitude du mouvement. Le patient s’exercera à mimer dans l’espace, le tracé d’énormes 8 ou 0. Cet exercice sera suivi du tracé sur de grandes surfaces de courbes diverses.
Puis, le patient sera incité à retrouver la bonne hauteur des lettres en écrivant des mots courts, puis de plus en plus longs sur des supports quadrillés.
À chaque séance de rééducation, le thérapeute donne des indications orales au patient parkinsonien. Quel est le but de cette méthode ? Rendre les mouvements plus volontaires, conscients et moins automatiques. En mémorisant ces consignes verbales et en prenant conscience des mouvements à réaliser, le patient saura par la suite ce qu’il doit faire pour obtenir le résultat visuel espéré.
Un trouble négligé :
Nous avons vu que :
- La micrographie est un trouble fréquent et précoce dans la maladie de Parkinson.
- Il s’agit d’un trouble Parkinsonien type par ses causes : akinésie, bradykinésie, hypertonie, perte des automatismes, etc.
- La micrographie peut être soignée par des séances de rééducation chez un orthophoniste.
Cependant, nous avons pu constater que ce trouble Parkinsonien reste relativement confidentiel. Il existe très peu de documentation sur la micrographie, même dans la littérature anglo-saxonne. Par ailleurs, les patients paraissent s’accommoder de ce handicap (pour beaucoup de patients, il y a des troubles plus graves!) et nous avons cru comprendre que la rééducation de la micrographie Parkinsonienne était assez rare chez les orthophonistes, faute de demande des patients. Mais cela peut et doit changer !
Bibliographie (sur Internet) :
- Acquisition et troubles de l’écriture de Pascal Zesiger
- Maladie de Parkinson — Ecrire malgré tout ( Revue Medipedia et Véronique Locht)
Rédigé par Jean Pierre LAGADEC
Place de l’orthophonie dans la maladie de Parkinson
Publié le 23 octobre 2011 à 08:31Article paru dans LE PARKINSONIEN INDÉPENDANT n°46 – octobre 2011
Les signes de la MP sont la conséquence de l’atteinte du Locus Niger, petite structure du cerveau faisant partie du système extrapyramidal et entrainant la disparition des neurones qui fabriquent la dopamine. Ce système intervient dans le contrôle de tous les mouvements automatiques : posture, marche, parole, écriture.
Conséquence sur la communication :
Troubles de la voix, de la parole et du langage souvent accompagnés par des troubles de l’écriture. Après quelques années d’évolution, une dysarthrie modérée est constante. Ces troubles sont souvent précoces et apparaissent avant les troubles de la déglutition.
Signes observés :
- Dysphonie avec altérations de l’intensité vocale, du timbre, de la mélodie, du débit (voix monotone, bredouillement, intensité diminuée, timbre voilé …)
- Dysarthrie avec articulation imprécise des consonnes. Au niveau de la mâchoire, l’articulation se réduit et la différenciation entre voyelles et consonnes se fait mal (démarrage hésitant, répétition de syllabe, parfois débit de paroles accéléré, rigidité des muscles des lèvres et de la langue avec manque de coordination entre l’émission sonore et l’articulation).
- Dysphagie avec perturbations de la phase buccale, pharyngée, œsophagienne. Les troubles de la déglutition étant une complication tardive dans l’évolution avec formation difficile du bol alimentaire et contraction pharyngée insuffisante avec pour conséquence une perte d’appétit, des difficultés à avaler les médicaments. La dysphagie peut empêcher aussi que la salive soit absorbée automatiquement ; celle-ci s’accumule et peut provoquer des « bavages » en cas de mauvaise posture de la tête (tête baissée).
- Amimie avec diminution de l’expression gestuelle du visage, support habituel de la parole. Les contractions modifient l’expression faciale.
- Troubles cognitivo-visuels apparaissent au décours de la maladie avec troubles de l’attention, de la concentration, pertes de mémoire, troubles du raisonnement, limitation et lenteur du mouvement des yeux et des mouvements tête-yeux.
- Akinésie qui est un ralentissement de l’initiation du mouvement avec raideur musculaire ou au contraire hypertonie, tremblements, et entraine des troubles de l’écriture qui peut être le premier signe de l’installation de la maladie et constituer un motif de consultation médicale. L’écriture est ralentie ou micrographique, reste lisible mais peut être perturbée au point que la phrase soit illisible. Cela entraîne souvent une modification de la signature.
La perte de l’automatisme doit être remplacée par un mouvement volontaire.
Prise en charge orthophonique :
Globalement le but est de renforcer la volonté pour tenter de conserver le plus longtemps les automatismes. Après évaluation, de la dysphonie, de la dysarthrie, de la dysphagie, de l’écriture, une rééducation s’avère indispensable. Les traitements antiparkinsoniens sont efficaces pour l’amélioration de la motricité des membres mais pas efficaces pour traiter les autres problèmes.
La rééducation consistera :
- parler
- détente musculaire, relaxation
- travail du souffle abdominal et de la respiration
- travail de la verticalité, de la posture, du regard,
- travail des praxies bucco-faciales,
- travail de la déglutition afin d’éviter les pneumopathies de déglutition,
- travail vocal pour augmenter l’étendue de la voix, son expressivité
- travail de l’articulation de la parole
- travail du langage en proposant une stimulation de la parole spontanée dirigée
- texture des aliments, adaptation des apports caloriques, posture,
- comportement graphique : position du tronc, du membre supérieur concerné par l’écriture,
- participation et information de l’entourage.
L’orthophoniste informe de la façon de limiter les situations de handicap et de maintenir au mieux la motricité et préserver au maximum l’autonomie. C’est un complément indispensable à la kinésithérapie. Le malade doit devenir co-acteur de sa prise en charge.
Association Solidarités Parkinson 93
La maladie de Parkinson : actualités physiopathologiques et axes de recherche thérapeutique.
Publié le 06 mars 2011 à 08:22Article paru dans LE PARKINSONIEN INDÉPENDANT n°44 – mars 2011
La maladie de Parkinson a été décrite pour la première fois en 1817, par James Parkinson (1755 – 1824), médecin anglais. Depuis cette première description clinique de la maladie de Parkinson, notre compréhension de cette pathologie neurodégénérative a fortement progressé, mais reste encore partielle. Actuellement, beaucoup de questions se posent encore aux chercheurs, médecins et acteurs de santé. Comment définir la maladie de Parkinson ? Alors que cette question parait simple et fondamentale, la réponse n’en est pas évidente. Or cette réponse ne conditionne-t-elle pas la recherche de nouvelles stratégies thérapeutiques, leurs bonnes mises en œuvre et par conséquent l’amélioration de l’état de santé du patient parkinsonien ? Ainsi, une compréhension toujours plus approfondie du fonctionnement cérébral, des réseaux neuronaux, des dysfonctionnements cellulaires et moléculaires, et des causes potentielles à l’origine de ces troubles, est indispensable à l’émergence de stratégies thérapeutiques curatives, ou ralentissant la progression de la maladie. C’est dans cet esprit et avec ces considérations que j’ai souhaité faire le point, sous la forme d’une thèse pour le diplôme d’Etat de Docteur en Pharmacie, sur les actualités physiopathologiques et les axes de recherche thérapeutique actuellement en développement dans la maladie de Parkinson.
La maladie de Parkinson peut se définir selon des critères cliniques (symptômes des patients) ou des critères physiopathologiques (nature des dysfonctionnements des réseaux neuronaux et des altérations moléculaires au sein des cellules). Actuellement, la maladie de Parkinson est définie comme une affection neurodégénérative, d’étiologie mal connue, touchant l’ensemble des systèmes monoaminergiques (dopaminergique, noradrénergique, et sérotoninergique) au niveau intracérébral et au niveau du système nerveux périphérique autonome. La principale caractéristique est la dégénérescence des neurones dopaminergiques de la substance noire pars compacta (zone cérébrale) entrainant un déficit en dopamine dans le striatum (zone cérébrale), responsable des troubles moteurs tels que le tremblement de repos, l’akinésie (incapacité à initier et à exécuter des mouvements volontaires et automatiques) et l’hypertonie (rigidité). De plus, le patient parkinsonien est affecté par des troubles cliniques non-moteurs davantage pris en considération de nos jours.
Tous les patients parkinsoniens ne présentent pas les mêmes troubles cliniques. Il existe des différences dans la nature et dans l’intensité de ces symptômes. De plus, ces symptômes apparaissent plus ou moins précocement (40 à 75 ans par exemple). Ces différences cliniques sont vraisemblablement liées à des troubles physiopathologiques différents. Peut-on alors parler d’une seule maladie de Parkinson ? Depuis plusieurs années, la compréhension de la nature des troubles cellulaires (et non cliniques) amènent les acteurs de santé à catégoriser les différentes formes de maladies de Parkinson. La maladie de Parkinson se caractérise par l’accumulation dans certains neurones (notamment dopaminergiques), d’une protéine altérée, mal repliée, et non éliminée par la cellule, à savoir l’alphasynucléine. La maladie de Parkinson appartient donc aux alpha-synucléinopathies. Bien que d’autres protéines soient également accumulées, l’alphasynucléine est majoritaire. Ces protéines accumulées forment une structure intracellulaire caractéristique, appelée corps de Lewy. D’autres pathologies dans lesquels on retrouve des signes cliniques parkinsoniens, comme la démence à corps de Lewy ou les atrophies multi systématisées présentent également une accumulation de cette protéine dans des neurones. Il existe aussi des tauopathies, dans lesquelles on retrouve une accumulation cellulaire d’une autre protéine, la protéine tau. Certaines de ces pathologies présentent également des signes cliniques de type parkinsonien.
Dans le cas de la maladie de Parkinson, l’origine de l’accumulation de cette protéine (alphasynucléine) est encore incomprise. Quel est le processus qui amène à la mort des neurones dopaminergiques dans lesquels cette alphasynucléine est anormalement accumulée ? Cette question n’a pas encore de réponse complète et satisfaisante. Toutefois, depuis de nombreuses années, les facteurs environnementaux, à savoir les pesticides et les métaux, sont suspectés de jouer un rôle clé dans ce processus. Des enquêtes épidémiologiques mettent bien en corrélation l’exposition à des pesticides et la plus grande fréquence de maladies de Parkinson dans des populations souvent agricoles ou rurales. Ainsi, la majorité des cas de maladie de Parkinson (environ 90%), dits idiopathiques ou sporadiques, ont probablement pour origine une susceptibilité génétique associée à des facteurs environnementaux. Cependant, depuis une dizaine d’années, des formes génétiques de la maladie de Parkinson ont été mises en évidence. En effet, des mutations sur certains gènes sont responsables de maladies de Parkinson. Pour certaines d’entre-elles, les signes cliniques sont similaires à ceux de la maladie de Parkinson idiopathique, alors que d’autres présentent une symptomatologie plus éloignée. Actuellement, une dizaine de gènes ont été identifiés comme potentiellement liés à la pathogénèse de la maladie de Parkinson (exemples de gènes : SNCA, PRKN, PINK1, LRRK2). Bien que ces formes génétiques ne représentent que 10% des cas de maladie de Parkinson, leur étude n’en demeure pas moins importante. En effet, de par la mutation de ces gènes, les chercheurs peuvent étudier l’implication des protéines issues de ces gènes dans le processus moléculaire amenant les neurones à accumuler l’alphasynucléine et à mourir.
Actuellement, plusieurs phénomènes ont été identifiés comme participant à la mort des neurones, notamment dopaminergiques. Tout d’abord, la métabolisation oxydative de la dopamine qui conduit à la formation d’un composé appelé aminochrome peut, dans certaines conditions, favoriser la production de métabolites réactifs au sein des neurones et donc augmenter le stress oxydatif cellulaire. L’aminochrome pourrait alors constituer une source endogène toxique pour les neurones dopaminergiques. Par ailleurs, des dysfonctions mitochondriales, une altération du système d’élimination des protéines altérées (système ubiquitine- protéasome), et des lysosomes sont également associées à l’accumulation de l’alphasynucléine dans les neurones. Le système immunitaire et inflammatoire cérébral est également impliqué dans le processus pathologique de la maladie de Parkinson. Cependant, malgré ces avancées dans l’identification des acteurs intracellulaires dans le processus dégénératif des neurones, les mécanismes, les séquences, et les liens entre ces acteurs restent encore inconnus. Or, le développement de stratégies thérapeutiques curatives semble étroitement lié à notre compréhension de ces mécanismes moléculaires conduisant à la mort des neurones.
La compréhension de la pathogénie a été améliorée par une meilleure compréhension du fonctionnement des circuits neuronaux (notamment ceux des ganglions de la base fortement impliqués dans la maladie de Parkinson) et des altérations cellulaires et moléculaires, même si l’ensemble des interactions n’est pas encore totalement défini. Ces avancées permettent actuellement l’essai de différentes stratégies thérapeutiques contre la maladie de Parkinson. Lorsque les thérapeutiques classiques comme la lévodopa-thérapie ou les agonistes dopaminergiques deviennent inefficaces contre des formes avancées de la maladie, une stimulation cérébrale profonde peut être, dans certains cas précis, proposée au patient. Cette approche est à différencier de la stimulation magnétique transcrânienne qui est en cours de développement. Cette stratégie permettrait un remodelage des certains circuits neuronaux et ainsi favoriserait une augmentation de libération de dopamine. Des essais cliniques ont montré une amélioration des troubles moteurs de 15 à 50%. Des résultats d’autres essais sont moins favorables, mais il reste beaucoup de travail de mise au point, afin que cette approche soit la plus efficace possible. D’autre part, pour renouveler le stock de neurones dopaminergiques ou contrecarrer les dysfonctions cellulaires, d’autres approches se développent actuellement. Tout d’abord, il est important de parler de la thérapie cellulaire. Au cours des années, plusieurs essais chez l’animal ont été réalisés à partir de types cellulaires différents (neuroblastes fœtaux, cellules souches mésenchymateuses, cellules souches neurales) et dans des conditions de greffes variées que ce soit dans la substance noire ou le striatum. Cette stratégie qui offre un grand espoir de remplacement cellulaire, n’est encore pas applicable chez le patient parkinsonien. Il demeure encore beaucoup de questions sur des plans de sécurité d’emploi de cette stratégie, d’efficacité et de conditions d’utilisation. Depuis quelques années, le transfert de gènes d’intérêt (thérapie génique) dans les structures cérébrales lésées, a suscité un grand engouement. Différentes stratégies de thérapies géniques permettraient d’augmenter la capacité de survie des neurones et de ralentir la progression de la maladie. On peut citer, à titre d’exemples, le facteur GDNF (glial cell line-derived factor) connu pour ses effets neuroprotecteur et de régénération des axones. Des essais cliniques encourageants ont été réalisés. La neurturine, qui est un facteur de croissance agissant sur les neurones dopaminergiques, est également à l’essai. Des stratégies de thérapie génique de gènes codant pour des enzymes (tyrosine-hydroxylase, dopa-décarboxylase, GTP-cyclohydrolase‑1) permettant d’augmenter la synthèse de dopamine dans les neurones, sont aussi étudiées. De plus en plus de travaux combinent ces deux approches en modifiant génétiquement des cellules d’intérêt avec des gènes d’intérêt, qui seront ensuite greffées (thérapie génique ex vivo). Par ailleurs, il existe aussi une autre approche afin de combattre la progression de la maladie de Parkinson : la neuroprotection. Cette stratégie consiste à protéger les neurones du processus de mort cellulaire et ainsi permettre un ralentissement de la progression de la maladie. La neuroprotection est donc destinée aux maladies débutantes, avant même que les troubles moteurs connus ne se manifestent. Cette stratégie nécessiterait donc un diagnostic beaucoup plus précoce. Cette neuroprotection essaie de contrer les dysfonctions intracellulaires en ciblant, notamment, les altérations mitochondriales. Des molécules sont actuellement en cours d’essai comme par exemple la créatine et le coenzyme Q10. Des approches permettant de diminuer la composante neuro-inflammatoire délétère pour le fonctionnement cellulaire sont aussi testées. Un autre axe de recherche thérapeutique consiste à bloquer certains types de canaux calciques à la surface des neurones dopaminergiques à l’aide de molécules comme l’isradipine. Enfin, une dernière approche est de nos jours en développement afin de diminuer les symptômes des patients parkinsoniens. En effet, bien que les neurones dopaminergiques soient les principaux neurones touchés dans cette maladie, d’autres structures cérébrales non dopaminergiques sont impliquées dans le contrôle des mouvements et notamment dans les fluctuations motrices et les dyskinésies apparaissant souvent à la suite d’une lévodopa thérapie au long cours. Des antagonistes des récepteurs à l’adénosine A2A comme l’istradéfylline sont en cours d’essais cliniques. Sont également à l’étude des inhibiteurs du glutamate, des antagonistes des récepteurs adrénergiques alpha2c, des inhibiteurs des récepteurs NMDA (N‑méthyl-D-aspartate), et des modulateurs sérotoninergiques.
Ainsi, l’ensemble des travaux de recherche ont contribué à améliorer la définition de la maladie de Parkinson, et ce, à différents niveaux. Sur le plan clinique car les symptômes de la maladie sont variés qu’ils soient moteurs ou non-moteurs, et différents entre les patients. Sur le plan des réseaux neuronaux, car la vision du fonctionnement de ces réseaux qui contrôlent notamment la motricité est fortement complexifiée. Sur le plan des processus cellulaires et moléculaires, car la compréhension des différents acteurs participant à l’agrégation de cette protéine, l’alphasynucléine, retrouvée dans les neurones en dégénérescence s’est grandement améliorée, même si beaucoup de questions restent encore sans réponse. Or, notre compréhension dans ces trois aspects est indispensable à l’émergence de nouvelles stratégies thérapeutiques, notamment curatives. Actuellement, de nombreuses recherches et essais précliniques ou cliniques dans les domaines de la stimulation magnétique transcrânienne, de la thérapie cellulaire, de la thérapie génique, de la neuroprotection, et concernant des traitements symptomatiques non-dopaminergiques, sont porteurs d’espoir dans l’amélioration de la prise en charge du patient parkinsonien. Bien-sûr, beaucoup de travail reste à faire, et l’intérêt que les patients parkinsoniens et leur entourage portent aux chercheurs et aux acteurs de santé en général, motive encore plus la détermination à combattre la maladie de Parkinson.*
Vincent LE FOL.
* L’ensemble de ces informations et les références s’y rapportant, figurent dans la thèse suivante : Vincent LE FOL, thèse pour le diplôme d’Etat de Docteur en Pharmacie, « La maladie de Parkinson : actualités physiopathologiques et axes de recherche thérapeutique », Faculté de Pharmacie de Nantes, 2010.
La thèse est consultable depuis le site internet Nantilus (http://nantilus.univ-nantes.fr, portail documentaire de l’université de Nantes).
La kinésithérapie
Publié le 25 juin 2009 à 05:28Article paru dans LE PARKINSONIEN INDÉPENDANT N°37 — juin 2009
Conférence du 2 avril 2009 à Parthenay D’Alain Boyer
Je vous félicite pour votre action en faveur de la reconnaissance, de la prise en charge et de la vulgarisation des connaissances sur la Parkinson. Mon rôle de kinésithérapeute m’a permis au sein de l’enseignement et de la recherche, d’appréhender un peu mieux la maladie au demeurant variée, laissant dire que chaque parkinsonien a sa propre forme et évolution. C’est en partie vrai, mais en statistiques médicales le nombre de patients et les formes permettent de tirer des généralités que l’on retrouve de manière récurrente.
Pour cette raison, je vous propose un descriptif de la maladie, les moyens en kinésithérapie et dans la vie courante, différents programmes de gymnastique, et les adjuvants massages physio etc … Pour une question de compréhension, j’ai choisi de décrire le rôle de la kinésithérapie et les différentes fonctions générées.
Je vous parlerai donc des objectifs pour chaque exercice présenté. Naturellement ces exercices ne sont pas exhaustifs, d’autres professionnels peuvent vous présenter d’autres formes ayant les mêmes objectifs.
Rappel de neuropathologie :
Comme vous le savez, la maladie de parkinson est due à une affection dégénérative des noyaux du système extrapyramidal. Le noyau gris central le plus affecté par ce processus est le Locus Niger. Ce système commande la partie instinctive et automatique de l’activité motrice. Il réalise, hors du champ de la volonté, un schéma moteur d’ensemble, mobilisant les masses posturales, permettant les mouvements synergiques de la posture et de la marche, facilite l’expression corporelle et la mimique.
La maladie est la manifestation d’un désordre fonctionnel, de certains noyaux gris centraux, résultant de la suppression du contrôle exercé par la boucle nigrostrionigrique. Il existe une dégénérescence sévère du locus Niger constitué de neurones dopaminergiques. L’élément déterminant la pathogénie du Parkinson, c’est la chute du taux de Dopamine dans le Putamen, le noyau Caudé et le Locus Niger.
C’est la compréhension de cette pathogénie qui a provoqué une véritable révolution permettant de maîtriser l’évolution, d’atténuer les effets et de permettre une autre vie à nos amis parkinsoniens.
Rappel clinique :
Vous connaissez tous les différents troubles provoqués par la maladie de Parkinson, je vous en rappelle les différents signes de manière succincte.
Début lent et progressif. Fatigabilité. Maladresse. Lenteur des mouvements. Perte du balancement des bras lors de la marche. Tremblement au repos.
Faute de traitement équilibré les trois grands symptômes apparaissent : ce sont ces symptômes qui seront à combattre lors de la kinésithérapie. Tremblement, rigidité, akinésie.
- le tremblement
Il apparaît au repos au niveau de l’extrémité distale des membres supérieurs, le pied, la langue et la mâchoire. - la rigidité
On dit que le parkinsonien est figé en flexion tête en avant dos courbé avant bras et genou en légère flexion, bras collés au corps, le faciès amimique, appelé aussi de « porcelaine ».
Vous avez aussi vu votre médecin ou kiné imprimant un mouvement de flexion des coudes ou des poignets, il perçoit ainsi votre hypertonie musculaire s’opposant aux mouvements et cédant par à‑coups successifs. C’est la recherche du signe de la « roue dentée ». - l’akinésie :
Elle se traduit par un dysfonctionnement de l’activité volontaire et automatique. Lors de la marche, le patient avance à petits pas, tête en avant avec l’impression qu’il va courir après son centre de gravité, les bras collé au corps. Au moindre obstacle, il va piétiner et se bloque. Une voix lente. Une écriture tremblée, lettres fines diminuant en taille (micrographie). Activité plus ralentie.
Voici donc les différents troubles que nous aurons à prendre en charge en kinésithérapie et vous-même dans la vie courante.
Mais, le parkinson ne vous évitera pas de subir les effets dus à l’âge :
Arthrose, colonne vertébrale dans son ensemble aggravée par les contractures musculaires. Douleurs des épaules. Constipation. Trouble de la ventilation thoracique.
Notre action aura pour principe de prévenir :
- Les raideurs : du rachis cervicodorso, du thorax en insistant sur le travail diaphragmatique ; des membres supérieurs et inférieurs.
- La proprioception debout cherchant à conserver ou à retrouver des appuis.
- La motricité oculaire : améliorer le réflexe occulomoteur.
- Le bien-être : dans ce corps qui bouge les efforts sont plus intenses, les massages sont appropriés mais pas une arme thérapeutique unique.
Malgré la chronicité du parkinson, l’ensemble médicaments, kinésithérapie et volonté, avec l’aide des accompagnants, ont permis un confort dans la durée.
Massages :
S’ils sont bénéfiques, ils ne sont pas un traitement global du Parkinson. Du fait des dyskinésies quasi permanentes les muscles se comportent comme ceux des sportifs et produisent de l’acide lactique, qui lui-même favorise les crampes et contractures. Alors, comme pour les sportifs, le massage est un acte essentiel mais pas unique dans le traitement kinésithérapie du parkinsonien.
Nous cherchons à détendre les contractures, tant au niveau du rachis cervical que du rachis lombaire sans oublier les épaules et les membres inférieurs et supérieurs. Pour cela, nous pratiquons des massages relaxant au début suivis de pétrissage modelage en obtenant une détente neuromusculaire, associé à la thermothérapie (enveloppements de boue ou utilisation d’infrarouges). C’est une préparation à la gymnastique.
Naturellement il existe une multitude de massages, n’en citer qu’un ne reflète pas l’éventail des techniques et leurs effets. Néanmoins ceux que j’ai décrits sont les plus rencontrés. Certaines techniques comme les techniques myotensives (polak) ou microkinésie présentent également un intérêt sachant qu’il ne s’agit que d’aide, la gymnastique ayant ma faveur.
Nous allons donc voir ensemble les buts recherchés et les moyens pour y arriver.
Mise en garde :
Avant de pratiquer ces exercices, chacun d’entre vous doit s’adresser à son médecin traitant ou à son neurologue (médecin référant) puis à son kinésithérapeute afin d’étudier le programme le plus approprié à votre état. Votre thérapeute vous guidera en vous montrant les exercices les plus appropriés en tenant compte du moment (fatigue, crantage, tremblements…).
Nous allons voir le type d’exercices en fonction de l’objectif recherché tel que défini au préalable.
Les raideurs du rachis cervico dorso lombaire :
Elles sont présentes dès le début de la maladie, mais l’âge et l’activité modérée rendent le diagnostic Parkinson difficile car qui n’a pas de raideurs passé 55 ans et un travail pénible. Si les massages décontracturant sont intéressants et même recommandés, ils ne doivent pas être le seul traitement, mais être un moyen favorisant la cessation de raideurs lors de phase off.
Par contre, la gymnastique de placements et de recherche de mobilité doit être privilégiée à la maison. Les nombreuses techniques (douces ex Pilates ou proprioceptives) permettent une réelle amélioration. Elles sont toutes réalisées avec un travail respiratoire diaphragmatique.
Je vous propose donc pour débuter un travail de positionnement :
- le sujet est debout, regarde droit devant, les jambes droites mais pas tendues, les bras le long du corps, le ventre légèrement rentré, les épaules ramenées en arrière. Respiration thoracique en recherchant l’écartement des côtes flottantes à l’inspiration : 15 fois
- sujet debout même attitude dos collé au mur, rechercher un étirement maximum du rachis en insistant sur la respiration et l’ampliation thoracique, jambes tendues. Durée : 2 à 3 minutes. La respiration en insistant sur l’expiration permet la détente musculaire.
- même position lever une jambe légèrement fléchie 5cm en avant sans se décharger sur la jambe d’appui. L’amplitude n’est pas important seul compte le placement.
Etirements des muscles du rachis cervical :
Même position, main droite sur la tempe gauche, tirer avec la main, en soufflant, la tête vers l’épaule droite. L’épaule gauche cherche à descendre comme si vous vouliez allonger le bras. Faire de même pour l’autre côté. 10 respirations.
Travail proprioceptif :
- les yeux : tout en marchant, prendre un point fixe latéral dans un couloir ou une grande pièce, marcher en regardant ce point tout en tournant juste la tête, pas le tronc. Faire 10 allers et retours.
- même exercice mais marche sur le côté en regardant toujours un point au mur en tournant la tête. 5 allers et retours.
- légèrement penché en avant, regarder en tournant la tête à droite et à gauche 10 fois de chaque côté.
Ces exercices contribuent également à une mise en œuvre du système vestibulaire responsable entre autre de l’équilibre.
Etirement du rachis dans son ensemble :
- debout tout en soufflant, mettre les mains derrière le haut de la nuque et descendre petit à petit en s’enroulant.
- à quatre pattes passer en position de prière et en soufflant s’étirer, les bras en avant. Pratiquer 20 fois.
- mains sur une table, se reculer un peu de telle façon à ce que les jambes et le buste fassent un angle proche de 90°, souffler en essayant de descendre les vertèbres dorsales et rentrer le ventre. Vous sentirez une tension dans les jambes et une brûlure au milieu des vertèbres dorsales. Attention, il faut démarrer fermement mais ne pas provoquer de douleurs intenses aux mollets et aux épaules.
- toujours devant une table ou un mur, en appuis avec les mains, chercher à descendre en bloc, sans cambrer ni courber le dos ni décoller les talons, le tout en soufflant pendant la descente vers le mur.
Tous ces exercices doivent être exécutés lentement.
Travail d’assouplissement des épaules et du thorax :
- sur le dos, prendre un bâton des deux mains et lever le bâton derrière la tête si possible, lentement en soufflant en montant et inspirant en descendant. Il ne faut pas provoquer de douleurs aux épaules.
- debout avec le bâton en avant chercher à exécuter des mouvements de pagayage pour provoquer une coordination du geste et une détente scapulo-humérale.
- debout ou assis, chercher à descendre les épaules et à emmener l’articulation scapulo-humérale en arrière, les omoplates ont tendance à se rapprocher sans se lever. Exercice difficile nécessitant un travail devant une glace et la correction d’une tierce personne.
- travail avec un ballon de plage, bras en avant, debout, chercher à tourner en bloc tout le haut du buste sans rotation de la tête ni du bassin. Cela améliore les fixateurs des omoplates et contribue à l’assouplissement du rachis dorsolombaire.
- debout, avec un ballon, passer ce dernier autour de votre corps et dans les deux sens.
Tous ces exercices tendent à lutter contre tous les types d’enraidissements ou de déviations, pas seulement dus à la maladie de Parkinson, mais à l’âge également. Vous remarquerez le rôle important que nous attribuons à la respiration.
Respiration : pourquoi insister sur la respiration ?
Comme vous le savez, la respiration permet les échanges gazeux entre le poumon et le cœur en apportant, notamment de l’O2 nécessaire aux fonctions vitales et permettant une meilleure fonction musculaire, particulièrement une détente, ce qui est prépondérant chez le parkinsonien, une amélioration des fonctions cérébrales et elle évite l’acide lactique, fréquente dans les muscles spasmés, cause de manque d’élasticité musculaire.
Mais l’effet piston du diaphragme qui monte et descend alternativement provoque un phénomène de chasse au niveau de l’intestin et de ce fait participe à l’amélioration du transit. C’est également un facteur dynamique pour la circulation au niveau du petit bassin et, de ce fait, améliore la circulation au niveau des membres inférieurs et même au niveau du thorax lors du retour diaphragmatique.
Ne pas effectuer quotidiennement ces exercices respiratoires, c’est diminuer l’action de la gymnastique de plus de 50%. Ces exercices peuvent être effectués au lit !
Respiration abdominale en gonflant le ventre sans compensation du dos.
Respiration thoracique en cherchant à faire rentrer l’air et en ouvrant le thorax, sans compensation de la colonne vertébrale, soit dos au sol.
Pertes de mobilité :
Il faut aussi parler du problème de la perte de mobilité, pas forcément l’apanage du parkinsonien, mais fréquemment rencontrée. C’est une réalité vécue par les aidants.
- 1‑La marche : elle doit être recherchée et aidée par différentes facilitations : aide auditive (métronome ou claquement des mains), aide technique en demandant au patient de lever les jambes de façon exagérée, aide de lignes sur la chaussée ou obstacle, balancement des bras comme un militaire lors d’un défilé. Ne pas hésiter de marcher en sous-bois ou dans les escaliers sachant qu’ils sont un élément facilitateur.
- 1‑Se lever d’un fauteuil : c’est le problème majeur pour tous les parkinsoniens et personnes âgées en générale. Il ne faut surtout pas tirer sur les bras, vous générerez des douleurs au parkinsonien mais vous allez surtout vous en provoquer au niveau de la région lombaire. La raison est simple le remède également. Le fait de se lever est un déséquilibre en avant. Pour se faire il faut passer les épaules en avant de l’axe des genoux et provoquer un mouvement vers le haut et en avant. L’aide d’un dossier de chaise ou un déambulateur est suffisante. Parfois on peut aider le patient en appuyant légèrement vers le haut au niveau de la 1ère vertèbre dorsale.
- 1‑La marche aidée : comme pour le lever, point n’est besoin d’effort important, il suffit de se positionner côté droit ou gauche du patient et de lui demander d’appuyer légèrement sur vos doigts, cela suffit pour obtenir une réaction entraînant la marche.
Conclusions :
Pitié pour les Parkinsoniens, cela ne sert à rien de la traîner, vous risquez un lumbago ou une douleur des rotateurs de l’épaule avec un conflit acromio humérale.
Ne cherchez pas à vouloir vous activer en période « off ».
N’en faites pas trop lorsque vous êtes en période « on ».
Si vous arrivez chez le kiné en période « off », profitez des massages ; il faut s’adapter à son état.
Faites la séance de kiné en période « on » : pour cela réalisez sur un semainier un relevé en marquant les différentes périodes et les prises de médicaments.
Texte de la conférence de Alain BOYER
Transmis par Raoul GRIFFAULT de l’APDS
Repris par Jean GRAVELEAU
Conférence du 26 avril 2008 à Nantes
Publié le 25 juin 2008 à 12:14Paru dans LE PARKINSONIEN INDÉPENDANT n°33 – juin 2008
Cette conférence a abordé deux thèmes de Recherche :
la stimulation du cortex moteur dans la maladie de Parkinson,
les troubles digestifs et la maladie de Parkinson.
1 — La stimulation du cortex moteur dans la MP.
Le professeur Jean Paul N’GUYEN présente les deux modes de procédure envisagés. On intervient :
- soit par SMC (Stimulation Magnétique du Cortex). Il s’agit d’une stimulation transcrânienne parce que la bobine de stimulation est posée sur la peau et que les ondes traversent le crâne pour stimuler le cortex. On l’appelle répétitive car on délivre plusieurs impulsions de suite pendant 20 minutes, le plus souvent il n’y a qu’une seule séance
- Soit par SMtr : on utilise une électrode extradurale placée sous le cortex. La SMtr nécessite un acte chirurgical moins invasif que la Stimulation Cérébrale Profonde (SCP) qui consiste à implanter une électrode au niveau du noyau subthalamique.
La recherche clinique a commencé en Italie avec les professeurs A. ANTONINI ET A. LANDI à Monza-Milan, puis à Créteil avec les professeurs J.P. N’GUYEN et J.P. LEFAUCHEUR.
Les premiers résultats sont encourageants.
La SCM permet de traiter des patients qui étaient écartés de la SCP : plus âgés, 74 ans contre 61 ans (SCP), malades depuis plus longtemps 16 ans contre 11 ans (SCP), avec un déficit cognitif modéré, avec une Dopa sensibilité modérée, avec un cerveau fragile (risque de trajectoires modérées).
On constate :
Des améliorations :
- amélioration de la camptocormie (dos voûté);
- amélioration modérée de la bradykinésie (ralentissement moteur);
- amélioration modérée de l’hypertonie ;
- amélioration de la marche ;
- réduction de la fréquence de blocage ;
- réduction des dyskinésies ;
- réduction des doses de L‑Dopa.
Pas d’améliorations significatives :
- tremblement ;
- équilibre ;
- dysautonomie ;
- troubles cognitifs ;
- pas de complications psychiatriques.
Effets secondaires :
- légère augmentation de poids ;
- pas de complications chirurgicales.
Quelques commentaires :
- la SCM est moins efficace que la SCP, elle apporte une amélioration de 30 à 40% UPDRS III, (Unified Parkinson Disease Rating Scale, mesure pour quantifier la progression de la maladie);
- elle est moins risquée que la SCP ;
- elle est beaucoup moins invasive ;
- elle peut être appliquée uni ou bilatéralement.
Conclusions :
- La SCM peut efficacement améliorer les troubles moteurs de la MP ;
- elle peut participer à une meilleure sélection des candidats à la SCP ;
- on peut envisager un traitement au long cours par la SMT.
Lors de la séance de question-réponse, le professeur N’GUYEN précise que nous sommes encore au stade de la Recherche. Reste à préciser les lieux d’applications et à trouver les meilleurs paramètres. Mais cette nouvelle technique est prometteuse, car la SCP ne reste possible qu’à des patients qui répondent à des critères précis (âge, réponse à la L‑Dopa, MP sévère, pas de troubles cognitifs,…).
Au sujet de la SCP (stimulation profonde), le professeur DERKINDEREN a souligné que cette stimulation ne traite que les symptômes et essentiellement les signes moteurs. Quand un parkinsonien est neurostimulé on va améliorer le côté moteur, mais on ne connaît pas l’évolution de la maladie, car la maladie est beaucoup plus complexe que le simple côté moteur. On peut déjà noter les effets secondaires de la stimulation : apathie, déprime ou excitation. Quand on procède aux réglages de la neurostimulation, on agit sur les signes moteurs (lenteur des gestes, rigidité, tremblements…). Toutefois, il est maintenant bien montré que la stimulation a aussi des effets psychologiques et comportementaux, d’où la demande des Parkinsoniens de la mise en place d’une cellule psychologique de suivi des neurostimulés.
2 — Les troubles digestifs dans la Maladie de Parkinson
Le professeur Michel NEUNLIST présente les grandes lignes des avancées 2007/2008 qui vont être abordées :
- le développement du projet de recherche de Tanguy CHAUMETTE (bourse CECAP);
- l’INSERM U 913, neuropathies du système nerveux entérique et pathologies digestives.
Ce travail se faisant en collaboration avec le professeur Pascal DERKINDEREN, il se félicite de la transversalité qui allie la recherche fondamentale et la recherche clinique.
Un bref rappel : le système nerveux entérique, considéré comme le deuxième cerveau, est le plus ancestral car dès l’origine il a servi à la capture des nutriments. Aujourd’hui, il comprend 1000 millions de neurones et 1 milliard d’astrocytes. Le tube digestif est constitué du plexus myentérique qui contrôle la motricité et le plexus sous-muqueux qui contrôle la fonction d’absorption et de sécrétion
Donc deux grands axes de recherche. Mieux connaître l’atteinte du système nerveux pour :
- comprendre et prendre en charge les troubles digestifs
- comprendre l’origine et le développement de la Maladie de Parkinson ;
Les troubles digestifs et la maladie de Parkinson.
Tanguy Chaumette, doctorant en sciences à l’U913 rappelle que les troubles digestifs chez le parkinsonien vont de la réduction de la fréquence de déglutition jusqu’à la constipation, car la motricité est défectueuse. Pour mieux comprendre les troubles digestifs des patients parkinsoniens, il est indispensable d’étudier l’atteinte digestive dans les modèles animaux de MP. Nous avons montré au laboratoire dans un modèle de singe parkinsonien, qu’il existait une perte des neurones à dopamine dans le système nerveux entérique de ces singes parkinsoniens. En parallèle, une augmentation des neurones produisant du monoxyde d’azote, qui ont un effet relaxant est noté chez ces singes. Ces anomalies pourraient être à l’origine de troubles digestifs et leur mise en évidence devrait permettre, à terme, de mieux prendre en charge les problèmes digestifs des parkinsoniens.
Comprendre l’origine et le développement de la MP
Thibaud Lebouvier, neurologue, doctorant en sciences à l’U913, nous rappelle qu’à l’apparition des symptômes de la MP, il y a une perte de 70% des neurones dopaminergiques de la substance noire. La mort neuronale est due à une accumulation d’une protéine, l’alpha-synucléine que l’on trouve dans des inclusions cytoplasmiques appelées corps de Lewy. Le système nerveux entérique est atteint précocement au cours de la MP, bien avant la substance noire. D’où l’idée d’orienter la recherche vers l’utilisation de biopsies obtenues par coloscopie pour procéder à un dépistage précoce de la MP.
Le mot de la fin revient au professeur P DERKINDEREN. Il se réjouit des avancées de la recherche tout en nous précisant que la recherche sur le système nerveux entérique reste une grande spécialité de l’INSERM de Nantes car actuellement peu de monde travail sur le sujet. Cependant, nous avons des contacts intéressants en Espagne, à Barcelone, où les recherches sont menées sur des souris rendues parkinsoniennes.
Ensuite nos intervenants se sont prêtés au jeu des questions-réponses. Pour clore la séance Jacqueline GEFARD a remis le chèque de CECAP-Recherche à Tanguy CHAUMETTE ;
En remerciement, nous avons remis à chacun un joli bouquet de muguet.
Par Guy SEGUIN, président de l’ADPLA
ass.adpla@wannadoo.fr
Parkinson et idées fausses
Publié le 15 novembre 2007 à 12:53Paru dans LE PARKINSONIEN INDÉPENDANT N°30 – septembre 2007
| La maladie de Parkinson est une maladie du 3ème âge | FAUX |
| Le tremblement est toujours associe au Parkinson | FAUX |
| Les gens qui tremblent ne sont pas tous Parkinsoniens | VRAI |
| La maladie de Parkinson est héréditaire | FAUX |
| La cause de la maladie reste inconnue et multi-factorielle | VRAI |
| On vit mieux avec le Parkinson depuis l’avènement de la DOPA | VRAI |
| La maladie de PARKINSON n’induit ni fatigue, ni douleurs | FAUX |
| la maladie de PARKINSON induit irrévocablement un Handicap | VRAI |
| Le Handicap lié au PARKINSON est Permanent | FAUX |
| La chirurgie permet de guérir la maladie par l’implantation d’électrodes | FAUX |
| La maladie de PARKINSON n’induit qu’une gêne motrice | FAUX |
| Tous les malades présentent les mêmes symptômes | FAUX |
Mal connue du grand public, la Maladie de Parkinson est très souvent associée à des idées fausses. Tout le monde peut comprendre ce que représente le handicap des non voyants, des paralysés, des sourds … Il n’en est pas de même pour la MP, les symptômes étant moteurs et psychiques, intermittents dans la journée, déroutants pour l’entourage… et donc bien difficiles à comprendre pour une personne bien-portante.
S’il fallait retenir 10 idées fausses à combattre sur la M.P, voici celles que je retiendrais :
1- La maladie de Parkinson est une maladie du 3ème âge : FAUX
L’âge moyen au moment du diagnostic est de 57 ans … Ce qui signifie que, statistiquement, un parkinsonien sur 2 a moins de 57 ans au moment du diagnostic… C’est donc — en principe — un actif et non un retraité. En fait 10 à 15 % des parkinsoniens ont 40 ans ou moins au moment du diagnostic. De plus, il semblerait que les parkinsoniens juvéniles sont de plus en plus fréquents …
Puisqu’on est dans les statistiques, on sait que l’évolution moyenne de la maladie ne permet plus le maintien de l’activité professionnelle au bout de 7 à 8 ans. Et pendant ces 7 à 8 ans, l’activité est souvent réduite à un temps partiel. Evidemment, si on est chirurgien, dentiste, ou encore visiteuse médicale ou VRP, ou encore fonctionnaire … le maintien de l’activité professionnelle ne pose pas tout à fait les mêmes problèmes.
2 — Le tremblement est toujours associe au Parkinson : FAUX
L’équation tremblement = Parkinson est tellement ancrée dans l’esprit des gens que :
- peu de gens savent qu’on peut être parkinsonien sans présenter le moindre tremblement, notamment au début de la maladie,
- peu de gens savent qu’on peut être un « grand trembleur » sans pour autant être Parkinsonien …
En fait, le tremblement est bien le signe le plus visible et donc le plus gênant socialement, mais l’akinésie (mouvements lents voire impossibles), et l’hypertonie (raideurs des muscles) sont les signes moins visibles mais qui entraînent plus sûrement le handicap. D’autres symptômes sont également fréquents au cours de l’évolution de la maladie : l’insomnie, la dépression, l’hypotension, la constipation, l’hypersalivation, les difficultés d’élocution, les problèmes d’équilibre, le ralentissement psychomoteur… et la fatigue quasi permanente…
3- La maladie de Parkinson est héréditaire : FAUX
On pense de plus en plus à une cause mixte de déclenchement de la maladie : susceptibilité génétique à un facteur de l’environnement (lequel ?). En fait, le caractère héréditaire est très peu marqué (même s’il existe des familles de parkinsoniens). Les observations effectuées sur les jumeaux confirment le caractère très peu héréditaires de la MP. Cependant,c’est une maladie fréquente (1 sur 1000), avec laquelle on peut vivre de nombreuses années, ce qui explique que l’on peut retrouver plusieurs cas de Parkinson dans une famille.
4- On vit mieux avec le Parkinson depuis l’avènement de la DOPA : VRAI
La L‑DOPA, découverte dans les années 60, a certes révolutionné la qualité de vie des parkinsoniens. Avant la DOPA, les malades devenaient grabataires en moins de 10 ans et ne survivaient pas au delà.
La L‑DOPA est le médicament le plus efficace pour pallier aux symptômes moteurs du Parkinson. Son action est très efficace les 1ères années de traitement, puis son effet s’amenuise au fur et à mesure que les neurones de la substance noire meurent. Ceci se traduit par les fameuses fluctuations motrices en cours de journée, qui se traduisent par des périodes OFF (mouvements lents voire bloqués, parole difficile, crampes etc.) alternant avec des périodes ON (mouvements désordonnés ou dyskinésies) en fonction des heures de prises des médicaments.
En conclusion, on vit mieux avec la L‑DOPA qu’avant, mais la qualité de vie se dégrade tout de même progressivement. On ne sait pas encore guérir le Parkinson.
5- La maladie de PARKINSON n’induit pas de fatigue, ni de douleurs : FAUX
Au moment du diagnostic, lorsque mon médecin généraliste m’a affirmé que la MP ne faisait pas souffrir, j’ai été rassurée…
Mais, j’ai rapidement déchanté… Les crampes, raideurs musculaires et douleurs quasi-permanentes au niveau de la nuque sont des douleurs chroniques, en général peu aigues (sauf pour les crampes !). Non, on ne peut pas dire que la MP ne fait pas souffrir …
La fatigue : Je dirais qu’il s’agit d’un symptôme majeur de la MP, celui qui ne vous lâche pas d’une semelle, du matin au soir, une asthénie de tous les instants. Tout fatigue : parler, se déplacer, écouter une conversation, marcher, lire, manger, répondre au téléphone, sourire, chercher des papiers dans son sac, rendre la monnaie etc. La MP c’est épuisant, car vos moindres gestes et vos moindres paroles ne sont plus sous « pilotage automatique ». Tout doit être pensé « comme si c’était la première fois ».
La fatigue et l’hypertonie entraînent fréquemment une perte de poids qui peut être importante.
6- Le HANDICAP lié au PARKINSON est PERMANENT : FAUX
7 — La maladie de PARKINSON induit irrévocablement un HANDICAP
Être parkinsonien, c’est être handicapé à temps partiel …
Allez faire comprendre cela au quidam dans la rue … que par moments les parkinsoniens sont bloqués, incapables d’initier un mouvement et par moments, au contraire les mouvements sont aisés, voire involontaires (dyskinésies).
Que faire un pas pour franchir une porte, c’est difficile, mais grimper l’escalier c’est facile… Que parler et se faire comprendre n’est pas possible par moments et possible à d’autres…
Un handicap à temps partiel, qui gêne l’activité normale quotidienne, est peu compatible avec l’activité professionnelle, et n’est pas toujours reconnu comme un réel handicap par les bien-portants.
Déroutant, non ?
8- La maladie de PARKINSON peut être guérie par l’implantation d’électrodes dans le cerveau : FAUX
La stimulation du noyau sous thalamique permet de réduire significativement les symptômes majeurs de la MP : tremblement, akinésie et hypertonie.
Seule, une petite majorité de parkinsoniens environ 15 % sont « éligibles » à une stimulation, car ils doivent correspondre à certains critères, notamment réagir favorablement au traitement dopaminergique, et ne pas présenter de troubles cognitifs ; les heureux élus devront attendre plusieurs années avant de pouvoir être opérés, car il y a trop de malades potentiels par rapport aux possibilités d’opérations en neurochirurgie.
Il faut retenir que 15 % des malades sont concernés par une amélioration des symptômes « moteurs » exclusivement.
9 — La maladie de PARKINSON n’induit qu’une gêne motrice : FAUX
Des troubles psychiques telles que la dépression, le ralentissement psychomoteur et l’insomnie sont fréquemment associés. Les médicaments peuvent induire également des troubles tels que les hallucinations ou la confusion mentale.
La gêne sociale peut être très importante : les tremblements, les mouvements involontaires, les difficultés d’élocution, le visage figé sont autant de « murs » entre les Parkinsoniens et leur entourage et gênent les relations sociales.
Des troubles divers telles que l’hypersudation, l’hypersalivation, la constipation, le manque d’équilibre sont fréquents.
10 — Tous les malades présentent les mêmes symptômes : FAUX
Il n’existe pas deux Parkinsoniens identiques : les symptômes majeurs ne sont pas les mêmes, leurs criticités, l’évolution de la maladie sont différents.
Le traitement qui réussit à Pierre ne marche pas avec Paul. Comment voulez-vous que les neurologues y retrouvent leur latin ?
11 — Il n’est pas nécessaire d’être suivi par un neurologue lorsqu’on est Parkinsonien : FAUX
Un médecin généraliste a en moyenne 1 parkinsonien dans sa clientèle. Or tous les parkinsoniens sont différents ; les traitements médicamenteux sont nombreux et évoluent. On ne soigne pas un Parkinson comme on soignerait une grippe.
Rien ne remplace une formation et une expérience d’un neurologue qui soigne des multitudes de patients tous les jours, même s’il faut faire quelques kms pour cela.
NOURRY Marie-Pierre
L’Isradipine© un nouveau traitement anti-Parkinson ?
Publié le 07 novembre 2007 à 09:53Paru dans LE PARKINSONIEN INDÉPENDANT N°30 – septembre 2007
Tests animaux prometteurs d’un médicament
Un médicament contre l’hypertension testé sur des souris de laboratoire pourrait ralentir et même stopper l’évolution de la maladie de Parkinson, offrant un nouvel espoir thérapeutique, selon les travaux de chercheurs américains publiés dimanche dans la revue britannique Nature.
L’Isradipine, commercialisé notamment pour le traitement de l’hypertension artérielle, « rajeunit » en quelque sorte les vieilles cellules à dopamine, celles dont la mort cause la maladie, selon les auteurs. Ces résultats sont jugés si prometteurs que l’équipe de chercheurs projette de conduire des essais sur des volontaires humains.
La maladie, décrite en 1817 par le médecin britannique James Parkinson, est une affection neurologique liée à la destruction progressive de certaines cellules du cerveau produisant de la dopamine, un messager chimique qui intervient dans le contrôle de la motricité. Elle touche 1 a 2% des plus de 65 ans et 3 a 4% des plus de 75 ans. En France, 100.000 personnes en sont atteintes (environ 1 million aux Etats-Unis) et 10.000 nouveaux cas sont répertoriés chaque année.
Le syndrome parkinsonien est caractérisé par l’association de trois signes principaux : un tremblement de repos, qui se manifeste chez deux tiers des patients, une raideur des muscles (ou rigidité, ou hypertonie), une lenteur des mouvements (akinésie).
« Notre espoir est que ce médicament protège les neurones dopaminergiques, et qu’en le prenant suffisamment tôt, la maladie ne se développera pas, même chez les gens à risque », s’enthousiasme le professeur James SURMEIER (Chicago) responsable de l’étude. « Si l’Isradipine permettait de doubler ou tripler la période efficace de la L‑dopa », un traitement du Parkinson dont les effets s’amenuisent avec le temps, « ce serait une grande avancée », estime-t-il. « Il n’y a pas eu de progrès majeur dans le traitement pharmacologique du Parkinson en trente ans », relève-t-il.
Les chercheurs ont examiné l’activité électrique des neurones à dopamine qui génèrent sans cesse des signaux électriques pour faire leur travail.
Ils ont ainsi découvert qu’à l’âge adulte, ces neurones dépendaient de plus en plus des ions calcium pour produire des signaux électriques, une dépendance gourmande en énergie et qui les exposeraient à un stress répété épuisant.
L’Isradipine bloque les canaux de passage du calcium situés à la surface de ces cellules nerveuses. Quelques heures après son administration, les neurones requinqués se remettent à utiliser le sodium comme de jeunes neurones. Ils deviennent en outre moins vulnérables à des toxines pouvant les détruire.
Ces cellules nerveuses « se mettent à agir comme si elles étaient jeunes à nouveau », selon le chercheur.
Lu et transmis par Pierre LEMAY de l’association de La Manche
Graphiques et figures élémentaires pour mieux comprendre le phénomène des blocages et des dyskinésies
Publié le 06 janvier 2007 à 12:28Article paru dans LE PARKINSONIEN INDEPENDANT N°27 – décembre 2006
1. Représentation graphique de la concentration plasmatique
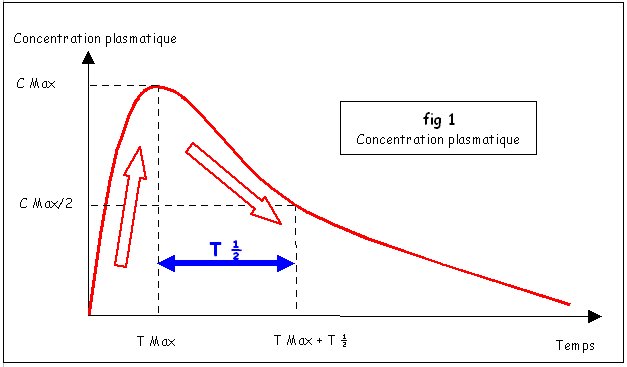
La concentration du médicament dans le sang présente l’allure d’une courbe en cloche : elle croît jusqu’à une valeur maximale (Cmax obtenue après un temps Tmax) puis décroît. La décroissance est exponentielle, la concentration diminue de moitié dans un intervalle de temps caractéristique : la ½ vie (T ½) jusqu’à devenir nulle ou négligeable.
Les temps Tmax et T ½ varient avec les individus, entre des valeurs limites généralement données par le Vidal.
Ordres de grandeurs retenues pour la L‑Dopa (Sinemet ou Modopar) :
T max = 1 h ½
T ½ = 2 h ½
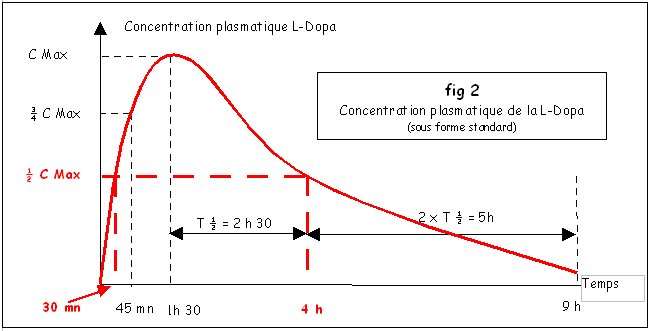
Tous les Parkinsoniens savent que le traitement fait son effet environ 30 minutes après ingestion, ce seuil dit « thérapeutique » correspond en fait à Cmax/2 généralement choisi par le neurologue pour les raisons évoquées ci-après.
2. Fréquence d’administration
Problématique :
- Parvenir rapidement à l’efficacité thérapeutique
- Maintenir une concentration active le plus longtemps possible tout en évitant des pics de concentration excessifs susceptibles d’entraîner des effets secondaires.
Le seuil thérapeutique étant choisi à Cmax/2, il est nécessaire de délivrer la dose suivante avant que la concentration ne redescende au dessous du seuil thérapeutique (une prise toutes les 4 heures : posologie bien connue en début de traitement)
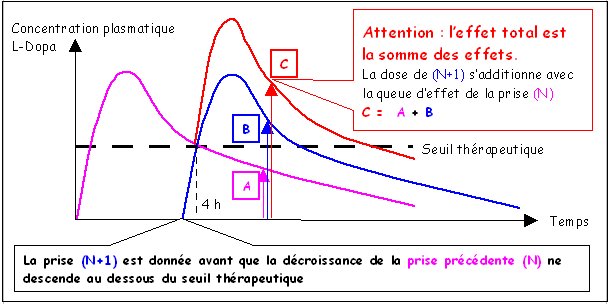
3. Espace thérapeutique et effets de la L‑Dopa
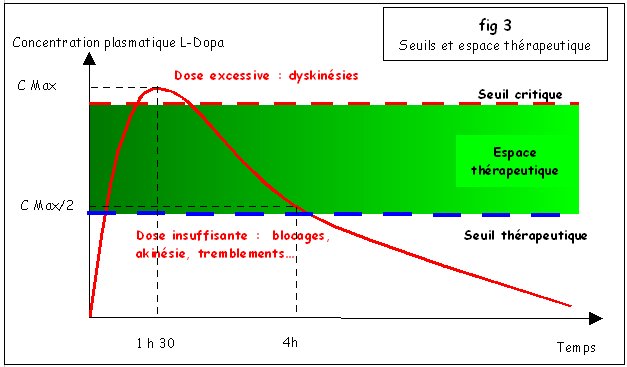
L’effet thérapeutique d’un médicament est généralement en grande partie lié à la valeur des concentrations plasmatiques (dans le sang). On peut observer :
- un seuil « plancher » dit thérapeutique (en dessous duquel aucun effet n’est obtenu)
- un seuil « plafond » dit critique (au delà duquel apparaissent des effets indésirables)
- entre les deux, un intervalle thérapeutique dans lequel les concentrations sont actives et non toxiques. La dose adoptée doit être telle que la concentration maximum soit située dans cet intervalle.
4. Evolution de la fenêtre thérapeutique au fil des années (fig 4)
L’équilibre obtenu avec une dose unitaire adaptée et une fréquence d’administration adéquate n’est pas définitif.
Au fil des années, la fenêtre thérapeutique se referme :
- le seuil thérapeutique augmente (accoutumance au médicament, modification des paramètres pharmacocinétiques de la L‑Dopa par rapport au malade, perte plus importante des neurones dopaminergiques…)
- le seuil critique s’abaisse et les excès de la L‑Dopa, tolérés au début du traitement, génèrent des complications nouvelles :
- fluctuations d’effet : quand la couverture thérapeutique n’est plus assurée, le patient ressent à nouveau les symptômes parkinsoniens, tremblements, akinésies, hypertonie et son confort devient discontinu (malaises en début et fin de dose)
- effets indésirables : les excès de dosage, inutiles mais sans sanctions immédiates en début de traitement par la L‑Dopa, engendrent des complications très pénalisantes (dyskinésies) après quelques années (au voisinage du maximum de concentration plasmatique, au milieu de dose).
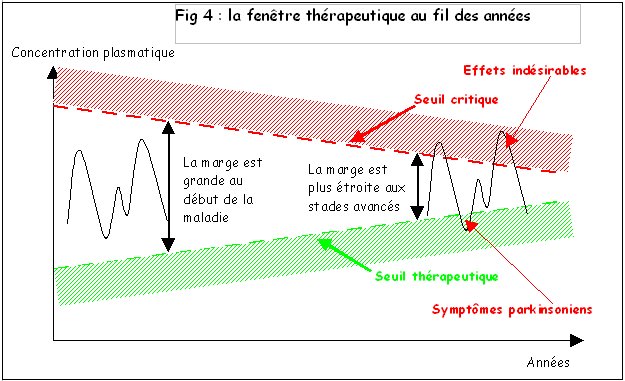
5. Chronobiologie
Parmi les variations d’efficacité du traitement, que les malades ressentent, certaines sont périodiques et la médecine a appris à les connaître et à les utiliser. Les principales sont circadiennes, sur la durée du jour, comme l’alternance veille/sommeil, et circannuelles (sur l’année) comme la succession des saisons, plus difficiles à identifier pour la question qui nous intéresse (les centres de gériatrie savent bien que le traitement est plus important l’hiver que l’été).
Exemples de variations d’effet circadiennes
Pour une même dose ingérée, dans cet exemple, la concentration maximum : Cmax, le temps de montée au pic : Tmax et la demi-vie : T ½, varient pratiquement dans le rapport de 1 à 2 ; on imagine les conséquences sur le choix de la posologie !
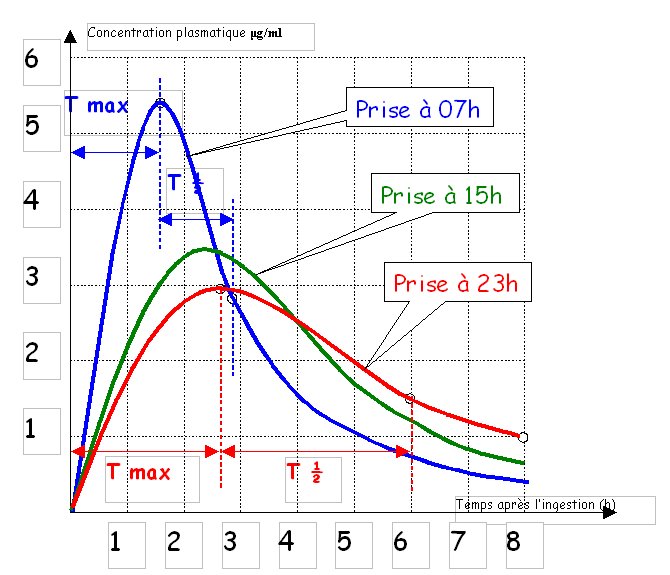
6. Influence des variations d’effet sur l’efficacité du traitement
Dans l’exemple précédent, imaginons que le seuil thérapeutique se situe à un niveau 3, une prise donnée à 7 heures sera efficace pendant environ 2h 1/4, celle donnée à 15 heures sera efficace pendant environ 2 heures alors que celle donnée à 23 heures n’aura aucune efficacité, d’où la perplexité du malade et de son entourage. Ce qui peut être le cas pour certains d’entre vous !
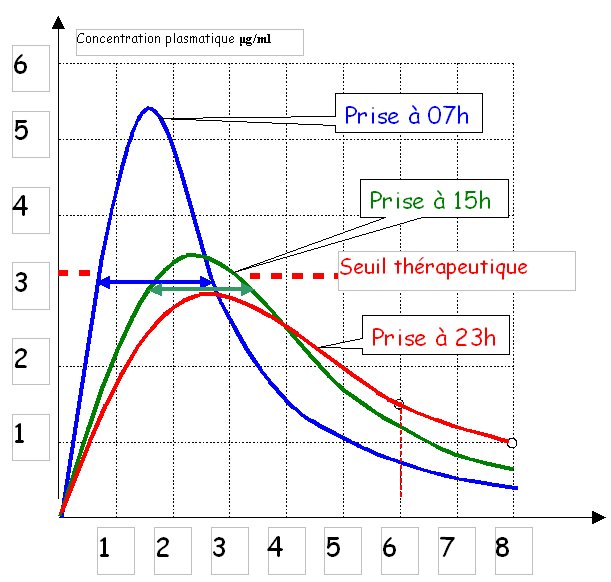
Encore quelques pas vers l’optimisation ?
Pas évident mais compréhensible, non ? oui ?
Demain : interro écrite…
Ceux qui ont en dessous de la moyenne devront faire de solides révisions avant de passer au stade de l’optimisation.
Conclusions (Tout ça pour ça !)
Sans doute beaucoup d’entre vous seront déçus dans leurs attentes, par cet exposé difficile, qui ne débouche pas sur une solution rapide, valable à très long terme et leur demande une participation exigeante, pas toujours compatible avec leur état de forme.
Pourtant c’est à ce prix que l’on peut arriver à mieux connaître sa maladie et à mieux se soigner en apportant son concours à son médecin.
Diminuer l’inconfort et ralentir la survenue des handicaps c’est aussi ménager l’avenir et garder l’espoir de bénéficier des progrès que la Recherche médicale nous promet.
Pierre Lemay & Emile Rainon
Septembre 2006
Les soins de support dans la maladie de Parkinson
Publié le 21 août 2006 à 09:21Les soins de support dans la maladie de Parkinson concernent :
1. Les troubles associés à la maladie de Parkinson qui sont fréquents et détériorent la qualité de vie des patients.
2. Parmi les troubles digestifs, les fausses routes et la constipation qui peuvent engendrer des complications sérieuses.
3. Les troubles urinaires (allers-retours multiples aux toilettes la nuit), le dysfonctionnement érectile et l’hypotension aux changements de position du corps qui peuvent bénéficier d’une prise en charge spécifique et efficace.
4. Les douleurs sensitives primaires qui sont à soigner.
5. Les troubles du sommeil qui sont d’origines multiples et doivent être explorés par un interrogatoire minutieux et une exploration dite « polysomnographique ». Elle se fait dans un laboratoire de sommeil (Brest, Rennes). Une somnolence excessive pendant la journée doit faire considérer le risque pour la conduite automobile.
6. Les troubles de la déglutition
Signes de gravité :
- Faible efficacité de la toux
Infections pulmonaires récidivantes
Durée des repas supérieure à l’heure
Blocage du bol alimentaire dans le pharynx ou l’ oesophage
Hypersalivation et « bavage » important
Signes d’alerte à rechercher :
- Hypertonie des muscles de la mâchoire
Stagnation buccale des aliments et de la salive
Fractionnement de la déglutition
Reflux alimentaire nasal et buccal
Douleurs à la déglutition
Perte d’appétit
La prise en charge des douleurs dans la maladie de Parkinson
Publié le 14 février 2005 à 10:48Les signes de la Maladie de Parkinson Idiopathique (MPI) sont classiquement dominés par :
- akinésie
- hypertonie
tremblement
La maladie est la conséquence directe de la dégénérescence de plusieurs voies neuronales du système nerveux central.
De multiples tableaux cliniques sont possibles où prédomine l’un ou l’autre de ces signes principaux auxquels s’ajoutent des signes moins spécifiques.
La maladie de Parkinson peut s’accompagner :
- d’un syndrome dépressif avec troubles du sommeil
— de tableaux douloureux complexes
La notion de sensation douloureuse est évoquée dès 1817 par Charcot dans sa description de la maladie. Il fait alors état de douleurs rhumatismales sévères à très sévères pouvant précéder les signes moteurs de la maladie de Parkinson.
La prise en charge de la douleur du patient parkinsonien pose un problème diagnostique et thérapeutique difficile. C es douleurs sont fréquentes et parfois sévères. Elles ajoutent un handicap supplémentaire qui altère la qualité de vie.
La douleur est rapportée par près de la moitié des patients.
Le syndrome douloureux
Dans 10 à 20% des cas, les douleurs annoncent la maladie. Les douleurs peuvent se manifester plusieurs années avant l’apparition des autres signes de la maladie.
L’origine de ces douleurs reste très discutée.
L’intrication entre les différents tableaux douloureux suggère des mécanismes variés.
Deux grands groupes de syndromes peuvent artificiellement être séparés.
- Les douleurs spécifiques qui ont leur origine dans le cerveau en lien direct avec le déficit dopaminergique
- Les douleurs d’origine périphérique, conséquences rhumatismales de la maladie.
Avec le vieillissement, pas moins de 70% de patients gériatriques en hospitalisation aiguë expriment des douleurs confirmées sur les échelles d’évaluation. Les mêmes observations sont faites dans les services de moyen et long séjour. Ceci justifie une évaluation régulière des douleurs et le développement de stratégies thérapeutiques associant aux antalgiques et co-analgésiques une prise en charge globale du patient par des techniques non médicamenteuses dont les différentes techniques de kinésithérapie, la posturologie, l’ergothérapie, la sophrologie ou d’autres méthodes de type bio-feedback.
L’immobilisation entraînant des positions vicieuses, le développement d’escarres, les séquelles de chutes répétées doivent être pris en charge. Cependant le Parkinsonisme peut s’accompagner de douleurs associées à la rigidité comme dans le cas de l’hémi rigidité en début de maladie, en cas de sous dosage permanent avec accentuation de la rigidité, lors d’effet « off » (souvent le matin), ou comme conséquence de dystonie douloureuse. Dans ces cas, une concertation avec le neurologue est requise pour adapter le traitement anti-parkinsonien. Le recours aux différents traitements contre les douleurs se fera après une évaluation très précise des douleurs et sur la base d’une prise en charge globale des patients
DOULEURS SPÉCIFIQUES DE LA MALADIE DE PARKINSON
I- Physiopathologie
Diverses recherches ont montré l’existence d’une relation étroite entre déficit sérotoninergique central, douleur, dépression et troubles du sommeil dans la MPI. Une activité anormale du système nerveux central est incriminée dans l’émergence de certains tableaux douloureux. Il est à noter que ces mêmes douleurs sont retrouvées chez des patients présentant un syndrome parkinsonien d’autre origine (syndromes parkinsoniens médicamenteux (neuroleptiques). Certaines douleurs font partie intégrante de la MPI, en lien direct avec le déficit dopaminergique central.
Les bilans électrophysiologiques (électromyographie, potentiels évoqués) sont normaux, confirmant l’intégrité du système nerveux périphérique.
Ces douleurs d’origine centrale sont très souvent rattachées aux fluctuations motrices, généralement localisées du côté le plus akinétique et en période « off »
Il existe un équilibre physiologique entre les systèmes dopaminergiques, sérotoninergiques et noradrénergiques également impliqués dans les contrôles inhibiteurs de la douleur. L’introduction de la L‑Dopa, traitement de base de la MPI, modifie cet équilibre, pouvant de ce fait améliorer un certain nombre de douleurs.
LES MANIFESTATIONS DOULOUREUSES — ÉVA, SAINT-ANTOINE, DOLOPLUS 2.
1- Les crampes fugaces
Elles sont souvent associées à des raideurs douloureuses et surviennent chez 30% des malades environ. Elles ne sont pas secondaires à l’apparition de contractures et ne sont pas augmentées par le mouvement.
Elles sont de localisation variable mais prédominent aux membres inférieurs, surtout du côté atteint, pouvant être reliées à un manque d’activité et de mobilité. Elles sont rarement bilatérales. Elles sont rapportées par les patients comme durables, pouvant varier entre un quart d’heure et une heure. Elles apparaissent surtout dans la deuxième partie de la nuit.
Elles peuvent également apparaître en cours de traitement (généralement en fin de doses) et sont alors en rapport avec la dopathérapie.
Des douleurs musculaires plus diffuses sont parfois retrouvées, prédominant sur les muscles posturaux. Elles sont fréquemment reliées à l’existence d’attitudes vicieuses secondaires, aux positions maintenues pendant les phases de blocage et à une hypertonie musculaire associée. Elles surviennent surtout avant la prise des médicaments, notamment en fin de doses.
2- Les dystonies douloureuses
Sont présentes dans 40% des cas. La dystonie est un mouvement de torsion et/ou d’inflexion soutenues qui entraîne une attitude vicieuse et des déformations. Elles peuvent être associées à des dyskinésies. Ces mouvements anormaux involontaires sont parfois accompagnés de manifestations telles que transpiration, oppression thoracique ou angoisse .La douleur est probablement liée aux contractures musculaires qui sont en rapport avec les prises médicamenteuses : soit liées à une carence en dopamine, soit par surdosage, soit induites par l’utilisation chronique de dopamine et disparaissent alors à l’arrêt du traitement.
Elles peuvent survenir à l’installation des périodes de blocage (période off) surtout en fin de nuit et au réveil avant la première dose de L‑Dopa. La « dystonie du petit matin » est ressentie par près de 16% des patients. Il s’agit d’une contracture des orteils en flexion pendant près de 15 minutes à une heure. Elle cède après la prise de L‑Dopa.
Les déformations des mains et des pieds sont relativement fréquentes, dans les formes évoluées de la maladie. Elles sont responsables d’une torsion douloureuse des doigts, touchant plus souvent le pied que la main, surtout du côté le plus atteint. Ces spasmes douloureux peuvent être brutaux, spontanés ou provoqués par le mouvement. ils sont souvent brefs, de l’ordre de quelques minutes mais peuvent durer plusieurs heures Ils peuvent devenir permanents et rebelles à tous traitements. Différentes positions du pied peuvent être observées : pied varus équin surtout, flexion plantaire ou dorsale, flexion des orteils (en griffes) ou extension forcée du gros orteil. Elles peuvent être associées à une contracture des muscles du mollet. La dystonie douloureuse du pied peut apparaître avant toutes les autres manifestations de la maladie de Parkinson.
Les déformations peuvent devenir permanentes et évoluer vers des positions fixées de traitement difficile, elles touchent également les autres membres, le tronc, la nuque, la face et le cou.
L’évaluation de la dystonie impose une analyse soigneuse de ses relations avec le traitement par L‑Dopa, tant sur le plan de sa chronologie que sur celui des doses. La « dystonie du petit matin » est le plus souvent dopa-sensible. L’intensité des dystonies de la période « off » est diminuée en rapprochant les prises de la L‑Dopa. Les agents dopaminergiques, y compris l’apomorphine sont efficaces, de même que les anticholinergiques et le lithium.
Les injections de toxique botulique ont une action sur les dystonies localisées.
3- Les Dysesthésies
Elles sont fréquentes. Décrites depuis près d’un siècle.
Elles évoquent une origine dans le cerveau et sont une conséquence directe de la maladie de Parkinson.
La description est celle des douleurs neuropathiques par atteinte du système nerveux central ou périphérique.
Elles sont décrites comme des fourmillements et des picotements prédominant dans les membres inférieurs, associés à une sensation de piqûres ou d’élancements. Elles précèdent parfois de plusieurs années les manifestations motrices et peuvent s’installer du côté opposé à celui atteint par la maladie. La douleur survient essentiellement pendant les périodes « off » mais n’est pas toujours réduite par l’ajustement de la L‑Dopa. Elles sont parfois associées à des douleurs de type : sensations de brûlures intenses, de serrement ou d’étau, parfois de froid ou de chaud. Ces douleurs sont évaluées sur le questionnaire de Saint-Antoine et leur traitement est fonction de l’atteinte des fibres nerveuses.
4‑les Douleurs abdominales ou épigastriques
Elles exigent un bilan clinique précis.
Sensation d’abdomen distendu et douloureux.
Elles surviennent principalement pendant les périodes « off » de la maladie et disparaissent sous traitement. Elles doivent faire éliminer des douleurs de constipation chronique, fréquente mais qui doivent être mieux prévenues.
La prévention de la constipation par l’hydratation et l’administration systématique de laxatifs doux, la mobilisation à l’aide du kiné et de l’entourage et éventuellement de petits lavements lors de passage difficile.
Il existe de la même façon des douleurs de la sphère génitale, notamment chez la femme : brûlures vaginales, sensation d’engourdissements ou d’élancements. Un examen approprié aura soin d’éliminer une cause locale organique.
5‑Les douleurs de la sphère oro-pharyngée
Elles se manifestent par des sensations de brûlures des gencives, de la langue ou des joues, survenant en l’absence de pathologie locale. Elles peuvent simuler une glossodynie idiopathique ou une pathologie dentaire. Ces douleurs sont souvent décrites comme pulsatiles, associées à une sensation de brûlure permanente dans le même territoire, le plus souvent en période « off »
Ces deux derniers types de douleurs peuvent être dû, dans certains cas, à un déficit en dopamine, alors amélioré par la prise de L‑dopa. Plus rarement, la douleur serait la conséquence d’une hypersensibilité des récepteurs à la dopamine, celle-ci apparaissant à l’introduction du traitement dopaminergique. Elles sont également retrouvées chez les patients présentant un syndrome parkinsonien lié à la prise de neuroleptiques.
6‑Le syndrome des jambes sans repos (impatience)
Ces symptômes sont décrits comme des sensations désagréables à type de fourmillements. Les jambes sont lourdes et douloureuses. Ils surviennent dans les membres inférieurs, au repos la nuit et disparaissent avec l’exercice obligeant le patient à changer constamment de position. Ils peuvent être responsables de troubles du sommeil. Ils sont améliorés par une prise de L‑dopa ou d’un agoniste dopaminergique au coucher.
II. LES DOULEURS SECONDAIRES
1- Les douleurs musculo-squelettiques et articulaires. (60 à 70% des cas)
Elles sont essentiellement axées sur la colonne vertébrale, à type de cervicalgies, de lombalgies ou de lombo-radiculalgies. Elles prédominent souvent du côté le plus atteint dans les formes akinéto-hypertoniques, ou bien sont secondaires aux rétractions musculaires et aux anomalies posturales.
Les déformations du rachis telles que scoliose et cyphose sont fréquentes dans l’évolution de la maladie de parkinson. La scoliose est plus fréquente avec une prévalence évaluée à près de 70%. Le côté de la convexité semble sans rapport avec la latéralisation de la maladie. Elle serait liée aux déséquilibres posturaux en rapport avec l’asymétrie de la MP. L’attitude classique du patient est tête projetée vers l’avant. Dans certains cas, cette position est fixée. Dans d’autres cas, elle semble liée à la dystonie de la nuque et peut se modifier avec la posture, l’activité et les prises médicamenteuses. L’existence de douleurs de la colonne vertébrale doit faire rechercher une pathologie rachidienne associée (hernie discale, canal lombaire étroit).
L’ostéoporose fréquente, prédispose aux fractures pathologiques.
Le traitement de ce type de douleurs nécessite une évaluation rigoureuse, un diagnostic précis en retraçant l’historique de la symptomatologie, un examen clinique et des examens complémentaires y compris d’imagerie. Un avis orthopédique s’avère souvent indispensable.
Il faut dans tous les cas rechercher une pathologie associée : arthrose fréquente, à l’origine d’un tableau douloureux précis. Une affection rhumatologique d’origine mécanique doit être recherchée : douleurs cervicales thoraciques ou lombaires devant être traitées pour leur propre compte. Des lésions arthrosiques peuvent toucher le genou (genou parkinsonien) avec limitation de l’extension pouvant nécessiter une intervention chirurgicale (arthroplastie).
En cas d’atteinte articulaire périphérique, l’épaule est fréquemment touchée, principalement dans les formes akinéto-rigides : algodystrophie de la ceinture scapulaire, capsulite rétractile, prériarthrite scapulo-humérale. L’algodystrophie de l’épaule est la plus fréquente souvent inaugurale précédant alors d’un an ou deux l’apparition de la MPI. Elle est en rapport avec des anomalies réactionnelles du système nerveux autonome.
Elle est améliorée par la dopa thérapie et la rééducation bien faite qui doit être la plus précoce possible.
2 — les maux de tête (céphalées)
touchent environ 35 % des patients soit plus que ce que l’on observe dans une population contrôle. Leur relation avec la maladie de Parkinson n’est pas clairement établie. Les maux de tête sont souvent derrière la tête occipito-nuquales, profondes et pulsatiles. Elles sont souvent associées à une sensation de chape de plomb sur les épaules. Elles peuvent être transitoires apparaissant le matin et sont alors sensibles à la prise de dopamine.
Les douleurs d’origine centrale directement liées à la MP, sont rattachées aux fluctuations motrices présentes du côté le plus akinétique. E!les sont souvent intermittentes, mal localisées. Leur évolution est variable. Elles sont accentuées en période de blocage et en cas de dépression sévère. Elles surviennent surtout chez lez patients les plus jeunes, habituellement déprimés et sont associées à des troubles du sommeil. Elles peuvent disparaître sans raison et réapparaître quelques mois plus tard.
III. LE TRAITEMENT.
La prise en charge d’un tableau douloureux chez un patient parkinsonien est difficile. Les douleurs spécifiques de la maladie et celles d’origine rhumatismale sont largement intriquées. Le choix du traitement doit s’appuyer sur l’examen médical, l’évaluation précise des douleurs et le type de la douleur. L’établissement d’un calendrier est essentiel pour essayer de mettre en relation douleur, période on-off et prise médicamenteuse en cours.
Dans tous les cas, la rééducation précoce (plusieurs techniques existent) visant à l’amélioration des postures, les massages, la physiothérapie à base d’ultrasons et l’application de chaleur locale sont des éléments essentiels de la prise en charge de la MP.
Les tensions musculaires sont levées par des manœuvres d’étirement des muscles contractés et par des massages locorégionaux myorelaxant et antalgiques. L’action sédative recherchée est cependant de courte durée.
Les techniques de relaxation favorisent repos et sommeil.
La thermothérapie garde sa place comme traitement antalgique adjuvant, notamment dans les manifestations douloureuses d’origine ostéo-articulaire. L’expérience montre que les sensations désagréables consécutives à l’inactivité et à l’immobilité sont sensiblement atténuées par l’activité physique et la pratique régulière d’exercices.
- La cryothérapie
- La micro kinésithérapie
- Les corrections posturales
L’adaptation du traitement spécifique de la MP avec aménagement dans les horaires de prise et modification des doses avec recours à des formes retard pour permettre la rééducation des fluctuations motrices au cours du rythme nycthéméral et de ce fait améliorer les douleurs. Ceci doit se faire avec le neurologue.
1 — Le recours à l’utilisation d’agoniste dopaminergique, et notamment l’apomorphine sous-cutanée est souvent utile. Cet agoniste spécifique de la dopamine présente une affinité importante pour les récepteurs dopaminergiques Dl et D2. utilisé en injection sous cutanée discontinue, son délai d’action est rapide : 10 à 15 minutes et sa durée d’action courte : 45 à 120 min. Elle peut être utilisée en perfusion continue à l’aide d’une pompe. Elle est surtout efficace sur les périodes « off ». Elle est aussi préconisée dans le traitement des akinésies nocturnes, des dystonies matinales et des spasmes et douleurs dans le syndrome des jambes sans repos.
2 — Les anti-dépresseurs tricycliques notamment ceux à médiation mixte noradrénergique et sérotoninergique, ont un effet sur les douleurs d’origine centrale.
Ces molécules agissent également sur le syndrome dépressif sous jacent qui doit être systématiquement recherché (HADS, PENN STATE ). Le traitement est débuté à faible dose pour être augmenté progressivement jusqu’à la posologie adaptée, ce qui permet une titration individuelle du produit utilisé. Le patient reçoit au préalable une information claire quant à la durée du traitement et sur le risque d’apparition d’effets secondaires, ces derniers pouvant entraîner un changement de molécules ou l’interruption du traitement.
3 — La sophrologie
4 — La prise en charge par le psychologue
5 — La prise en charge par un sociologue
6 — La morphine peut être justifiée chez certains patients résistant aux thérapeutiques précédentes. Son action est supérieure à celles des antalgiques du palier 1. Il faut prévenir d’emblée les effets secondaires par des traitements adjuvants adaptés afin d’améliorer la tolérance et donc l’observance aux thérapeutiques proposées.
7 — Le traitement classique d’une pathologie rhumatismale rachidienne cervicale ou lombaire ou périphérique se révèle souvent utile : AINS, infiltration articulaire de corticoïdes et rééducation. La chirurgie orthopédique peut être nécessaire dans les formes évoluées. La rééducation doit être précoce en période postopératoire car le risque de rétraction tendineuse ou musculaire est fréquent.
8 — Le myorelaxants : le baclofène a une efficacité prouvée sur les dystonies douloureuses.
9 — La toxine botulique est utilisée en injection locale pour le traitement des dystonies douloureuses. Ces injections de toxines semblent efficaces dans le traitement des contractures musculaires douloureuses accompagnant les dystonies avec régression des douleurs et de la dystonie dans tous les cas. Les muscles pouvant être injectés de toxines sont sélectionnés par le kinésithérapeute et le médecin sur leur aspect au moment de la dystonie.
10 — Les anesthésiques locaux en injection : généralement il s’agit d’une série de trois ou quatre points injectés à la fois.
L’imagerie fonctionnelle et la maladie de Parkinson
Publié le 14 février 2005 à 10:31Ce texte relate l’intervention du Dr Catherine Cheze-Le Rest, médecin au service de médecine nucléaire au CHU de Brest – lors de notre conférence sur la douleur dans la maladie de Parkinson du 9 octobre 2004.
Ecrit par Michelle Galès, il a été revu et corrigé par le Docteur Cheze-Le Rest
Les symptômes tels que les tremblements, l’akinésie, l’hypertonie révèlent à 80% la maladie de Parkinson.
Pour aider le diagnostic clinique, on fait un test à la L‑Dopa pour faire une cotation du sujet. Lorsqu’on donne 100 – 200 mg de L‑Dopa, le test est positif si on observe une amélioration de 50% du score.
Dans la maladie de Parkinson, des neurones à dopamine disparaissent, d’où nécessité de dopamine.
En imagerie fonctionnelle, on injecte une substance radioactive par voie intraveineuse pour étudier un organe. Il n’y a pas de préparation particulière. Pas de précaution particulière avant l’examen, inutile d’être à jeun. La substance injectée émet des rayonnements. Ces examens sont des scintigraphies. Il y a autant de scintigraphies qu’il y a de substances à injecter. Elles se font en service de médecine nucléaire.
Pour détecter la maladie de Parkinson, plusieurs cibles sont à étudier :
1.Les neurones qui fonctionnent avec de la dopamine, pour poser le diagnostic de maladie de Parkinson.
2. Les douleurs musculaires, squelettiques et articulaires : scintigraphies osseuses afin d’éliminer les maladies associées (imagerie fonctionnelle osseuse).
Pour étudier les neurones fonctionnant avec la L‑Dopa on utilise une substance, la Fluorodopa. Après la période de fixation du produit, la scintigraphie permettra de détecter s’il y a ou non maladie de Parkinson, car la dopamine sera plus faible. Cette imagerie permet de suivre le pourcentage de perte de neurones à dopamine. Ainsi chez un parkinsonien débutant, on pourra remarquer moins de 30% de perte avant que ne se manifestent les premiers signes cliniques. Sur les patients Parkinsoniens déclarés, on constate en moyenne 50% de perte, allant jusqu’à 90% de perte en stade terminal.
Il existe une alternative à la fluorodopa pour le diagnostic : la scintigraphie au Datscan. Le scanner est utile pour diagnostiquer les maladies associées mais pas pour le diagnostic du Parkinson.
La Datscan donne les mêmes images que précédemment. Il n’est pas nécessaire d’interrompre les traitements. Et là encore, pas de préparation ni de précaution particulière avant l’examen, si ce n’est que sur place, une heure avant, on donne une substance pour bloquer la thyroïde qui, sinon, sera marquée avec de l’iode. Pour l’examen, on fait l’injection intraveineuse du produit au pli du coude (comme pour une prise de sang) et on attend 2 ou 3 heures pour laisser au produit le temps d’aller s’accumuler au niveau des neurones.
Cet examen se déroule allongé sur une table rigide, en position immobile pendant 45 minutes. Pour la machine, la température de la salle est maintenue à 20°C.
L’examen est indolore (si ce n’est la piqûre du début) sans effet secondaire. Sur prescription médicale, il est pris en charge à 100% par la Sécurité Sociale.
L’examen se fait avec une substance radioactive. Il n’y a aucun risque d’effets secondaires au niveau cérébral (avec cet examen, on irradie deux fois moins qu’avec un scanner).
Quand on suspecte une maladie de Parkinson : à l’apparition des premiers symptômes, quand le diagnostic est encore incertain, l’examen est anormal et plus on fait cet examen, plus on remarque que les anomalies sont évidentes, car les clichés anormaux le restent.
L’examen sert donc à poser le diagnostic.
Imagerie fonctionnelle des os : scintigraphie osseuse
En cas de problèmes ostéo-articulaires, on va utiliser une substance qui va se placer sur l’os seulement.
Les douleurs ostéo-articulaires :
— sont le plus souvent axiales : cervicalgies, dorsalgies…
— elles sont parfois liées à une pathologie associée : arthrose, tendinite…
— parfois elles sont aussi périphériques.
Pour l’examen, on injecte un produit au pli du coude, on attend 2 à 3 heures pour que le produit soit capté sur les os. L’enregistrement des images peut être centré sur une zone particulière, douloureuse ; on place alors le détecteur sur cette zone. Cet enregistrement peut aussi se faire de la tête aux pieds. Chaque image dure 3 minutes, 30 minutes pour le corps entier.
On demande au patient de boire pendant l’attente pour que le produit ne s’accumule pas mais au contraire soit éliminé le plus vite possible par les reins.
L’examen se fait en consultation externe. La prise en charge est de 100% dès lors qu’elle a été prescrite.
Algodystrophie
Elle cause de vives douleurs au niveau des articulations qui peuvent aussi être gonflées, coincées. On rencontre beaucoup ce problème.
Avec cet examen, on peut diagnostiquer une algodystrophie quand le produit s’accumule très vite au niveau des articulations.
Fractures
Cet examen permet de confirmer les fractures que l’on ne voit pas bien sur une radiographie. Par contre, une scintigraphie osseuse ne permet pas de voir les problèmes musculaires ou tendineux puisque seul le squelette est visible.
Orthophonie : le point de vue d’un médecin
Publié le 16 janvier 2005 à 19:32Communiquer est une des principales fonctions de l’homme vivant en société. Il utilise la parole et l’écrit, capacités qui lui sont propres mais aussi l’expression gestuelle, les mimiques de la face qui se rapprochent de mode d’expression comportementale commun à de nombreuses espèces animales.
Or l’appauvrissement de l’activité motrice liée à la maladie de Parkinson retentit inexorablement sur la capacité de communiquer du malade par tous ces modes. Souvent interprétées comme un ralentissement intellectuel par un entourage non averti, l’inexpressivité du visage, les diminutions des capacités orales et graphiques ont des répercussions importantes sur la qualité de vie des parkinsoniens.
L’atteinte de la communication orale se caractérise par une dysphonie (altérationdes caractéristiques acoustiques de la voix) et une dysarthrie (troubles de l’articulation de la parole). La triade classique de la maladie, tremblement, hypo et bradykinésie, hypertonie se retrouve dans tout le processus de la parole :
- difficulté de l’initialisation de l’acte
— respiration et phonation (expiration, résonance, nasalisation)
— articulation labio-linguo-vélopharyngée (hauteur, intensité, timbre)
— prosodie (mélodie, durée, intensité, débit) (tremblement du larynx)
Les troubles du rythme s’intègrent aux dyskinésies (et évoluent donc avec les effets thérapeutiques on/off). Le débit de parole se précipite (tachylalie) à mesure que la capacité d’articulation diminue rendant le propos incompréhensible, associé à une désorganisation de la respiration. L’articulation est gênée par la dyskinésie et l’hypertonie, avec incoordination entre l’émission sonore et le travail musculaire bucco-laryngo-facial.
On constate donc que le parkinsonien essaie de dire le plus de mots possible sur un seul souffle en articulant peu pour essayer d’arriver au bout de sa phrase. Il en résulte une économie de langage avec appauvrissement et réduction essayant d’esquiver toutes les difficultés lexicales et syntaxiques de la langue.
Les gestes de la parole dans leur versant non verbal vont être aussi altérés et aggravent les difficultés de communication : réduction de la mimique, hypoexpressivité, fuites salivaires (hypertonie de l’orbiculaire des lèvres donnant une fausse hyper sialorrhée), déglutition automatique raréfiée, trouble de la posture de la tête gênant une bonne projection verbale.
Le traitement pharmacologique, dans toutes ses composantes, peut améliorer tous ces symptômes, mais avec les même évolutions dans le temps que pour toutes les autres difficultés motrices. Or on constate que la prescription d’orthophonie aux parkinsoniens reste exceptionnelle. Cette rééducation nécessite un ou une orthophoniste formé mais peut apporter une réelle amélioration de la qualité de communication et donc de la qualité de vie et de la préservation de l’autonomie.
La rééducation orthophonique comprend plusieurs volets complémentaires :
- travail de relaxation qui reconquiert la maîtrise du tonus musculaire ;
— travail de la mécanique respiratoire permettant une émission vocale correcte et audible ;
— travail de la voix (travail gnosopraxique) force de la voix et timbre ;
— travail de la motricité bucco faciale et des praxies (face au miroir,o uverture/fermeture de la bouche, des lèvres, place de langue etc.);
— travail sur la mélodie et l’expressivité (lecture, chant);
— travail de l’écriture ;
— travail de la déglutition ;
Les séances doivent être courtes sans dépasser la demi-heure, mais intensives et rapprochées, idéalement quotidiennes. Des cures de 15 à 20 séances, étalées donc sur deux à trois semaines, deux à trois fois par an apportent les meilleurs résultats
Alors que vous soyez malade ou médecin, en lisant ces lignes vous aurez compris tout l’intérêt de la prise en charge orthophonique de la maladie de Parkinson, à côté de la classique kinésithérapie et en complément des médicaments
Ce texte écrit par le docteur Walusinski a été transmis par le Docteur Claude Mange sur le site de Parkliste
La Maladie de Parkinson — Conférence du docteur Anne FROBERT
Publié le 24 juin 2004 à 21:17paru dans Le Parkinsonien Indépendant n° 17 — juin 2004
Saint Nazaire le 17 avril 2004
Docteur en médecine, spécialisée en gynécologie-obstétrique et principalement en chirurgie gynécologique, Anne FROBERT est diagnostiquée « parkinsonienne » à son 42ème anniversaire, cela à la suite d’une « sorte de paralysie de la main droite et de douleurs persistantes ».
J’essaie, de part ma double appartenance, c’est-à-dire au monde des personnes porteuses de la maladie et à celui des médecins, de trouver les moyens pour mieux se comprendre et se faire comprendre, mieux expliquer les problèmes des uns et des autres. Par contre même si je commence à bien connaître la maladie, je ne suis pas neurologue et ne prétends en aucun cas l’être ni tout savoir sur la maladie de Parkinson (MP).
Les porteurs de maladies chroniques décident de faire les efforts nécessaires pour se prendre en charge, être des collaborateurs efficaces à l’ensemble des thérapeutes, pour devenir des partenaires à la gestion de leur propre maladie.
Intervenir devant vous aujourd’hui, c’est aussi une démonstration immédiate et probante du fait que la maladie de Parkinson n’atteint pas précocement les fonctions supérieures dites cognitives et n’est pas la maladie uniquement de personnes particulièrement âgées comme le pense souvent le grand public non averti.
Quelle que soit notre âge et nos symptômes, nous avons tous une maladie de Parkinson : est ce la même maladie pour tous ? Sans doute pas tout à fait : pluri symptomatiques, il y a autant d’aspects de la maladie que de patients. Cependant des traits communs font qu’actuellement le même mot de « maladie de Parkinson » est utilisé.
Rappel sur la maladie de Parkinson (M.P.)
C’est une affection dégénérative du système nerveux central, de cause initiale inconnue et sans traitement pouvant actuellement stabiliser définitivement ou guérir les personnes atteintes.
Elle est liée à la disparition des neurones de la voie nigro-striée, qui jouent un rôle fondamental dans la commande des mouvements volontaires et qui, de plus, interviennent dans de nombreux contrôles neuropsychiques : la MP trouble de très nombreuses régulations et n’est pas seulement la maladie neuromusculaire du tremblement des doigts de la main.
En France, la prévalence est de 1 pour 1000 habitants dans la population globale ; cette prévalence augmente de manière exponentielle après l’âge de 50 ans ; elle est de 1.5 pour 100 au-delà de 65 ans. Le sexe ratio est de 1.
En moyenne, elle débute vers 55/57 ans mais on estime à 10% les patients atteints entre 25 et 40 ans. Il existe de rares cas avant 25 ans.
La MP n’a actuellement pas de causes connues, elle est dite idiopathique. Hormis certaines formes familiales à début précoce, elle n’est pas héréditaire. Par contre, les recherches actuelles permettent de dire qu’il existe des facteurs géniques de prédispositions, une vulnérabilité anormale et génétiquement déterminée des neurones dopaminergiques à des facteurs environnementaux variés (entre autres, certains pesticides ou solvants).
Physiopathologie :
La dégénérescence des neurones dopaminergiques touche principalement, dans le cerveau, le « locus niger » où se trouve le corps des neurones et le « striatum » où se trouvent leurs terminaisons. Les signes cliniques de la MP n’apparaissent que lorsque 70% a 80% des neurones sont détruits.
Les manifestations cliniques s’expliquent par les connexions fonctionnelles entre le locus niger et le striatum : la dopamine, fabriquée par ces neurones, est l’initiateur et le régulateur de l’exécution de l’ordre moteur. Elle est sécrétée et libérée dans l’espace entre deux cellules nerveuses : l’espace inter-synaptique.
Sur le plan moteur, le locus niger contrôle un centre sous-jacent : le noyau sous-thalamique qui lui sécrète de l’acétylcholine. Celle-ci a pour effet de faire contracter le muscle.
Lorsque cela fonctionne correctement, la dopamine va réguler en la bloquant la sécrétion d’acétylcholine et ainsi régler le tonus du muscle aussi bien au repos qu’à l’exécution d’un exercice volontaire. Par contre en cas de manque :
— au repos, la contraction des muscles, provoquée par l’acétylcholine, rapide et discontinue, provoque le tremblement ou une raideur importante par tonus excessif ou hypertonie.
— Au mouvement, l’absence de régulation provoque un ralentissement dans l’exécution des mouvements volontaires : c’est la lenteur parkinsonienne ou bradykinésie qui peut aller jusqu’à l’absence mouvement, l’akinésie.
Selon le professeur POLLAK : « La maladie de Parkinson est une maladie non seulement motrice, mais neuropsychiatrique : les complications psychiques observées sous traitement dopaminergique émergent comme le résultat d’une balance parfois subtile entre l’effet direct de ces traitements, la personnalité préalable du patient atteint et les lésions cérébrales dues à la maladie. »
Ceci explique non seulement la très grande variété des symptômes de la MP mais aussi leur caractère parfois « insolite et aberrant » pour le patient ou son entourage.
Les différents signes cliniques :
— Le tremblement au repos disparaît lors du mouvement volontaire et du maintien de l’attitude. L’émotion et la concentration l’augmentent. Il prédomine sur la main.
— Bradykinésie et akinésie ou retard à la mise en route des mouvements volontaires : perte des mouvements automatiques. Cela se traduit par : la micrographie, la perte du ballant du bras lors de la marche, lenteur de certains gestes (se raser, se boutonner), visage inexpressif, figé, la dysarthrie parkinsonienne (parole lente, assourdie, monotone)
— Rigidité plastique d’origine extrapyramidale : douleurs cervicales, lombaires ou des membres supérieurs. Ce qui se traduit par : une marche perturbée (lente à petits pas) parfois accélérée (la festination) voire impossible (le freezing) ; une posture générale en flexion vers l’avant.
— L’acathésie : besoin impérieux de se lever et de marcher, fréquemment constatée lors de l’évolution.
Accessoires de ces différents signes typiques : l’instabilité posturale (risque de chutes), la fatigue, la « crampe de l’écrivain », le pied qui accroche, les douleurs (musculaires, des dystonies), les troubles du sommeil, les manifestations neuropsychiatriques (anxiété, dépression, hallucinations visuelles, confusion).
Différents troubles sont également associés à la MP, également provoqués par les médications : troubles intellectuels (concentration et mémoire immédiate, difficultés de planification, de synthèse) ; troubles de la paroles (articulation, phonation, ton et rythme) ; troubles digestifs, urinaires, sexuels (impuissance ou hypersexualité) ; troubles visuels ; hypotension artérielle.
Traitements médicamenteux disponibles
Rappel : la dopamine est secrétée et libérée dans l’espace inter-synaptique et telle une clé dans une serrure, elle va se fixer sur un récepteur dopaminergique du neurone suivant transmettant ainsi un message.
Le traitement consiste à remplacer le neurotransmetteur manquant suivant quatre formules complémentaires :
— Les précurseur de la dopamine : la Lévodopa ou L‑dopa commercialisée sous deux formes Modopar et Sinemet.
— Les inhibiteurs de la dégradation de la Dopamine : Amantadine, le Deprenyl pour la MAO‑B (monoamine oxydase B), le Tasmar ou le Comtan pour le COMT.
— Les agonistes dopaminergiques jouant le même rôle que la dopamine : par voie orale, les ergopeptines (Parlodel, Dopergine, Celance) ; en injection sous-cutanée l’Apomorphine.
— Le libérateur de dopamine : l’hydrochlorure d’amantadine.
Traitement chirurgical
L’équipe Benabib et Pollak à Grenoble a conçu dès 1993 une méthode thérapeutique ayant pour cible chirurgicale le noyau sous-thalamique : la stimulation électrique à l’aide d’électrodes implantée dans ce noyau qui permet de régler le degré d’inhibition des cellules cibles. Mais cette méthode ne concerne qu’entre 10% et 15% des malades parkinsoniens.
Recherches et essais en cours pour rétablir la sécrétion de dopamine
Pour y parvenir, les recherches s’orientent essentiellement dans plusieurs directions : la greffe de cellules embryonnaires , la greffe de cellules génétiquement modifiées et la thérapie génique qui consiste à introduire un gène codant la synthèse de la dopamine dans des neurones du striatum. Pour cela, il s’agit, à l’aide d’un vecteur – généralement un virus inactivé et génétiquement modifié – qui sert de cheval de Troie, d’introduire dans les neurones du striatum un gène portant un facteur neurotrophique ; c’est-à-dire qui stimule la survie des neurones.
Les progrès thérapeutiques des années à venir sont à attendre avant tout dans l’amélioration du traitement par la L‑dopa et la réduction de ses effets secondaires.
Les choses importantes qu’on ne vous dira jamais !
Il est fondamental de bien comprendre que la MP est un handicap intermittent qui gêne de façon plus ou moins marquée l’activité normale quotidienne.
Les « vrais choses » concernant la MP à expliquer à l’entourage et au public :
Les signes classiques :
— La rigidité et l’akinésie : Imaginez que vous êtes porteur en permanence d’une combinaison de plomb qui pèse et gêne chacun de vos mouvements et que, parfois, vous avez de plus l’impression de marcher contre le courant d’une rivière. C’est à peu près ce que l’on ressent lorsqu’on est en phase d’akinésie : le désir de bouger est là, et pourtant la main, le pied ne bouge pas ou à la vitesse d’un escargot.
— Le tremblement : ce n’est pas juste « sucrer les fraises ». Un mouvement simple reste possible (claquer une portière par exemple). Couper avec un couteau ou piquer avec une fourchette, boire ou manger deviennent presque impossible ou très gênant (verres renversés, tâches ou nappes maculées…).
— Marcher devient difficile, les chutes sont fréquentes. S’habiller, défaire des boutons, lire une feuille de papier tenue à la main, trier sa monnaie dans un porte-monnaie, etc.…
Tout doit être fait et refait sans cesse plusieurs fois : c’est mentalement, physiquement et psychologiquement épuisant ; sans compter tout ce qu’on évite de faire par peur de l’échec.
Les signes moins connus de tous :
— Variabilité dans le temps : être parkinsonien, c’est être handicapé de façon intermittente. A tel moment vous êtes « une statue » quelque temps plus tard vous danseriez la samba puis de nouveau vous êtes « coulé dans le béton armé ».
— Alternances des périodes « on » et « off ». Quant la personne atteinte est dans un bon moment, elle donne l’illusion (du moins au début de la maladie) que tout va bien : comme pour un bouton électrique on dit qu’il est sur ON. Lorsque le parkinsonien n’est plus correctement soulagé par les médicaments, il ressent alors une fatigue extrême et les signes moteurs (tremblement, akinésie, dyskinésie) sont au maximum : période OFF.
— Ceci peut également se produire plus particulièrement en cas de stress, d’émotion, de peur, d’agressions de toute sorte (bruit, foule) ou d’horaire à respecter !
— Variabilité dans le type de difficultés : plus les mouvements requièrent de complexités, d’enchaînements et de contrôles multiples, plus ils seront difficiles à réaliser. Il est plus facile de serrer une poignée de porte que d’enfiler une aiguille, de marcher que d’apprendre un pas de danse compliqué. Mais inversement, il est plus facile de monter un escalier que de faire un pas pour franchir une porte !
Fatigue et fatigabilité : La MP est épuisante car les moindres gestes, les moindres paroles ne sont plus sous « pilotage automatique »… Tout doit être pensé comme « si c’était la première fois ». Et c’est d’autant plus fatigant que la peur de ne pas y arriver est là, constante, une peur qui conduit le plus souvent à éviter les situations difficiles et à s’isoler des autres.
Le parkinsonien ne peut ni faire plusieurs actes en même temps, ni les réaliser sans une performance volontaire : installé à la terrasse d’un café, pour boire vous devez quitter des yeux votre interlocuteur et, concentré sur la tasse de café, vous ne pouvez plus répondre aisément ; votre visage se contracte ; vous paraissez soudain muré dans votre maladie.
L’ensemble de ces signes qui ne sont pas, heureusement, tous présents en permanence et pour tous, conduit l’immense majorité des parkinsoniens à s’isoler du monde extérieur et modifier son comportement ce qui déroute l’observateur : si on ne pense pas obligatoirement « comédie », on pense « paresse », manque de volonté ou « tête de mule ».
Du fait de la rigidité de son visage, de ses mimiques peu ou pas marquées, de son regard un peu figé, la personne atteinte de Parkinson paraît triste ou donne l’impression de « faire la gueule » !
Rappelez-vous que la personne atteinte de la maladie de parkinson ne fait pas exprès et que c’est bien plus difficile pour lui que vous ne le pensez, d’autant que votre regard impatienté ou agaçé le stresse vite ce qui va augmenter sa lenteur et ses troubles du comportement.
L’investissement intellectuel et psychoaffectif pour vivre avec la MP est très important. Parfois par trop de solitude ou d’isolement, trop de difficultés liées à la maladie, le malade cesse de s’adapter, abandonne le combat et toute joie de vivre.
La dépression, plus fréquente chez le parkinsonien, est liée à plusieurs phénomènes :
— Liée au phénomène chimique du manque de dopamine, elle est visible « en fin de dose » en période OFF.
— La multitude des « deuils » à faire dans les activités (perte d’autonomie, de son métier, de ses amis quelque fois de son partenaire…)
— De plus l’estime de soi et la confiance en soi sont rapidement altérées dans cette maladie où l’on ne peut pas compter sur soi-même.
Cela étant, il est inutile de penser qu’un parkinsonien est par essence dépressif et il n’y a pas lieu de lui administrer systématiquement des médicaments spécifiques. La psychothérapie, quant cela s’avère nécessaire, fait des merveilles ainsi que toutes les techniques permettant une relaxation que ce soit le yoga, la sophrologie, etc.…
Les troubles du sommeil : classiquement le parkinsonien dort peu la nuit et somnole dans la journée. Cette somnolence diurne est plus liée à la fatigue du travail musculaire et aux effets secondaires des médicaments qu’à l’insomnie nocturne. Pour autant, l’insomnie est plus une notion qualitative : il s’agit d’un manque de sommeil nocturne qui gêne le sujet et a des conséquences négatives sur lui.
Médecins ou spécialistes ? Sans l’ombre d’une hésitation et sans la moindre intention de froisser les généralistes, il faut impérativement être suivi par un spécialiste en neurologie, l’idéal étant un neurologue spécialisé dans la MP. En effet, le généraliste ne peut suivre tous les détails de cette maladie et de son traitement qui est en constant changement pour s’adapter au patient et introduire de nouvelles drogues. Cela n’empêche pas de voir son généraliste entre deux consultations et ainsi lui permettre de parfaire ses connaissances.
Il faut établir un partenariat avec le corps médical car nul ne connaît mieux que le parkinsonien SA maladie, nul mieux que le neurologue ne connaît LA maladie de Parkinson
Les cocktails médicamenteux : La réponse à la dopamine exogène s’estompe à la longue et des effets secondaires très gênant, des mouvements anormaux répétés en crise et souvent violents, les dyskinésies, altèrent fortement la qualité de vie des patients. C’est pourquoi de essais sont en cours sur des molécules agonistes pour lesquelles on espère l’absence de dyskinésies secondaires ainsi que sur d’autres médicaments qui pourraient supprimer ce très gros problème
Le neurologue va donc essayer un « cocktail » équilibré pour diminuer les doses de L‑dopa au profit d’agonistes ce qui va multiplier le nombre de « pilules » à prendre à des horaires bien spécifiques et qu’il faut impérativement respecter. En effet, tout retard de quelques dizaines de minutes peut aboutir à quelques heures très difficiles d’akinésie, de tremblement ou de dyskinésie qui gênent tous les mouvements et ne cèdent plus malgré les prises.
Le rôle de l’entourage : il est essentiel et difficile. Il est évident pour tout le monde qu’il faut, autant que possible, laisser le malade effectuer le maximum d’activité, même s’il est lent ; mais à l’inverse il ne faut tomber dans l’indifférence. De nombreux moments sont déconcertant tant pour le patient que pour l’entourage.
En 2001, Novartis Pharma a réalisé, avec France Parkinson, une enquête pour juger des conséquences sur la vie et la santé des conjoints. Elle fait apparaître de réelles difficultés et le manque de structures d’accueil « temporaires » permettant de les aider dans leurs rôles et les soulager.
Il y a des malades exigeants voire tyranniques, comme il y a des conjoints qui bousculent leur « malade » et leur font payer, heure après heure, l’aide qu’ils leur apportent à contrecœur. Mais il est impératif de dire et redire les difficultés bien réelles de leur entourage, pour que les malades en deviennent bien conscients
La maladie est un fait, un aléa de la vie, et c’est la regarder bien en face et lucidement que d’en cerner tous les aspects et les conséquences, que d’en parler « en équipe » pour trouver des solutions adéquates pour tous.
Résumé proposé par Jean GRAVELEAU, réalisé à partir des notes de Anne FROBERT
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.