Helicobacter pylori : une bactérie responsable de Parkinson ?
Publié le 07 avril 2012 à 22:28Article paru dans LE PARKINSONIEN INDÉPENDANT n°48 – avril 2012
Une étude présentée en mai dernier lors du congrès de l’American Association for Microbiology (1) a relancé le débat sur les causes de la maladie Parkinson. Après les facteurs génétiques et le rôle de l’exposition à des agents chimiques (2), les chercheurs pointent en effet la responsabilité d’Helicobacter pylori, une bactérie capable de coloniser l’estomac humain et déjà connue pour provoquer des ulcères.
Helicobacter pylori est une vieille compagne de l’espèce humaine. En 2007, des chercheurs ont, en effet, découvert qu’elle était probablement présente il y a 58.000 ans dans l’estomac d’environ la moitié des Homo sapiens de souche africaine avant les grandes migrations des êtres humains vers l’Asie et l’Europe (3). De même, elle est bien connue de la microbiologie. Dès 1875, des scientifiques allemands ont identifié sa trace dans l’estomac humain.
Ce n’est toutefois qu’en 1982 que les chercheurs australiens J. Robin Warren et Barry J. Marshall ont mis en évidence sa dangerosité. Dans des travaux couronnés en 2005 par un Prix Nobel de Médecine, ils ont démontré qu’elle était responsable de l’essentiel des ulcères de l’estomac, jusque-là attribués à une alimentation excessivement épicée. Une découverte fondamentale au plan thérapeutique puisque, désormais, la plupart des ulcères sont traités avec succès par des traitements antibiotiques tuant la bactérie. Un lien maintenant établi formellement.
Toutefois, l’étude présentée lors du 111e congrès de l’American Association for Microbiology devrait faire date. Les chercheurs soutiennent en effet qu’Helicobacter pylori est également impliquée dans le développement de la maladie de Parkinson. L’idée n’est pas totalement inédite. De précédentes études avaient, en effet, observé une corrélation entre les ulcères de l’estomac et la maladie de Parkinson ainsi qu’une présence plus fréquente de cette bactérie chez les patients souffrant de la maladie de Parkinson. De même, le suivi des patients avait révélé que ceux qui suivaient un traitement antibactérien voyaient leur état s’améliorer.
L’étude rendue publique en mai dernier vient confirmer ce lien. Après avoir inoculé la bactérie à des souris de tous âges, les chercheurs ont observé l’évolution de leur activité locomotrice et de leur taux de dopamine. Il est en effet établi de longue date que la maladie de Parkinson résulte d’une chute du taux de cette hormone sécrétée par le « locus niger », une zone spécifique du cerveau. Or, chez les souris infectées par Helicobacter pylori, la sécrétion de dopamine s’effondre au bout de 3 à 5 mois.
De nouvelles pistes de traitement
Dès lors, pour les chercheurs, la responsabilité d’Helicobacter pylori dans le développement de la maladie de Parkinson ne fait plus guère de doute. Ils estiment que la maladie de Parkinson résulte vraisemblablement de la sécrétion de substances toxiques par certains types de bactéries comme Helicobacter pylori. Ils évoquent ainsi un composé similaire au cholestérol, mais qui s’avère être, selon eux, un neurotoxique responsable de la progression de maladie.
Sans remettre en cause les autres études et hypothèses sur les causes de la maladie de Parkinson –qui s’avère en effet être une pathologie à causes multiples – , cette étude ouvre la voie à de nouvelles pistes en matière de traitement ou de dépistage des populations à risque. Elle constitue donc un motif d’espoir légitime pour les malades et leurs familles.
Compléments d’information :
(1) « Helicobacter pylori infection induces Parkinson’s Disease symptoms in aged mice ». M.F. Salvatore, S.L. Spann, D.J. Mcgee, O.A. Senkovich, & T.L. Testerman. Presentation at the 111th General Meeting for the American Society for Microbiology. 2011 May 22. New Orleans , LA
(2) Pour une première approche de la maladie de Parkinson, ses causes, ses effets et des traitements actuellement disponibles, on peut consulter les interventions de spécialistes mises en ligne sur le site www.infopatients-lundbeck.fr.
(3) « An African origin for the intimate association between humans and Helicobacter pylori ». Bodo Linz, François Balloux, Yoshan Moodley, Andrea Manica, Hua Liu, Philippe Roumagnac, Daniel Falush, Christiana Stamer, Franck Prugnolle, Schalk W. van der Merwe, Yoshio Yamaoka, David Y. Graham, Emilio Perez-Trallero, Torkel Wadstrom, Sebastian Suerbaum and Mark Achtman. Nature. 2007 February 22 ; 445(7130): 915 – 918
Le 5 décembre 2011 par lucierobia Le Parisien
Lu et transmis par Pierre LEMAY
A tous les malades victimes des pesticides
Publié le 12 janvier 2012 à 09:33Article paru dans LE PARKINSONIEN INDÉPENDANT n°47 – janvier 2012
Des malades ayant subi des séquelles de maladies graves dues aux pesticides, ont souhaité se rencontrer pour créer une association nationale.
Après plusieurs réunions de préparation, conseillés par d’autres associations, un cabinet d’avocats spécialisés, des chercheurs, une cinquantaine de personnes atteintes de cancer, sclérose en plaque, maladie de Parkinson se sont réuni à Ruffec en Charente, le 19 mars 2011. La journaliste Marie Monique Robin auteur des livres : Le monde selon MOSANTO et Notre Poison Quotidien était à Ruffec la veille, comme elle l’avait annoncé lors de son passage à la télévision quelques jours plus tôt.
La plupart des médias ayant été informée de la création de l’association, le jour même, il y a eu de nombreux appels de personnes regrettant de ne pouvoir y participer, l’ayant su trop tard. Ce qui montre l’utilité d’une telle association.
Dans la foulée, un Conseil d’Administration a été constitué, puis un bureau a été élu. Paul François a été élu à l’unanimité, très médiatisé pour avoir réussi à faire reconnaître sa maladie de Parkinson, provoquée par un produit MOSANTO (que j’ai utilisé également). Ce produit lui a provoqué une violente réaction puisqu’il a perdu connaissance, intoxiqué par les gaz en ouvrant son pulvérisateur. La partie très dangereuse de la composition de ce produit, découverte par l’INSERM, n’était pas mentionnée. Par conséquent, il attaque en justice. Voir l’épilogue sur Internet.
L’association PHYTO – VICTIMES se donne pour but, entre autres : d’apporter conseils scientifiques et juridiques aux professionnels utilisateurs de pesticides, de faire valoir leurs droits et obtenir compensation des préjudices subis et aussi faire inscrire la maladie de Parkinson au tableau des maladies professionnelles, ce qui n’est pas simple surtout si l’on reste isolé.
Plus nous serons nombreux à en faire la demande, plus tôt nous obtiendrons la reconnaissance nationale.
Gilles GODET, agriculteur retraité parkinsonien
N° téléphone : 0549814294
Internet : gilles.godet@orange.fr
Transmis par Raoul GRIFFAULT
Menaces sur nos neurones
Publié le 06 janvier 2012 à 13:10Article paru dans LE PARKINSONIEN INDÉPENDANT n°47 – janvier 2012
En même temps que je prenais connaissance de l’actualité pleine d’espoir (cf. l’article de Science et Vie), je lisais les propos recueillis par Sophie Chapelle, concernant le livre de Marie Grosman, et Roger Lenglet, « Menaces sur nos neurones », Editions Actes Sud, 2011 283 pages.
Marie Grosman est agrégée de sciences de la vie et de la Terre, spécialisée en santé publique et en santé environnementale. Elle a publié des travaux scientifiques sur les facteurs environnementaux des maladies neurodégénératives. En gros elle dénonce : « l’habitude de raisonner sur le mode « Pasteurien » : un virus = une maladie. Dans un monde où les produits chimiques sont devenus omniprésents, leurs effets se combinent, et les maladies sont multifactorielles. Mais les principaux coupables sont connus. Grâce à une étude épidémiologique de 1995, par exemple, on sait qu’au taux de 100 microgrammes/l’aluminium dans l’eau du robinet multiplie par deux ou trois le nombre de cas d’Alzheimer », écrit-elle. Elle dit aussi qu’en France les causes des maladies neurologiques sont parfaitement identifiées !!! Ils dénoncent dans ce livre les nombreux conflits d’intérêts, sur lesquels ils ont enquêté, et qui paralysent toute la politique de prévention !!!
Elle cite, entre autres, la maladie de parkinson et la sclérose en plaque qui sont aussi en progression ? Nous sommes face à une pandémie neurologique qui ne cesse d’empirer. Ce livre dénonce que nous vivons dans un monde neurotoxique …
J’ai trouvé cet interview je crois dans mes alertes Google …
J’ai été sidérée de comprendre et d’apprendre que les causes de notre maladie sont connues mais qu’une politique de prévention dévoilerait beaucoup trop de conflits d’intérêts !
Lu par Lucie Michèle Salentiny
Essais cliniques et autorisation de mise sur le marche (AMM)
Publié le 04 janvier 2012 à 11:10Article paru dans LE PARKINSONIEN INDÉPENDANT n°47 – janvier 2012
Le développement d’un nouveau médicament pour le traitement d’une maladie humaine est une entreprise très régulée, nécessitant des années de recherche et un important investissement en temps, en argent et en moyens humains. Le chemin à parcourir pour passer d’un produit prometteur jusqu’à l’obtention d’un médicament approuvé prend souvent de 10 à 15 ans, et la plupart des produits expérimentés (plus de 90%) ne vont jamais aussi loin.
La durée de développement du produit peut créer de l’impatience et de la frustration chez le patient et sa famille, chez les médecins, et les firmes pharmaceutiques. Mais chez tous les acteurs concernés, il y a un large assentiment pour exiger une évaluation scientifique du produit.
Après plusieurs années d’études en laboratoire, puis éventuellement des essais sur des cobayes animaux, le produit (ce candidat médicament !), devra, avant d’être autorisé à la mise sur le marché (AMM), subir un certain nombre de tests, appelés essais cliniques.
Les essais cliniques :
Les autorités gouvernementales exigent que tous les médicaments potentiels passent une série de tests avant d’être proposés aux malades. Ces tests comprennent les essais cliniques qui ont pour but d’examiner l’innocuité et l’efficacité d’un médicament potentiel. Les essais cliniques se déroulent en 3 phases successives, avant l’approbation du médicament, ces phases pouvant se superposer. Généralement, les phases se déroulent de la façon suivante :
Phase I : Ces essais cliniques sont l’occasion de la première application du produit à des sujets humais, en fait des volontaires en bonne santé. Ces essais ont pour but de déterminer l’innocuité, les effets indésirables, la tolérance, l’absorption, la distribution, le métabolisme, l’élimination et la pharmacocinétique.
Phase II : Ces essais cliniques sont réalisés sur un nombre limité de patients. Ils ont pour but : d’évaluer l’efficacité du médicament pour des indications spécifiques et ciblées, de déterminer le dosage toléré et de dosage optimal, d’identifier les effets indésirables possibles et les risques.
Bien qu’il n’y ait pas de définition officielle, on utilise parfois les termes Phase IIa et Phase IIb.
La Phase Iia est utilisée pour décrire un essai clinique évaluant l’efficacité , les effets indésirables et les risques sanitaires.
La Phase IIb, succédant à Iia, elle évalue la tolérance au dosage, la fréquence optimale du dosage, et cela sur un nombre de patients plus important que dans la phase Iia.
Ces essais de Phase II concernent pour la première fois des patients atteints de la maladie. Ces patients sont répartis de façon aléatoire (ramdom) en 2 groupes, l’un recevant le produit, l’autre un placebo et selon une procédure en double aveugle. Les résultats des patients des 2 groupes sont comparés à la fin de l’essai.
Phase III : Si on trouve que le produit est potentiellement efficace et présente une innocuité acceptable dans l’essai de Phase II, le programme des essais cliniques sera étendu pour démontrer l’efficacité, le dosage optimal et l’innocuité du produit et cela sur une population étendue de malades sur des sites dispersés géographiquement. En fait, les essais de Phase III concernent de plusieurs centaines à plusieurs milliers de patients selon la maladie et l’importance espérée de l’effet du produit.
Par ailleurs, plus l’efficacité du produit est faible, plus le nombre de patients de l’essai III devra être élevé. Comme en Phase II, les patients sont répartis de façon aléatoire en 2 groupes, selon la procédure en double aveugle, pour une comparaison patients avec produit/patients avec placebo.
Phase IV : Nous citerons pour mémoire la Phase IV qui recouvre les essais sur le médicament après sa mise sur le marché.
L’autorisation de mise sur le marché (AMM)
L’autorisation de mise sur le marché ou AMM est l’accord donné à un médicament pour être commercialisé. Lorsqu’un laboratoire pharmaceutique désire mettre en vente un produit de santé (médicament, produit d’analyse, etc), il doit présenter un dossier auprès de l’autorité compétente du pays concerné : l’Agence Française de Sécurité Sanitaire des Produits de Santé (AFSSAPS) pour la France, la Food and Drug Administration (FDA) aux Etats-Unis, l’Agence Européenne des Médicaments (EMEA) en Europe. Le dossier déposé auprès de l’autorité compétente est établi à partir des résultats obtenus à l’issue des essais de Phase III.
Cet article a été rédigé à partir des articles cités en bibliographie, traduits et résumés.
Jean Pierre LAGADEC
Bibliographie :
‑Site Internet de Santhera Pharmaceuticals à la rubrique Fipamezole
‑Discovering and Developing New Medications, The long and challenging journey de William T Andrews
Les troubles cutanés
Publié le 03 janvier 2012 à 12:20Article paru dans LE PARKINSONIEN INDÉPENDANT n°47 – janvier 2012
Parmi tous les symptômes associés à la maladie de Parkinson, les troubles cutanés ne sont pas très fréquents, mais ils sont néanmoins désagréables et dévalorisants. Beaucoup de ces troubles cutanés sont dus à la maladie elle-même, mais parfois aussi seraient dus aux effets indésirables des médicaments antiparkinsoniens.
Le traitement de ces troubles consiste à adjoindre aux traitements antiparkinsoniens (qui doivent rester prioritaires), un traitement dermatologique adapté au patient.
Types de troubles cutanés dans la maladie de Parkinson.
- La peau grasse. Il y a onctuosité excessive de la peau sur le visage, en particulier sur le front et sur les ailes du nez, et cela donne à la peau un aspect gras et luisant.
- Les pellicules. Le cuir chevelu peut devenir gras, ce qui provoque cheveux gras et pellicules.
- La dermatite séborrhéique. Une inflammation de la peau peut survenir, provoquer la rougeur de la peau et des démangeaisons, avec une tendance à l’écaillage.
- La peau sèche. Dans certains cas, il y a une extrême sécheresse de la peau due à une transpiration insuffisante.
- La transpiration excessive, qui est un trouble très désagréable. Les sueurs nocturnes sont très fréquentes chez les patients atteints de la maladie de Parkinson.
Causes des troubles cutanés dans la maladie de Parkinson
- Les troubles cutanés peuvent survenir comme conséquence de la maladie de Parkinson et d’un mauvais fonctionnement du système nerveux autonome, ou parfois comme un effet secondaire de médicaments antiparkinsoniens.
- Les glandes sébacées de la peau produisent de la matière sébacée ou sébum, qui aide à protéger la peau et à la maintenir souple. Une production excessive de sébum peut se produire dans la maladie de Parkinson. Les zones qui contiennent le plus de glandes sébacées, comme le front, les ailes du nez, et le cuir chevelu sont plus sévèrement touchées. Cela provoque la peau grasse et des pellicules et dans des cas extrêmes, la peau peut devenir rouge, enflammée et peut démanger. La chaleur peut exacerber ce problème.
- Dans la maladie de Parkinson, les glandes sudoripares peuvent produire trop ou trop peu de sueur provoquant des problèmes de transpiration excessive ou de peau sèche. Les médicaments antiparkinsoniens ont aussi des effets secondaires provoquant trop de transpiration (avec des médicaments tels que la L‑dopa), ou trop peu de transpiration (avec des anticholinergiques).
Traitement des troubles cutanés dans la maladie de Parkinson
- Pour les peaux huileuses et graisseuses, les traitements standards, tels que ceux utilisant un savon neutre (savon à la glycérine non parfumé) et ceux consistant à laver la peau deux fois par jour avec de l’eau tiède et rinçage à l’eau froide, sont efficaces. Il est préférable d’utiliser des gels car ils sont à base d’eau, plutôt que des crèmes qui sont à base d’huile. Dans les cas les plus sévères, une crème contenant de l’acide salicylique, peut être plus efficace.
- Lotions et shampooings divers sont disponibles pour le traitement des pellicules. Des produits contenant du sulfure de sélénium peuvent donner de bons résultats.
- Les dermatites séborrhéiques peuvent nécessiter un traitement avec des lotions contenant l’hormone adrenocorticotrope (ACTH), ou une crème contenant du kétoconazole. Le shampooing au goudron peut être efficace pour le front et les sourcils.
- Prendre des douches tièdes, porter des vêtements légers en coton, en été, et boire beaucoup d’eau et de liquides pour récupérer sont utiles dans la lutte contre les effets de la transpiration excessive.
- La transpiration excessive peut parfois être due aux effets secondaires des médicaments antiparkinsoniens tels que la L‑dopa. On pourra ajuster la dose de L‑dopa, en utilisant une préparation à libération prolongée, ou bien utiliser un inhibiteur de la COMT ; Les bétabloquants, et les anticholinergiques, peuvent aussi être utiles, dans certains cas.
- En cas de transpiration insuffisante, on pourra réduire la dose d‘antiparkinsoniens, par exemple celle d’anticholinergiques.
Conclusion
Les troubles cutanés, c’est à dire les maladies de la peau, l’irritation et les divers excès de transpiration, sont dus, soit à la maladie de Parkinson elle même, soit aux effets indésirables des traitements antiparkinsoniens. A défaut d’être graves, ils sont désagréables et dévalorisants pour le patient. Mais ils peuvent être soignés.
Les traitements utiliseront des médicaments dermatologiques et la posologie des médicaments antiparkinsoniens (L‑dopa et anticholinergiques) sera adaptée.
Bien entendu, il faut consulter un neurologue ou un dermatologue, qui a la compétence et les moyens, pour réaliser cette alchimie.
Lu, traduit et copié dans Skin Diseases and Irritation in Parkinson’s disease
Par Jean Pierre LAGADEC
Faut-il continuer avec Azilect ?
Publié le 30 décembre 2011 à 15:02Article paru dans LE PARKINSONIEN INDÉPENDANT n°47 – janvier 2012
L’Azilect (Rasagiline) a été mis sur le marché en Europe en 2005 et aux Etats Unis en 2006, avec l’indication d’IMAO‑B (inhibiteur de la Mono Amine Oxydase, médicament de type antidépresseur, améliore l’action de la L‑Dopa, attention à l’utilisation d’autres antidépresseurs.).
Ce médicament a fait l’objet de plusieurs articles dans le Parkinsonien Indépendant.
Tout d’abord des articles favorables :
- un article en Décembre 2008, intitulé « la Rasagiline, un nouvel espoir pour limiter la progression de la maladie ? »
- un article en Décembre 2009, intitulé « l’Azilect (Rasagiline,) je l’ai essayé », à un moment où le médicament très cher (6 Euros par jour) n’était pas remboursé par la Sécurité Sociale. Depuis Janvier 2010, le médicament est remboursé, ce qui a permis à de nombreux patients de se le faire prescrire par leur neurologue.
Et puis, il y a eu, en Septembre 2011, l’article de Jean Graveleau, intitulé « Pourquoi, j’ai arrêté l’Azilect », dans lequel l’auteur raconte son expérience malheureuse du médicament.
La parution de ces articles a provoqué de nombreux commentaires sur le site GP 29. Les avis exprimés dans ces commentaires étant particulièrement discordants, il nous a paru intéressant de faire le point sur l’utilisation de l’Azilect.
Pendant la rédaction de cet article, l’actualité nous a proposé une information nouvelle, à savoir l’expertise à la mi-octobre 2011 des résultats de l’étude Adagio par la Food and Drug Administration.
Ce qu’en pensent les patients
Jusqu’à l’article de Septembre 2011, les commentaires qui ont suivi la parution de l’article de 2009 et l’accord de remboursement de la sécurité sociale étaient plutôt positifs. Les patients supportaient bien le produit et constataient assez souvent une certaine amélioration de leur état. Cependant, des avis négatifs étaient exprimés, dans lesquels les auteurs expliquaient que des effets indésirables leur avaient fait abandonner l’Azilect.
Après la parution de l’article de Jean Graveleau en Septembre 2011, on a assisté à une prolifération de commentaires majoritairement négatifs, et cela en raison d’effets indésirables du médicament. On notera toutefois l’expression de quelques commentaires positifs.
Quels sont ces effets indésirables ? Le fabricant Teva en fournit une liste dans la notice d’utilisation du médicament. Cette liste est impressionnante. On y retrouve des effets dont certains ont été victimes : dyskinésies (très fréquentes), constipation, sensation de malaise, dépression (fréquentes). Par contre, on ne trouve pas dans cette liste de risques d’insomnies, ni de diminution de la sexualité, cités par certains patients. Mais Teva précise bien que sa liste n’est pas exhaustive et peut être complétée. Il est compréhensible que la présence de tels troubles entraine l’arrêt de l’Azilect par le patient.
Enfin, on ne trouve pas de commentaire pertinent de patients sur l’effet ralentisseur de l’Azilect sur la progression de la maladie. Par ailleurs, certains patients pensent que l’Azilect n’est efficace qu’à un stade précoce de la maladie. Je pense que cela est inexact, et que même si on commence tard, (mon neurologue me l’a prescrit après 8 ans de maladie), on peut bénéficier au moins partiellement de l’effet ralentisseur, bien entendu sans rattraper le temps perdu !
Ce qu’en pense le corps médical
Dans l’article de Décembre 2009, intitulé « l’Azilect (Rasagiline) je l’ai essayé », l’auteur explique la façon dont ont été menés les essais cliniques de la Rasagiline. Il s’agit de l’étude Adagio, dont les résultats ont été analysés et publiés, dans plusieurs articles, et en particulier dans un article de C.Warren Olanow et de Olivier Rascol dans The New England Journal of Medecine, le 24 Septembre 2009.
Mais si l’étude est terminée, l’analyse des résultats continue et a fait l’objet en 2011 de plusieurs articles dans The New England Journal of Medecine, et certains auteurs ont commencé à contester les résultats et l’effet ralentisseur de l ’Azilect.
Le refus de la FDA (Food and Drug Administration)
Signalons tout d’abord la parution d’une notice de 147 pages produite par le fabricant Teva le 17 Octobre 2011 (Azilect briefing document) et disponible sur Internet dans laquelle le lecteur pourra trouver réponse à beaucoup de questions. Renseignement pris, cette notice était destinée prioritairement à l’administration américaine FDA (Food and Drug Administration). En effet, Teva ayant obtenu en 2006 une AMM (Autorisation de Mise sur le Marché) pour l’indication IMAO‑B, demandait l’extension de l’AMM à l’indication de ralentisseur de la progression de la MP.
Après analyse des documents fournis, FDA a refusé cette extension, les experts désignés ayant jugé que les méthodes et les résultats de l’étude Adagio ne sont pas convaincants (lire l’article FDA advisers refuse Teva …). On attend avec intérêt les réponses du fabricant Teva et des coordinateurs de l’étude Adagio.
Prendre ou ne pas prendre de l’Azilect ?
C’est une question que chaque patient peut poser à son neurologue, qui pourra prescrire en tenant compte des traitements antérieurs et de son expérience du médicament.
En ce qui me concerne, j’ai commencé sur les conseils de mon neurologue à prendre Azilect depuis Avril 2009 et je vais expliquer les raisons pour lesquelles j’ai continué depuis lors. Je pense qu’il faut d’abord essayer le médicament, pour se rendre compte individuellement des effets indésirables. Si ceux-ci se révèlent insupportables, il vaut mieux arrêter, après avis de son neurologue. N’ayant pas été confronté depuis plus de 2 ans à des effets indésirables, j’ai pu continuer le traitement très facile à suivre (1 comprimé par jour).
Notons que l’Azilect est à l’origine un IMAO et que cette indication n’est pas contestée.
Par ailleurs, ce médicament est actuellement le seul sur le marché annoncé comme ralentisseur de la progression de la MP. Enfin, il est intégralement remboursé par l’assurance maladie aux patients reconnus en Affection de Longue Durée (ALD). Ces deux derniers points me paraissent très importants et ont beaucoup influencé mon choix, en faveur de l’Azilect.
On pouvait à ce stade de la réflexion, se poser des questions plus difficiles :
Le patient peut il mesurer un ralentissement de la progression de sa maladie ? Raisonnablement non, car le gain espéré sur l’échelle d’évaluation de la maladie de Parkinson UPDRS est trop faible et ne peut être mesuré et interprété que par des neurologues. Y a‑t-il ralentissement ? On a vu que, si l’analyse des mesures faites dans l’étude Adagio semble confirmer le ralentissement, cette interprétation des mesures a été contestée, depuis 2009. Le patient doit donc croire aux vertus de l’Azilect, en tant que ralentisseur de la progression de sa maladie. C’était mon cas !
En conclusion, jusqu’à présent n’ayant pas subi d’effet indésirable, et dans l’espoir d’un ralentissement, j’ai pensé que je pouvais continuer à prendre l’Azilect ! C’est le choix que j’avais fait.
Aujourd’hui, compte tenu de l’avis des experts de la FDA, ma croyance en l’Azilect a été ébranlée. Je dois solliciter l’avis de mon neurologue et reprendre complètement ma réflexion.
Bibliographie :
- Azilect Briefing Document du 14 Octobre 2011
- FDA advisers refuse Teva plea to expand Azilect label — Haaretz du 19 octobre 2011
Par Jean Pierre LAGADEC
Parkinson l’incroyable hypothèse !
Publié le 29 décembre 2011 à 09:01Article paru dans LE PARKINSONIEN INDÉPENDANT n°47 – janvier 2012
Et si la maladie de Parkinson n’était pas une pathologie du cerveau, mais … une maladie infectieuse, qu’un pathogène déclencherait dans les intestins ? Emise depuis une dizaine d’années, cette hypothèse « incroyable » commence à devenir crédible. Or, une infection, ça se soigne !
[…] L’origine de cette maladie neurodégénérative – comme Alzheimer – reste en effet incertaine, ce qui recule d’autant la possibilité d’en venir à bout. Pourtant, il y a moins de dix ans, le chercheur Heiko Braak, anatomiste et professeur à l’université de Francfort, formulait une hypothèse littéralement « incroyable » tellement elle allait à l’encontre de la vision classique de la maladie de parkinson… Selon lui, non seulement la maladie de Parkinson serait la conséquence d’une banale infection par une bactérie ou un virus ; mais la dégénérescence des neurones du cerveau ne serait qu’une conséquence ultime d’un long processus amorcé des années auparavant dans les intestins…
Heiko Braak n’est pas un simple amateur. Au début des années 90, c’est lui qui décrivit l’évolution de la maladie d’Alzheimer au niveau cellulaire. Anatomiste, son travail quotidien consiste à examiner des coupes cellulaires de personnes autopsiées. Or, en 2003, il s’aperçoit que certaines personnes ont développé des lésions neuronales typiques de la maladie de Parkinson dans d’autres zones du cerveau que celle où ces lésions sont traditionnellement observées (la « substance noire »), alors même que ces patients n’avaient pas été diagnostiqués malades…
L’idée se forme alors en lui que la maladie pourrait peut-être apparaître en dehors de la substance noire, où elle ne migrerait qu’ensuite, à mesure de son évolution. L’examen attentif d’autres coupes va peu à peu lui confirmer : d’autres neurones du corps humain, ceux situés au niveau des l’intestins, présentent des lésions typiquement parkinsoniennes alors que la substance noire, elle, est indemne. En clair : la maladie est apparue ailleurs que dans le cerveau et avant de frapper celui-ci ! Et voila qui change tout. Car, dès lors, c’est une toute nouvelle vision de la maladie qui surgit : elle pourrait avoir une origine infectieuse, probablement au niveau du tube digestif. La maladie ne serait donc pas une fatalité liée à l’âge ou à la génétique. Et surtout, comme la plupart des infections, il serait possible de la guérir !
[…] Ainsi va dans ce sens l’observation récente d’un cas de régression des symptômes caractéristiques de la maladie de Parkinson à la suite d’un traitement par des antibiotiques visant la bactérie intestinale Clostridium difficile : un homme de 73 ans, diagnostiqué parkinsonien depuis 4 ans, venu se faire soigner pour une constipation chronique dans une clinique spécialisée dans les troubles digestifs à Sydney. « Nous supposions que sa constipation était la conséquence d’une infection intestinale. Après quelques semaines sous antibiotiques, son transit était redevenu normal », raconte Thomas Borody, gastro-entérologue qui l’a soigné. « Mais surtout, la personne qui prenait soin de ce patient à domicile est venue me raconter à quel point les symptômes de sa maladie avaient régressé. L’homme pouvait à nouveau faire des gestes de la vie courante comme s’essuyer avec une serviette ou sortir de la douche ! » Après un an, le malade avait retrouvé une véritable autonomie dans sa vie quotidienne.
Thomas Borody n’étant pas neurologue, il s’en est ouvert auprès de ses collègues spécialistes qui ont confirmé l’amélioration spectaculaire de l’état du malade. Quand d’autres patients se sont présentés avec les mêmes symptômes (la constipation étant un des effets collatéraux les plus fréquents du Parkinson), il fut décidé de suivre au plus près ces malades. A ce jour, ils sont huit à avoir été ainsi traités. Un seul n’a pas répondu au traitement antibiotique. Pour tous les autres, le retour à un transit digestif normal s’est accompagné d’une régression des symptômes de la maladie de Parkinson.
L’observation clinique rejoint donc le postulat de Heiko Braak : quelque chose se trame au niveau des intestins des patients. Pour les neurologues, ce n’est pas absurde, car les intestins sont entourés d’un nombre si grand de neurones (il y en a autant que dans la moelle épinière), qu’ils ont été surnommés le « second cerveau ». Et plusieurs observations récentes renforcent encore cette idée. En 2010, une équipe de médecins français a découvert, en étudiant des biopsies de côlons de parkinsoniens, que les lésions habituellement observées dans le cerveau des malades se retrouvent à l’identique dans les neurones qui entourent l’appareil digestif…
Plus troublant encore, « il semble que les neurones intestinaux soient affectés des années avant le cerveau, et même bien avant les premiers symptômes de la maladie, explique Michael Gershon, le chercheur américain de l’université Columbia à qui l’on doit l’expression de « second cerveau ». Certains font donc l’hypothèse que la maladie de Parkinson se déclare d’abord dans les intestins avant de remonter vers le cerveau » …
A quoi ressemblerait le nouveau scénario de la maladie de Parkinson ? « Le plus probable à mon sens est que tout cela commence par une infection, sans doute d’origine alimentaire », avance Thomas Borody. « Les bactéries produisent des millions de molécules. Certaines peuvent traverser la barrière intestinale et se retrouver dans le corps humain ». C’est ainsi qu’un composé toxique atteindrait et attaquerait les neurones de l’appareil digestif.
Quelle que soit l’origine de l’infection, la toxine bloquerait la dégradation d’une protéine naturellement présente dans le corps humain, l’alphasynucléine. Chez les malades, cette protéine s’accumule jusqu’à former des structures visibles au microscope, les corps de Loewy, qui seraient la cause de la mort des neurones. Peu à peu ces agrégats de protéines se répandraient dans le système nerveux. Le moteur de cette transmission fait lui aussi l’objet de suppositions…
L’une des plus célèbres et des plus intrigantes est « l’hypothèse prion ». Le découvreur du prion, prix Nobel 1997, Stanley Prusiner, prend cette idée très au sérieux : « Il est possible que l’alphasynucléine soit une protéine prion qui forme des agrégats et se transmet à des cellules saines, propageant la maladie » écrivait-il dès 2009.
L’idée serait donc que la protéine subit un changement, chimique ou de forme tridimensionnelle et que ce soit ce changement, peut-être directement provoqué par l’infection, qui amorce la propagation des agrégats toxiques d’un neurone à l’autre. Lesquels agrégats finiraient par atteindre le cerveau, et notamment la « substance noire »… la perte des neurones entrainant les signes cliniques de la maladie. Le tout pourrait prendre plusieurs dizaines d’années. Le scénario est séduisant mais les zones d’ombre demeurent nombreuses. L’idée d’une infection sera difficile à soutenir tant qu’on n’aura pas trouvé l’agent responsable (bactérie, virus, ou toxine quelconque); le mécanisme de diffusion demeure mystérieux ; la séquence des évènements, différente chez certains patients, ne fait pas consensus, etc…
Cependant « Si l’origine digestive se confirmait, nous pourrions détecter la maladie à un stade très précoce grâce aux biopsies déjà pratiquées lors de coloscopies », estime Nicolas Bouvier, médecin-chercheur à Nantes. « Ce qui permettrait de tester à nouveau un grand nombre de molécules neuroprotectrices sur lesquelles reposaient de grands espoirs, mais qui ont été tous déçus, peut-être parce que les traitements ont été administrés à des stades trop, tardifs de la maladie ».
Dans la clinique de Thomas Borody, ont pense appliquer une technique qui a déjà fait ses preuves pour divers troubles intestinaux : la transplantation fécale. Il s’agit de transmettre la flore intestinale d’une personne saine à une personne malade. « C’est la seule solution pour se débarrasser de certaines bactéries pathogènes, explique Thomas Borody. Avec les traitements antibiotiques, il subsiste toujours des spores qui permettent aux bactéries pathogènes de revenir lorsque l’on arrête le traitement ». Et si cela marchait, cela confirmerait qu’il s’agit bien d’une histoire de bactérie. Bien plus que la validation d’une hypothèse audacieuse, ce serait un véritable changement de paradigme, fertile en perspectives thérapeutiques. Car il autoriserait de rêver à un traitement de la maladie de Parkinson avant même l’apparition des symptômes. Et quitte à rêver, pourquoi ne pas rêver aussi de transposer le concept d’infection à d’autres maladies neurodégénératives (sclérose en plaque, Alzheimer, maladie de Huntington, syndrome de Guillain-Barré) …
Mathieu NOWAK, Sciences et Vie novembre 2011
Repris par Jean GRAVELEAU graveleau.jean2@orange.fr
Informations Régionales : 29- Association De Parkinsoniens Du Finistere
Publié le 28 octobre 2011 à 07:52Article paru dans LE PARKINSONIEN INDÉPENDANT n°46 – octobre 2011
Eté pluvieux, Automne lumineux…Il faut seulement patienter !
- La rentrée, c’est la reprise de nos points rencontre mensuels à Brest, Morlaix, Quimper et Quimperlé. Nos adhérents de Brest, Quimper et depuis Janvier Ploudaniel sont ravis de retrouver leurs amis aux séances de gymnastique, une fois par semaine (voir texte de Michèle Guianvarch)
- L’appel du 18 Juin a été entendu. Nous étions 66 à Châteauneuf du Faou, réunis autour d’une bonne table. Le temps était exécrable mais les convives n’ont pas tardé à détendre l’atmosphère et à mettre de l’ambiance : histoires, chants, accordéons, danses…Une journée qui laisse de bons souvenirs.
- Pendant l’été, nous avons répondu à plusieurs enquêtes, dont une sur la maladie de Parkinson et psychomotricité. Deux étudiantes se sont déplacées auprès des adhérents de 60 ans et plus. Elles présenteront leur mémoire à Toulouse fin Septembre.
- Courant Octobre, nous organisons une journée ayant pour thème, le maintien à domicile (annulée au mois de Mai). Des intervenants du Conseil Général, de la MDPH , d’un CLIC, de l’ANAH, une ergothérapeute se succèderont et répondront aux demandes du public. Une société exposera du matériel médical pouvant aider nos malades et présentera ses nouveautés.
- La vente du livre Dans la roue de Jo Velly se poursuit. A ce jour, 836 euros ont été versés à la recherche. Un grand bravo à Jean Claude le Guéziec qui a eu cette merveilleuse initiative et qui a écrit ce livre ainsi qu’à Jo, notre champion cycliste, atteint de la maladie de Parkinson qui a bien voulu faire ses confidences. Merci !!!
- Nous participerons en Octobre au forum sur la dépendance à Quimper. Des rendez-vous sont pris auprès des CLIC, maisons de retraite, AFPA pour des réunions d’information …..Nous cherchons des volontaires pour nous aider !!!
Profitons bien de cette fin d’été et à bientôt à Piriac sur Mer.
Claire Ducros
Plan Alzheimer : l’argent, ce grand oublié
Publié le 27 octobre 2011 à 09:20Article paru dans LE PARKINSONIEN INDÉPENDANT n°46 – octobre 2011
« Un modèle pour le monde. » A la conférence internationale annuelle de l’Association Alzheimer qui se tenait ces jours-ci à Paris, c’est en ces termes que le président de l’association américaine a qualifié le plan français Alzheimer lancé en 2008. Nicolas Sarkozy n’a pas manqué de reprendre l’expression ce mercredi dans le discours en forme de bilan qu’il a énoncé devant un parterre de chercheurs du monde entier.
« Nous voulons doter la France d’un système complet sur l’ensemble du territoire français pour qu’aucun malade d’Alzheimer ne soit ignoré (…) qu’aucune famille française ne soit laissée sans assistance et nous voulons qu’aucune piste de recherche ne soit négligée », le chef de l’Etat rappelant ainsi les trois volets du plan 2008 – 2012 : la santé, la recherche et la solidarité. Et s’il s’est félicité d’avoir « dégagé en cette période de crise un budget considérable de 1,6 milliard d’euros », il ne s’est en revanche pas avancé sur son financement.
Sa décision sur la réforme de la dépendance était attendue mi-juillet, après la remise par le sénateur UMP de Loire-Atlantique André Trillard du rapport sur la prévention de la dépendance. Roselyne Bachelot a déjà rendu sa copie fin juin, avec les recommandations des quatre groupes de travail qui planchaient sur le financement du dispositif selon l’aspect sociétal, démographique, médical et financier. Du tout public au tout privé, plusieurs scénarios sont à l’étude. Les 850.000 malades français d’Alzheimer, leurs familles, les associations de soutien et structures d’aide, tous attendaient que le chef de l’Etat tranche enfin, car ils sont directement concernés puisque 70% des cas de dépendance sont causés par Alzheimer.
« Après 2 ans et demi d’expérimentation, nous sommes maintenant en phase de développement. Les 44 mesures du plan sont une bonne chose… Mais pour ce qui est de l’application, sur le terrain, c’est plus compliqué », commente Marie-Odile Desana, présidente de France Alzheimer. Son souhait serait que la maladie d’Alzheimer ne se résume pas à « un énorme problème financier » même si « pour les familles le problème est toujours le même : l’argent ». Le maintien à domicile est la solution dans 70% des cas, mais « le choix n’est pas toujours libre » : le placement en établissement coûte cher. Et c’est dans ces cas que l’aidant souffre le plus.
La présidente de l’association rappelle ainsi que « 30% des aidants meurent avant le malade ». « S’occuper d’une personne atteinte d’Alzheimer c’est 24h sur 24, l’entourage est épuisé », explique-t-elle. Il existe des dispositifs permettant de soulager les aidants, mais là encore, ils ne sont pas accessibles à tous.
« Quand on sait que la retraite d’une femme s’élève en moyenne à 850 euros par mois, comment peut-on s’offrir les services d’une auxiliaire de vie, le portage des repas à domicile, l’accueil de jour ou l’hébergement temporaire pour prendre quelques jours de vacances, dormir, aller chez le coiffeur ? », interroge Marie-Odile Desana.
Un article de Médiapart (journal numérique) faisant le bilan du plan Alzheimer (bilan assez négatif : de bonnes idées mais pas de financement, en sera-t-il de même pour le futur plan Parkinson)
Pierre LEMAY
Place de l’orthophonie dans la maladie de Parkinson
Publié le 23 octobre 2011 à 08:31Article paru dans LE PARKINSONIEN INDÉPENDANT n°46 – octobre 2011
Les signes de la MP sont la conséquence de l’atteinte du Locus Niger, petite structure du cerveau faisant partie du système extrapyramidal et entrainant la disparition des neurones qui fabriquent la dopamine. Ce système intervient dans le contrôle de tous les mouvements automatiques : posture, marche, parole, écriture.
Conséquence sur la communication :
Troubles de la voix, de la parole et du langage souvent accompagnés par des troubles de l’écriture. Après quelques années d’évolution, une dysarthrie modérée est constante. Ces troubles sont souvent précoces et apparaissent avant les troubles de la déglutition.
Signes observés :
- Dysphonie avec altérations de l’intensité vocale, du timbre, de la mélodie, du débit (voix monotone, bredouillement, intensité diminuée, timbre voilé …)
- Dysarthrie avec articulation imprécise des consonnes. Au niveau de la mâchoire, l’articulation se réduit et la différenciation entre voyelles et consonnes se fait mal (démarrage hésitant, répétition de syllabe, parfois débit de paroles accéléré, rigidité des muscles des lèvres et de la langue avec manque de coordination entre l’émission sonore et l’articulation).
- Dysphagie avec perturbations de la phase buccale, pharyngée, œsophagienne. Les troubles de la déglutition étant une complication tardive dans l’évolution avec formation difficile du bol alimentaire et contraction pharyngée insuffisante avec pour conséquence une perte d’appétit, des difficultés à avaler les médicaments. La dysphagie peut empêcher aussi que la salive soit absorbée automatiquement ; celle-ci s’accumule et peut provoquer des « bavages » en cas de mauvaise posture de la tête (tête baissée).
- Amimie avec diminution de l’expression gestuelle du visage, support habituel de la parole. Les contractions modifient l’expression faciale.
- Troubles cognitivo-visuels apparaissent au décours de la maladie avec troubles de l’attention, de la concentration, pertes de mémoire, troubles du raisonnement, limitation et lenteur du mouvement des yeux et des mouvements tête-yeux.
- Akinésie qui est un ralentissement de l’initiation du mouvement avec raideur musculaire ou au contraire hypertonie, tremblements, et entraine des troubles de l’écriture qui peut être le premier signe de l’installation de la maladie et constituer un motif de consultation médicale. L’écriture est ralentie ou micrographique, reste lisible mais peut être perturbée au point que la phrase soit illisible. Cela entraîne souvent une modification de la signature.
La perte de l’automatisme doit être remplacée par un mouvement volontaire.
Prise en charge orthophonique :
Globalement le but est de renforcer la volonté pour tenter de conserver le plus longtemps les automatismes. Après évaluation, de la dysphonie, de la dysarthrie, de la dysphagie, de l’écriture, une rééducation s’avère indispensable. Les traitements antiparkinsoniens sont efficaces pour l’amélioration de la motricité des membres mais pas efficaces pour traiter les autres problèmes.
La rééducation consistera :
- parler
- détente musculaire, relaxation
- travail du souffle abdominal et de la respiration
- travail de la verticalité, de la posture, du regard,
- travail des praxies bucco-faciales,
- travail de la déglutition afin d’éviter les pneumopathies de déglutition,
- travail vocal pour augmenter l’étendue de la voix, son expressivité
- travail de l’articulation de la parole
- travail du langage en proposant une stimulation de la parole spontanée dirigée
- texture des aliments, adaptation des apports caloriques, posture,
- comportement graphique : position du tronc, du membre supérieur concerné par l’écriture,
- participation et information de l’entourage.
L’orthophoniste informe de la façon de limiter les situations de handicap et de maintenir au mieux la motricité et préserver au maximum l’autonomie. C’est un complément indispensable à la kinésithérapie. Le malade doit devenir co-acteur de sa prise en charge.
Association Solidarités Parkinson 93
Essais cliniques et Autorisation de Mise sur le Marché (AMM)
Publié le 18 octobre 2011 à 18:36Article paru dans LE PARKINSONIEN INDÉPENDANT n°46 – octobre 2011
Le développement d’un nouveau médicament pour le traitement d’une maladie humaine est une entreprise très régulée, nécessitant des années de recherche et un important investissement en temps, en argent et en moyens humains. Le chemin à parcourir pour passer d’un produit prometteur jusqu’à l’obtention d’un médicament approuvé prend souvent de 10 à 15 ans, et la plupart des produits expérimentés (plus de 90%) ne vont jamais aussi loin.
La durée de développement du produit peut créer de l’impatience et de la frustration chez le patient et sa famille, chez les médecins, et les firmes pharmaceutiques. Mais chez tous les acteurs concernés, il y a un large assentiment pour exiger une évaluation scientifique du produit.
Après plusieurs années d’études en laboratoire, puis éventuellement des essais sur des cobayes animaux, le produit (ce candidat médicament !), devra, avant d’être autorisé à la mise sur le marché (AMM), subir un certain nombre de tests, appelés essais cliniques.
Les essais cliniques :
Les autorités gouvernementales exigent que tous les médicaments potentiels passent une série de tests avant d’être proposés aux malades. Ces tests comprennent les essais cliniques qui ont pour but d’examiner l’innocuité et l’efficacité d’un médicament potentiel. Les essais cliniques se déroulent en 3 phases successives, avant l’approbation du médicament, ces phases pouvant se superposer. Généralement, les phases se déroulent de la façon suivante :
- Phase I : Ces essais cliniques sont l’occasion de la première application du produit à des sujets humains, en fait des volontaires en bonne santé. Ces essais ont pour but de déterminer l’innocuité, les effets indésirables, la tolérance, l’absorption, la distribution, le métabolisme, l’élimination et la pharmacocinétique.
- Phase II : Ces essais cliniques sont réalisés sur un nombre limité de patients. Ils ont pour but : d’évaluer l’efficacité du médicament pour des indications spécifiques et ciblées, de déterminer le dosage toléré et le dosage optimal, d’identifier les effets indésirables possibles et les risques.
Bien qu’il n’y ait pas de définition officielle, on utilise parfois les termes Phase IIa et Phase IIb.
- La Phase IIa est utilisée pour décrire un essai clinique évaluant l’efficacité, les effets indésirables et les risques sanitaires.
- La Phase IIb, succédant à IIa, elle évalue la tolérance au dosage, la fréquence optimale du dosage, et cela sur un nombre de patients plus important que dans la phase IIa.
Ces essais de Phase II concernent pour la première fois des patients atteints de la maladie. Ces patients sont répartis de façon aléatoire (random) en 2 groupes, l’un recevant le produit, l’autre un placebo et selon une procédure en double aveugle. Les résultats des patients des 2 groupes sont comparés à la fin de l’essai.
- Phase III : Si on trouve que le produit est potentiellement efficace et présente une innocuité acceptable dans l’essai de Phase II, le programme des essais cliniques sera étendu pour démontrer l’efficacité, le dosage optimal et l’innocuité du produit et cela sur une population étendue de malades sur des sites dispersés géographiquement. En fait, les essais de Phase III concernent de plusieurs centaines à plusieurs milliers de patients, selon la maladie et l’importance espérée de l’effet du produit.
Par ailleurs, plus l’efficacité du produit est faible, plus le nombre de patients de l’essai III devra être élevé. Comme en Phase II, les patients sont répartis de façon aléatoire en 2 groupes, selon la procédure en double aveugle, pour une comparaison patients avec produit/patients avec placebo.
- Phase IV : Nous citerons pour mémoire la Phase IV qui recouvre les essais sur le médicament après sa mise sur le marché.
L’autorisation de mise sur le marché (AMM)
L’autorisation de mise sur le marché ou AMM est l’accord donné à un médicament pour être commercialisé. Lorsqu’un laboratoire pharmaceutique désire mettre en vente un produit de santé (médicament, produit d’analyse, etc.), il doit présenter un dossier auprès de l’autorité compétente du pays concerné : l’Agence Française de Sécurité Sanitaire des Produits de Santé (AFSSAPS) pour la France, la Food and Drug Administration (FDA) aux Etats Unis, l’Agence Européenne des Médicaments (EMEA) en Europe. Le dossier déposé auprès de l’autorité compétente est établi à partir des résultats obtenus à l’issue des essais de Phase III.
Cet article a été rédigé à partir des articles cités en bibliographie, traduits et résumés.
Jean Pierre LAGADEC
Bibliographie :
— Site Internet de Santhera Pharmaceuticals à la rubrique Fipamezole
— Discovering and Developping New Medications, The long and challenging journey de William T Andrews
Vers un traitement pour la maladie de Parkinson ?
Publié le 17 octobre 2011 à 07:41Article paru dans LE PARKINSONIEN INDÉPENDANT n°46 – octobre 2011
Les patients atteints de la maladie pourraient être soignés grâce à des cellules issues de leur peau.
Un article, paru dans le New Scientist du 7 juillet 2011, rapporte que Vania Broccoli de l’Institut Scientifique San Raffaele à Milan en Italie et ses collègues auraient trouvé un moyen de transformer des cellules de peau en neurones spécialisés pouvant fabriquer de la dopamine. Ce neurotransmetteur situé dans notre cerveau, dont les patients atteints de la maladie de Parkinson en sont déficients, est à l’origine de notre mobilité. En rétablissant le niveau de production de la dopamine à la normale, la mobilité des patients pourrait nettement s’améliorer. Bien que les virus utilisés ne puissent pas perturber l’ADN et causer le cancer, l »équipe précise toutefois qu’elle a dû d’abord infecter les cellules de la peau pour réaliser les facteurs de transcription.
« Notre objectif est d’utiliser des cellules de souris en premier, puis les cellules humaines dans des souris », explique Vania Broccoli. « Si cela fonctionne, nous allons passer à des modèles de singe de la maladie. » Son équipe essaie également d’évaluer quelles méthodes de reprogrammation des cellules de peau pourraient passer par des virus sans aucun risque pour les receveurs humains.
Article transmis par Sylvain BIELLE
Plus de clairvoyance pour la recherche causale
Publié le 14 octobre 2011 à 14:55Article paru dans LE PARKINSONIEN INDÉPENDANT n°46 – octobre 2011
Par le professeur Dr. Peter JENNER
Director du Neurodegenerative diseases Research Centre of School Of Health and Biomedical Sciences, King’s College, Londres
Traditionnellement, la maladie de Parkinson est associée à la dégénérescence des neurones dopaminergiques dans la substantia nigra et à la perte de dopamine striatale qui en résulte, facteur déclenchant des symptômes moteurs. Un point de vue qui explique pourquoi depuis près de quarante ans, la substitution de la dopamine manquante par l’administration de levodopa ou d’agonistes dopaminergiques constitue la clé de voûte du traitement antiparkinsonien. Un point de vue parfait dont la véracité n’est pas contestée, mais qui, comme nous le savons aujourd’hui, est nettement insuffisant.
En réalité, la maladie de Parkinson est définie par une multitude d’altérations pathologiques – dans le cerveau comme dans les organes périphériques – et par de nombreuses anomalies biochimiques cérébrales qui résultent des altérations pathologiques primaires ou des adaptations consécutives à la perte de dopamine.
Tout cela modifie également l’équilibre de différents autres systèmes neurotransmetteurs, qui à leur tour contribuent au déclenchement des symptômes moteurs ou non-moteurs du Parkinson. S’ajoutent à cela les fluctuations motrices (phénomène de « wearing-off » et phases « on/off ») et les complications motrices qui accompagnent le traitement médicamenteux et la progression de la maladie.
La multiplicité des facteurs cités et leur influence contradictoire explique la complexité de la maladie de Parkinson et le nombre de difficultés que doivent surmonter les médecins quand ils essaient de contrôler au mieux les différents aspects du tableau clinique très individuel du Parkinson.
Tout inconvénient manifeste n’en est pas un.
Nombre de ceux qui ont commencé la lecture de cet article ne souhaitent pas poursuivre au-delà de ce point. L’espoir de pouvoir isoler et analyser les relations très complexes décrites précédemment semble trop faible pour permettre une compréhension détaillée de la situation. Cependant, si abstrus que cela semble, c’est précisément de la complexité du Parkinson que pourrait découler une nouvelle approche pour le futur traitement médicamenteux d’une maladie qui est davantage un syndrome tout entier.
Ci-après, je souhaite notamment développer la conscience du fait que les processus de La maladie de Parkinson dépassent largement une simple baisse du taux de dopamine striatale et que les traitements futurs devraient suivre une approche « intégrale » afin d’obtenir une normalisation globale du déséquilibre des transmetteurs occasionné par la maladie de Parkinson.
La pathologie du Parkinson
Quiconque sort de l’arène dopamine pour la première fois découvre rapidement l’ampleur et la complexité du tableau pathologique du Parkinson. La perte des neurones n’a pas lieu seulement dans le système dopaminergique. Elle concerne également différents systèmes monoaminergiques, parmi lesquels le locus coeruleus et les noyaux du raphé. Elle conduit à une baisse de la concentration en noradrénaline et en sérotonine (5‑HT) (deux substances transmettrices comme la dopamine) dans différentes zones du cerveau.
Par ailleurs, les dites projections cholinergiques corticales dégénèrent dans le prosencéphale. Il s’agit d’altérations pathologiques bien documentées, clairement identifiable en tant que Parkinson par la présence de corps de Lewy. Les caractéristiques pathologiques dans les noyaux olfactifs, dans le noyau dorsal du nerf vague et du noyau pédonculopontin génèrent des altérations de l’innervation dans le tronc cérébral, le mésencéphale et le prosencéphale par les neurotransmetteurs acétylcholine, glutamate et GABA (acide gamma-aminobutyrique).
Une telle analyse détaillée des pertes de neurones dans le cerveau montre clairement qu’en cas de Parkinson, les neurones disparaissent dans des régions très différentes du cerveau – c’est la raison pour laquelle différents systèmes de transmission sont atteint.
Tout ceci indique que la maladie de Parkinson est caractérisée par des altérations pathologiques complexes qui ne concernent pas uniquement la dopamine, mais bien plusieurs neurotransmetteurs.
Malheureusement, personne ne sait très précisément comment tout cela mène aux symptômes du Parkinson. Cependant, étant donné que la maladie de Parkinson comporte des symptômes moteurs et non-moteurs qui réagissent très mal, voire pas du tout à la médication dopaminergique, il est fort possible que ces symptômes résistants à la thérapie émanent de la perte de neurones non-dopaminergiques en dehors des ganglions de la base – et soient donc imputables à un déséquilibre dans un autre système de transmission.
Cette hypothèse semble d’autant plus probable que l’on sait aujourd’hui que d’autres neurotransmetteurs – tels que la noradrénaline, la sérotonine (5‑HT) et l’acétylcholine – interagissent de manière complexe avec les neurones dopaminergiques et jouent par conséquent, selon toute vraisemblance, un rôle dans les aspects moteurs de la maladie de Parkinson. En outre, le lien entre les caractéristiques pathologiques dans les régions non-dopaminergiques du cerveau et la progression lente de la maladie, pourrait être d’une importance capitale. A cet égard, nous sommes à présent contraints de penser de manière non conventionnelle.
La maladie se déclare-t-elle tout à fait ailleurs ?
Jusqu’à présent, la recherche des causes du Parkinson mettait l’accent sur la substance noire et la perte de neurones dopaminergiques. Une approche qui pourrait se révéler fausse. En effet, certaines observations indiquent que la maladie n’apparaît ni dans la substance noire, ni dans les ganglions de la base !
Au contraire, on suppose qu’il s’agit plutôt d’une pathologie systémique qui trouve son origine dans les organes périphériques, chemine via le système nerveux central dans le tronc cérébral, s’étend dans le cerveau et seulement ensuite atteint les neurones dopaminergiques de la substance noire avant que les neurones cholinergiques qui alimentent le prosencéphale soient détruits.
Certes, ce scénario est controversé – mais le concept de maladie progressive correspond parfaitement bien aux nombreuses altérations pathologiques et biochimiques et au fait que les symptômes moteurs n’apparaissent que relativement tard dans l’évolution de la maladie et qu’ils sont précédés par toute une série d’aspects non-moteurs tels que la constipation, la perte d’odorat, les jambes sans repos, les troubles du comportement dans le sommeil paradoxal, les dépressions et les états anxieux.
Altérations adaptatives
Pour en revenir à la perte primaire de neurones dopaminergiques dans la substance noire, il s’avère que des altérations adaptatives dans les processus biochimiques apparaissent d’une part dans les réseaux des ganglions de la base, et d’autre part dans les boucles qui commandent les mouvements volontaires via le thalamus, le cortex-moteur et en retour vers les ganglions de la base. En d’autres termes : si l’alimentation en dopamine des ganglions de la base vis la substance noir est perturbée, l’activité des neurones qui utilisent les autres transmetteurs que la dopamine (par ex. : l’acétylcholine, le glutamate ou le GABA) est obligatoirement modifiée. Et ce parce que les neurones des ganglions de la base sont agencés dans des chaînes alignées ou parallèles, qui traitent les informations motrices, sensorielles ou cognitives et permettent les mouvements contrôlés par le biais de boucles avant et arrière.
Ou plus simplement : en cas de Parkinson, la perte de dopamine modifie parallèlement l’activité électrique des neurones, au-delà de la voie dopaminergique endommagée ! La libération des neurotransmetteurs qui acheminent les signaux entre les neurones successifs de la chaîne est également transformée. Ainsi, la perte de dopamine dans les ganglions de la base génère également des modifications dans la transmission du signal par l’acétylcholine, le glutamate et le GABA. Cela explique pourquoi des médicaments, tel l’Amantadine, antagoniste des récepteurs NMDA, et le benzhexol, antagoniste de la muscarine, qui agissent sur d’autres systèmes de transmission que le système dopaminergique, peuvent influencer les symptômes du Parkinson. L’action positive d’une pallidotomie et de la stimulation cérébrale profonde s’explique.
Que signifie tout cela ?
La substitution traditionnelle de la dopamine par la L‑dopa permet sans aucun doute une amélioration drastique des symptômes moteurs du Parkinson et, dans une certaine mesure, des problèmes non-moteurs tels que les troubles du sommeil, les altérations de la perception sensorielle et les dépressions.
De grands défis doivent encore être relevés lors du traitement de toute la gamme des composantes pathologiques motrices (marche, équilibre) et – notamment – de nombreux aspects non-moteurs (capacités cognitives, langage, comportement obsessionnels, douleurs), et des complications motrices connues (dyskinésies, freezing) et des fluctuations. Pour un meilleur contrôle thérapeutique, nous devons toutefois regarder et penser plus loin et créer de nouvelles conditions dans lesquelles les altérations neuronales à la fois dopaminergiques et non-dopaminergiques peuvent être abordées – et ce à l’intérieur comme à l’extérieur des ganglions de la base. En matière de traitement médicamenteux, nous devons donc adopter une approche intégrative, globale.
Il est éventuellement envisageable de cibler individuellement les systèmes non-dopaminergiques, dont on sait qu’ils sont touchés par la maladie de Parkinson. Des tentatives sont déjà conduites actuellement, avec des médicaments qui agissent sur les récepteurs de la sérotonine (sarizotan), de la noradrénaline (fipamezole) et de l’adénosine (istradéfylline, preladenant). Cependant, à ce jour ces substances ne constituent qu’un complément au traitement dopaminergique. Les patients doivent donc prendre encore plus de pilules et ces dernières n’apportent jusqu’à présent que peu de progrès.
A la recherche de « la » superpilule
Le plus grand espoir reposerait sur les médicaments multifonctionnels, qui combinent plusieurs effets pharmacologiques, remplacent la dopamine tout en stabilisant et en normalisant les anomalies des transmetteurs sur lesquelles reposent de nombreux symptômes de la maladie de Parkinson.
Toutefois, compte tenu de la complexité des liens de causalité, il est plus difficile de savoir comment une telle action intégrale doit être visée. La transmission de l’activité électrique des neurones pourrait être une possibilité. Elle est définie par le travail des dits canaux ioniques, qui régulent le flux du calcium, du potassium et du sodium vers les neurones et en dehors des neurones. Ce mécanisme général, qui est valable pour de nombreux types de neurones différents, pourrait offrir la future génération de molécule pour le traitement de Parkinson.
Des expériences prouvent le potentiel de tels concepts futuristes. Elles démontrent que les modifications de l’activité des canaux sodiques dans le sous-thalamus peuvent provoquer des améliorations des composantes cliniques de Parkinson qui ne peuvent aujourd’hui être contrôlées que par des interventions chirurgicales. Une autre application pourrait toutefois en résulter : une normalisation de la fonction neuronale dans l’ensemble du cerveau.
Malheureusement de tels médicaments restent jusqu’à présent un pur concept – et sont loin d’être disponibles. Il ne fait toutefois aucun doute que considérer le cerveau dans sa globalité fait davantage avancer la recherche que de se concentrer sur le seul système dopaminergique. Le Parkinson est beaucoup trop complexe pour cela.
Source : EPDA Plus, n°14 2010
Dans la revue Parkinson Suisse N°102 de juillet 2011
Lu par Jean GRAVELEAU
La Recherche : un long parcours…
Publié le 12 octobre 2011 à 08:25Article paru dans LE PARKINSONIEN INDÉPENDANT n°46 – octobre 2011
C’est fin 1999 que la recherche sur la Xénotransplantation a débuté, à l’INSERM de Nantes sous la direction de Philippe BRACHET. CECAP RECHERCHE avait alors subventionné le jeune chercheur Benoît MELCHIOR.
Depuis plus de 10 ans maintenant… Cela prouve que le chemin est long et parsemé d’embûches pour arriver à un résultat satisfaisant pour les malades ? Que de paramètres à vérifier, de stratégies à confirmer…
Première étape de cette recherche : la création d’un porc transgénique
Philippe BRACHET écrivait dans le Parkinsonien Indépendant N° 24 de mars 2006 :
Près de 5 ans ont été nécessaires pour obtenir deux animaux transgéniques, après 2.286 injections d’œufs ensuite réimplantés dans des truies, qui ont abouti à la naissance de 151 porcelets seulement, dont 2 présentaient les propriétés recherchées.
Tout cela pour dire que la Recherche est toujours un grand espoir mais qu’il faut s’armer de patience pour en constater un résultat définitif et probant.
Donc PATIENCE, ne nous emballons pas aveuglément sur des annonces alléchantes que l’on croirait définitives pour notre bien. Wait and see (attendre et voir) disent les Anglais.
Lire dans ce numéro l’article très intéressant : « Plus de clairvoyance pour la recherche causale »
Xénotransplantation : les anticorps contre-attaquent !
Publié le 09 octobre 2011 à 22:44La maladie de Parkinson est une maladie progressive caractérisée par la dégénérescence bilatérale des neurones dopaminergiques de la substance noire. La destruction des neurones dopaminergiques de la substance noire se projetant dans le striatum a pour conséquence une diminution de la sécrétion de dopamine au niveau de cette structure. Ce déficit en dopamine est à l’origine des principaux troubles caractéristiques de la maladie de Parkinson.
Actuellement, il n’existe pas de traitement curatif de la maladie, mais différents traitements symptomatiques sont utilisés. L’administration par voie orale de L‑DOPA (lévodopa), précurseur de la dopamine capable de traverser la barrière hématoencéphalique, est l’un des plus couramment prescrits. Un inconvénient majeur de la prise de L‑DOPA est l’apparition, au bout de quelques années, de dyskinésies (mouvements anormaux) qui aggravent fortement le handicap du malade. Plus récemment, une stratégie basée sur la stimulation électrique du noyau subthalamique, entre autre, a été développée. Son efficacité sur les troubles moteurs est assez spectaculaire, dans la plupart des cas, mais les risques chirurgicaux et les critères d’inclusion en font une opération accessible à un très faible nombre de patients. De plus, de nombreux symptômes ne sont pas corrigés par ces thérapies.
Aussi, il apparaît important de poursuivre les recherches sur les stratégies restauratrices, notamment la greffe intracérébrale de neuroblastes.
Des neuroblastes mésencéphaliques issus d’embryons humains (8 à 9 semaines) et transplantés dans le striatum de patients parkinsoniens ont conduit à des améliorations cliniques basées notamment sur la production de dopamine par les neurones greffés. Cependant, le recours à des embryons d’origine humaine pose des problèmes éthiques et logistiques, notamment dus au fait que 7 à 8 embryons sont nécessaires pour réaliser ces greffes. D’où l’intérêt d’utiliser des neuroblastes d’origine animale et en particulier porcine. En effet, le porc présente de nombreux avantages pour la xénotransplantation : un grand nombre d’embryons à chaque portée, une facilité d’élevage, la possibilité de contrôler la reproduction des animaux et de pouvoir pratiquer des manipulations génétiques. De plus, son cerveau étant de grande taille, les neurones porcins ont la capacité d’émettre des neurites sur de longues distances comme chez l’Homme. Une survie des cellules greffées, une réinnervation du striatum ainsi qu’une récupération des fonctions motrices ont été observées lors d’essais cliniques menés chez certains patients parkinsoniens traités par des immunosuppresseurs (molécules permettant de limiter l’activité du système immunitaire). Mais le problème rencontré reste le rejet de ces greffes.
En effet, en l’absence d’immunosuppresseur comme la cyclosporine A, les greffes de neuroblastes porcins dans le striatum de rat sont rejetées au bout de 7 – 8 semaines. Les traitements par des immunosuppresseurs prolongent la survie de la greffe, mais de manière transitoire, de plus, utilisés à fortes doses, ceux-ci entraînent des effets secondaires, notamment une toxicité rénale. Il est donc important de comprendre et d’étudier les mécanismes en cause dans le rejet pour envisager une survie à long terme de la greffe.
Diverses études ont mis en évidence un rôle important de la réponse immunitaire cellulaire dans le rejet. L’analyse de xénogreffes chez le rat a révélé un recrutement précoce des cellules dendritiques Ces cellules, connues pour leur rôle dans la présentation des antigènes, pourraient favoriser le recrutement de lymphocytes T dans le cerveau. En effet, en l’absence d’immunosuppresseur, on observe vers 7 à 8 semaines, une forte infiltration de la greffe par des lymphocytes T et des cellules dendritiques. Cette réaction immune est accompagnée d’une activation des cellules microgliales. Elle a pour conséquence le rejet de la greffe.
Outre la réponse cellulaire, il a été observé un dépôt d’anticorps et de complément au niveau du greffon. Cette observation suggère une réponse humorale, caractérisée par la production d’anticorps dirigés contre la greffe, qui, à ce jour, a été très peu étudiée.
Nos travaux au sein de l’INSERM U643 ont pour but d’étudier la réponse humorale lors de xénogreffes. Pour cela, nous nous intéressons à l’analyse de la production d’anticorps dans le sérum de rats greffés avec des neuroblastes porcins.
Les anticorps produits suite à la greffe vont venir se fixer sur les cellules porcines du greffon et le détruire. Nous avons pu mettre en évidence que la production d’anticorps augmentait en fonction du délai post greffe et du statut de la greffe. En particulier, une forte concentration d’anticorps est observée dans le sérum de rats pour qui la greffe est rejetée.
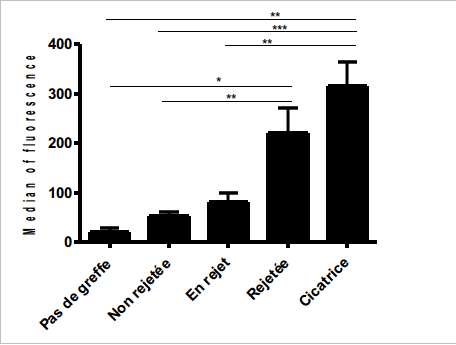
De plus, ces anticorps ont la capacité de cibler différentes populations cellulaires tels que les neurones et les astrocytes. Nous essayons maintenant de déterminer dans quelle mesure cette réponse humorale est importante dans le phénomène du rejet par le suivi de la survie de la greffe chez des rats ne possédant plus d’anticorps. En effet, il est important de pouvoir visualiser quelle est la balance dans le rejet entre les réponses immunitaires cellulaire et humorale. Ces données nous permettront de mieux comprendre le rejet dans le but final de développer des stratégies immunosuppressives locales pouvant intervenir sur les deux types de réponse immunitaire afin de permettre une survie de la greffe à plus long terme.
Je tenais à remercier tous les membres de l’association CECAP pour leur soutien dans la réalisation de ce travail.
Elodie MATHIEUX – INSERM 643 Nantes
Les pesticides à nouveau mis en cause
Publié le 07 octobre 2011 à 08:31Article paru dans LE PARKINSONIEN INDÉPENDANT n°46 – octobre 2011
Parmi les publications de ces dernières années, diverses études montraient qu’une exposition prolongée aux pesticides entraînait un risque accru de Parkinson. A ce propos, des chercheurs américains ont, pour la première fois, analysé les liens de cause à effet. Il semblerait que la substance active roténone bloque le développement des mitochondries et empêche la production d’énergie cellulaire. Le paraquat, quant à lui, intensifie la formation de dérivés de l’oxygène qui endommagent les structures cellulaires. D’après les auteurs de l’étude, les personnes qui ont été exposées aux pesticides précités courent un risque 2.5 fois plus grand d’être touché par la maladie que les autres.
Source : National Institut of Health
Articles lus dans le Parkinson suisse n°102 de juillet 2011 par Jean GRAVELEAU
Risque de démence et Parkinson
Publié le 05 octobre 2011 à 09:48Article paru dans LE PARKINSONIEN INDÉPENDANT n°46 – octobre 2011
Le Parkinson est souvent associé à des problèmes neuropsychologiques et neuropsychiatriques dont la prévalence augmente avec l’âge. C’est ce qu’à rapporté le Professeur Heinz Reichmann, de Dresde, lors du congrès Parkinson 2011 à Kiel. Il a fait référence à une étude réalisée sur 1 300 patients âgés de 66 à 75 ans, dont 38% souffraient de démence, 35% de dépression et 18% de psychose. Seul un tiers des patients n’étaient atteints d’aucun trouble. D’autres études confirment que le risque de démence est multiplié par six pour les patients parkinsoniens. M. Reichmann explique que 25% des patients développent une démence huit ans après le diagnostic, 50% douze ans après et plus des deux tiers seize ans après – celle-ci se manifestant aux environs de la 70ème année, indépendamment de la durée de la maladie. Une étude de 2005 donne les mêmes résultats : au bout de quinze années, environ un tiers des 149 patients participants vivait encore. 50% souffraient d’une démence, l’autre moitié de dépressions et d’hallucinations.
Article lu dans le Parkinson suisse n°102 de juillet 2011 par Jean GRAVELEAU
Les résultats encourageants d’une thérapie génique
Publié le 04 octobre 2011 à 12:55Article paru dans LE PARKINSONIEN INDÉPENDANT n°46 – octobre 2011
De nouveaux espoirs pour les parkinsoniens dont les symptômes ne réagissent pas aux traitements médicamenteux traditionnels : à l’avenir, une thérapie génique pourrait permettre de limiter les troubles moteurs.
Les neurologues de l’équipe du professeur Peter A. LeWitt de Bloomfeld (Etats-Unis) ont franchi une étape supplémentaire dans le développement d’une thérapie génique pour traiter les symptômes moteurs du Parkinson résistants au traitement.
Dans le cadre d’une étude en double aveugle contrôlée contre placebo, ils ont introduit un gène de l’enzyme glutamate-décarboxylase (DAB) dans le cerveau de 22 patients. Des expérimentations sur des animaux ont déjà prouvé que ce gène pouvait intensifier l’activité du neurotransmetteur GABA (acide gamma-aminobutyrique) dans le noyau sous thalamique, qui participe au contrôle de la motricité dans le cerveau. Le groupe témoin était composé de 23 patients parkinsoniens. Ils ont également subi toutes les interventions chirurgicales, mais une injection de sérum remplaçait celle du gène. L’âge des participants allait de 30 à 75 ans. Tous souffraient du Parkinson depuis au moins 5 ans.
Résultats d’une première étude
Les résultats de l’étude, publiés au mois de mars 2011 dans l’édition en ligne du magazine spécialisé The Lancet Neurology, sont encourageants : chez les patients traités par le gène, les fonctions motrices d’après l’échelle UPDRS (United Parkison’s Disease Rating Scale) se sont améliorées de 23% en l’espace de six mois, contre 12.7% chez les patients du groupe témoin. Les symptômes ne se sont aggravés chez aucun des patients traités – contrairement à quatre patients du groupe témoin.
Cette étude confirme ainsi dans une large mesure les résultats d’une étude réalisée en 2007 sur cette thérapie génique. A l’époque, il n’y avait pas de groupe témoin et les sceptiques avaient crié à l’effet placebo.
Bien que tous les patients ne se soient plaints que de légers effets secondaires tels que des céphalées et de la nausée, d’autres chercheurs, tels que Michael Hutchinson de la New York University School of Medicine, modèrent les espoirs et évoquent la possibilité d’une réponse négative. « Personne ne sait combien de temps les effets durent. Par ailleurs, un virus adéno-associé inoffensif a été utilisé comme vecteur génétique pour intégrer le gène. Toutefois, personne ne peut dire quelles séquelles à long terme il peut avoir », explique-t-il. Dans un commentaire sur l’étude publié dans The Lancet Neurology, M. Hutchinson écrit que les résultats de l’amélioration des symptômes par la stimulation cérébrale profonde (stimulateur neurologique), qui a également lieu dans le noyau sous-thalamique, sont jusqu’à deux fois meilleurs que ceux que permet la thérapie génique.
Source : www.thelancet.com
Pourquoi j’ai arrêté l’Azilect®
Publié le 25 juillet 2011 à 07:23Article paru dans LE PARKINSONIEN INDÉPENDANT n°45 – juillet 2011
Fin septembre 2010, mon neurologue me prescrit un Azilect® pour compléter mon traitement (5 Modopar125®, 5 Comtan® et 10 Dopergine®) avec lequel je me sentais plutôt bien. Sans doute a‑t-il voulu me « protéger » de l’usure des neurones dopaminergiques. Je respecte donc sa prescription.
Mais, depuis quelques semaines, je constate un état de plus en plus désagréable. J’ai une impression de dépression permanente telle qu’elle se révèle en phase Off : des idées noires d’inutilité sociale, des questionnements autour du suicide, des impressions de vide…
A cela, s’ajoute une lourdeur permanente qui me donne l’impression d’être velléitaire, sans volonté, atone. Je n’ai goût à rien et il me faut faire des efforts considérables pour simplement vivre, m’entretenir, tenir ma maison… Au moindre effort physique, j’ai les jambes en flanelle. Et puis, je me trouve confronté à une sexualité en berne : je n’ai plus de réelles érections. J’imagine que c’est l’andropause qui me touche et pourtant ma libido reste éveillée ! Quant au transit intestinal, il est devenu un peu compliqué m’obligeant à utiliser des moyens artificiels (Microlax®). Et ne parlons pas des nuits de six heures entrecoupées de réveil toutes les deux heures, ce qui provoque bien évidemment, des siestes dans la journée.
Cela me devient rapidement insupportable, moi qui, jusqu’à présent, ai réussi à ne pas me laisser dominer par la maladie. Mon amie kiné me trouve physiquement moins performant : je présente des petits effets secondaires de dyskinésies inhabituelles et des difficultés à exécuter correctement des mouvements jusque là sans problème pour moi. Elle m’interroge sur mon traitement me suggérant que celui-ci a peut-être changé mon attitude face à la maladie.
Un petit évènement va, le 17 février, me mettre la puce à l’oreille : en déplacement, j’ai oublié de prendre mon comprimé d’Azilect® et, en fin de journée, je me sens plutôt mieux moralement. Mais je ne réagis pas tout de suite à cet indice. Je vais attendre quelques jours avant de décider d’interrompre volontairement la prise de ce médicament le 25 février 2011 après 5 mois d’essai.
Aujourd’hui, je me retrouve dans la position d’il y a quelques mois où, certes, j’ai quelques difficultés mais si minimes qu’elles en sont tout à fait tolérables. Je me sens revivre correctement par rapport à cette période pénible que je viens de vivre. Bien évidemment, j’en ai averti mon neurologue qui a approuvé ma décision (pour lui, un tiers environ des patients n’éprouvent rien ; 40% ont un effet symptomatique positif ; les autres se sentent moins bien, plus somnolents ayant parfois des troubles de l’humeur à tendance dépressive).
Loin de moi l’idée de dénigrer l’intérêt de l’Azilect®, je ne veux que donner ma petite expérience et dire à chacun qu’il est indispensable de se bien connaître et de ne pas hésiter à remettre en cause les données énoncées par les prescripteurs. C’est notre maladie : nous devons nous appuyer sur nos propres troubles pour nous guider dans l’organisation de nos traitements. Tout cela avec beaucoup de précaution et en laissant le temps faire son effet.
Par Jean GRAVELEAU
Louise BEYER, psychanalyste, témoigne à propos de sa maladie
Publié le 21 juillet 2011 à 09:17Article paru dans LE PARKINSONIEN INDÉPENDANT n°45 – juillet 2011
Mettre des mots sur la maladie me parait nécessaire. Je suis psychanalyste et depuis 5 années j’ai la maladie de Parkinson et je ne me dis pas parkinsonienne. Le danger serait de s’identifier à la maladie comme étant victime d’elle et de ce fait en perdre mon statut de sujet pour devenir objet d’elle, ce qui peut contribuer à la dépression. Comprendre la place que j’occupe, le regard qu’il me faut réadapter. Je crois énormément à l’aide pluridisciplinaire, homéopathie, acuponcture, kinésithérapie et travail thérapeutique.
J’aimerai cependant poser une question ? Il me semble qu’un facteur psychologique peut intervenir. De quelle manière je n’en sait rien, mais j’ai constaté que la maladie de Parkinson mettait en exergue chez certaines personnes un oubli de soi, un don de soi comme seul moyen d’existence, ne s’autorisant pas à vivre pour elles comme si la maladie mettait en exergue que derrière ce don de soi elles espéraient qu’on les autorise à vivre leur désir et qu’on reconnaisse leur fragilité et leur difficulté à sortir du lien de dépendance à l’autre que le don de soi travestissait.
Cette prise de conscience est douloureuse pour la personne qui en prend conscience, mais libératrice aussi, car elle n’est pas jugée mais écoutée. Comme si, ironie du sort, la maladie remettait en scène le désir qu’on s’occupe aussi d’elle. Plus que dans toute autre maladie, l’émotionnel à fleur de peau fait revivre la peur de l’abandon et la dépression qui s’en suit parle, me semble-t-il, d’un désir inavoué celui d’abandonner notre désir de sauver l’autre par peur qu’il nous abandonne.
C’est une hypothèse, parmi tant d’autres, disons que je l’ai entendue chez certaines personnes ce qui n’en fait pas une généralité, juste une piste de réflexion. Parkinson a du sens pour chacun et le meilleur moyen de ne pas sombrer c’est d’essayer de comprendre ce que la maladie (le mal à dire) nous révèle sur nous-mêmes pour convertir le ressentiment qu’on peut éprouver en ouverture sur soi et par extension aux autres.
Il y a de saintes colères. Une fois exprimées, on peut passer à autre chose, montrer une nouvelle image de Parkinson même si le physique n’est plus aussi dynamique. Il y a en nous une autre force qu’il faut solliciter et ça, ça dépend de notre désir de vivre la maladie soit comme une victime soit comme acteur de ma vie malgré les malgré.
Cela peut se faire aussi grâce à tous ceux et celles qui nous encouragent à rester solidaires et à partager notre vécu, nos talents, à parler de Parkinson au plus près de son ressenti. Parler de tout cela peut être une aide pour la recherche aussi car qui peut parler le mieux d’elle, c’est celui qui en est atteint et qui décide de faire équipe avec Parkinson. Puisque Parkinson s’est imposé à moi autant ne pas m’en faire un ennemi mais un drôle d’ami.
Tout cela pour vous dire merci d’expliquer la maladie avec des mots simples. Donnons lui la iplace pour mieux l’apprivoiser et toute initiative est une pièce de plus au puzzle de la vie. Ce n’est pas de ma place d’analyste que je parle mais de la place à laquelle Parkinson m’a invité. Changer mon regard sur la maladie, sur moi et sur les autres, est une autre manière de ne pas répondre à ce qui peut nous entraîner à une fermeture sur nous-mêmes, qui nous ferait encore plus souffrir et qui ferait souffrir ceux à qui nous montrerons leur impuissance à nous soulager.
Jusqu’à notre mort, nous serons des personnes vivantes et nous avons besoin de toutes ces personnes, soignants, aimants, croyants à la vie qui nous habite. Alors merci à chacun, à la science, aux progrès de tous ceux qui comme vous insufflez la vie. Merci pour votre conférence (Conférence de Anne FROBERT du 17 avril 2004, paru dans le Parkinsonien Indépendant N°17-juin 2004).
Par Louise BEYER — 22 février 2011
Propulsé par WordPress et le thème GimpStyle créé par Horacio Bella. Traduction (niss.fr).
Flux RSS des Articles et des commentaires.
Valide XHTML et CSS.